Введение
Несмотря на доступность современных антибиотиков и эффективных вакцин, внебольничная пневмония (ВП) остается широко распространенным и потенциально жизнеугрожающим заболеванием. Согласно результатам современных эпидемиологических исследований, заболеваемость ВП у взрослых составляет 3–40 ‰, около 50 % из числа которых госпитализируются. При этом каждый 10-й госпитализированный пациент с ВП в силу исходно тяжелого или осложненного течения заболевания помещается в отделение интенсивной терапии (ОИТ). И если летальность среди амбулаторных больных, как правило, не превышает 0,5 %, госпитальная летальность достигает 14 % и более [1].
Диагностика
Едва ли не основным, на который необходимо ответить практикующему врачу при ведении пациента с респираторной инфекцией, является вопрос: пневмония – есть или нет, ложноотрицательная диагностика которой может привести к драматическим последствиям. Решение этого вопроса осложняется тем обстоятельством, что до настоящего времени отсутствует “золотой стандарт” диагностики ВП, клинические проявления которой зачастую оказываются весьма близкими к таковым небактериальных инфекций нижних дыхательных путей (острого бронхита). При этом в структуре инфекций нижних дыхательных путей ВП занимает “скромные” 4– % и даже такой традиционный предиктор бактериальной инфекции, как гнойная мокрота, не снимает остроты проблемы дифференциальной диагностики в ряду инфекций нижних дыхательных путей. Так, из 10 взрослых остролихорадящих больных, которых в течение 1– недель беспокоит кашель с отхождением гнойной мокроты, в 9 случаях пневмония отсутствует [2].
В связи с этим, очевидно, необходимо знание унифицированных критериев диагноза ВП, представленных, в частности, на страницах согласительных рекомендаций Российского респираторного общества (РРО) и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) в 2010 г. [3].
Диагноз ВП является установленным при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и по крайней мере двух клинических признаков из числа следующих (табл. 1):
а) острое лихорадочное начало заболевания (температура тела ≥ 38,0 °С);
б) кашель с мокротой;
в) физические признаки пневмонической инфильтрации: фокус(ы) крепитации и/или мелкопузырчатых хрипов, жесткого/бронхиального дыхания, укорочение перкуторного звука и др.;
г) лейкоцитоз (> 10 х 109) и/или палочкоядерный сдвиг (> 10 %).
При этом следует учитывать вероятность наличия известных синдромосходных заболеваний (острой эозинофильной пневмонии, инфаркта легкого на почве тромбоэмболии ветвей легочной артерии и др.).
Таблица 1.Критерии диагноза внебольничной пневмонии [3].
Отсутствие или недоступность рентгенологического подтверждения очаговой инфильтрации в легких (рентгенография или крупнокадровая флюорография органов грудной клетки) делает диагноз ВП неопределенным, который в данной клинической ситуации основывается на учете эпидемиологического анамнеза, жалоб и соответствующих локальных симптомов.
Если же при обследовании пациента с лихорадкой, жалобами на кашель, отделением мокроты и/или с болью в груди рентгенологическое исследование органов грудной клетки оказывается недоступным и отсутствует локальная симптоматика, предположение о ВП становится маловероятным.
Выбор места лечения
Почти все основные решения относительно ведения больных ВП, включая диагностику и лечение, “вращаются” вокруг первоначальной оценки тяжести заболевания. Решение этого вопроса напрямую связано с выбором места лечения пациента – на дому, в общей палате стационара или в ОИТ. При этом следует учитывать, что стоимость стационарного лечения в 25–30 раз превышает таковую лечения больного ВП в амбулаторных условиях. Другие причины отказа от необоснованных госпитализаций заключаются в том, что пациенты с низким риском летального исхода, получающие лечение в амбулаторных условиях, быстрее возвращаются к нормальной активности, чем госпитализированные больные, кроме того, 80 % больных ВП предпочитают лечиться на дому. Госпитализации также увеличивают риск тромбоэмболических осложнений и суперинфекции более вирулентными и лекарственно устойчивыми нозокомиальными патогенами [4].
Существенные различия в частоте госпитализаций больных ВП между отдельными лечебно-диагностическими учреждениями хорошо известны. Врачи часто переоценивают тяжесть течения заболевания и направляют в стационар много больных с низким риском летального исхода. В связи с потребностью в объективных критериях выбора места лечения предпринимались многочисленные попытки исследователей разработать такие критерии. Наиболее интересными из них оказались шкала PSI и критерии Британского торакального общества (CURB-65).
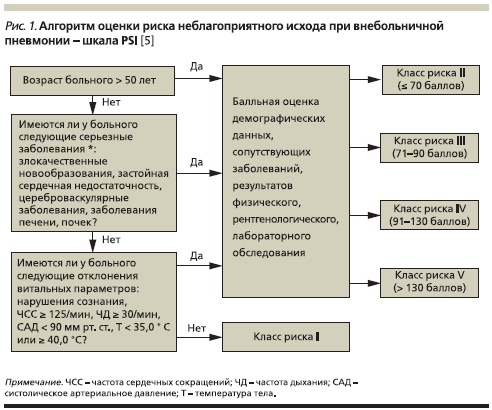
Разработка шкалы PSI (Pneumonia Severity Index – индекс тяжести пневмонии) явилась результатом беспрецедентного по масштабам исследования, получившего название “Исследование исходов пневмонии” – Pneumonia Outcomes Research Trial (PORT). Первоначально авторы использовали ретроспективные данные по оценке течения пневмонии у 14 199 госпитализированных больных. Затем выявленные закономерности были валидированы у 38 039 больных ВП, проходивших лечение в стационарных условиях. Впоследствии в программу PORT были включены результаты проспективного наблюдения за 2287 больными ВП, получавшими лечение как в домашних, так и в больничных условиях [5].
Согласно шкале PSI, больных ВП можно отнести к одному из пяти классов риска летального исхода. Прогностическая ценность данного подхода к оценке вероятности летального исхода в последующем была подтверждена результатами многочисленных исследований. Соответственно предполагаемому уровню летальности больные ВП I и II классов риска должны лечиться амбулаторно, больные III класса могут как лечиться на дому, так и быть госпитализированными на короткое время; больные же, относящиеся к IV и V классам риска, должны лечиться в стационаре (рис. 1).
С учетом главного недостатка балльной системы оценки тяжести (использование шкалы PSI предполагает учет 20 признаков), а именно: массы исследуемых параметров, с середины 1980-х гг. разрабатываются критерии ВП, основанные на ограниченном числе признаков. Одна из последних модификаций критериев BTS (Британское торакальное сообщество) включает пять легкооцениваемых параметров [6]. Многовариантный анализ данных 1068 больных позволил выделить следующие индикаторы неблагоприятного исхода заболевания: спутанность сознания (оценка осуществляется с помощью специфического ментального тест 1 или констатации факта дезориентации пациента в месте, времени или собственной личности), уровень мочевины крови > 7 ммоль/л (20 мг/ дл), частота дыхания ≥ 30 в минуту, низкое артериальное давление (систолическое < 90 мм рт. ст. или диастолическое ≤ 60 мм рт. ст.) и возраст ≥ 65 лет. В соответствии с полученными данными при суммарной оценке состояния пациента по шкале CURB-65, составляющей 0–1 балл, предлагается проводить лечение в амбулаторных условиях; при наличии двух факторов риска (2 балла) – в условиях отделения общего профиля; при наличии трех или большего числа факторов риска (≥ 3 баллов) – в ОИТ (рис. 2). Существует и упрощенная версия этой шкалы – CRB-65, не требующая исследования уровня мочевины крови, что позволяет врачам первичного звена использовать ее, не прибегая к помощи лабораторной диагностики.
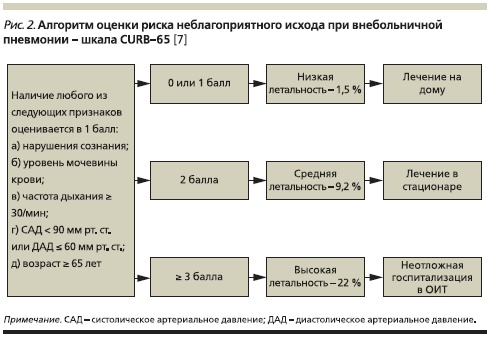
Применение приведенных выше шкал оценки прогноза и выбора места лечения может уменьшить число больных, госпитализируемых по поводу ВП. Неизвестно, какая из шкал – РSI или CURB-65/CRB-65 – лучше, поскольку до настоящего времени не было проведено ни одного рандомизированного исследования сравнительной оценки их прогностической ценности.
Впрочем, при всей привлекательности прогностических шкал для решения вопроса о госпитализации больного ВП очевидно, что в вопросе о выборе места лечения полагаться только на них не следует.
Так, в частности, причинами госпитализации больных ВП с низким риском летального исхода могут оказаться:
1) осложнения пневмонии;
2) обострение/декомпенсация сопутствующих заболеваний;
3) невозможность приема лекарственных препаратов внутрь или амбулаторного ухода за больным;
4) многочисленные факторы риска, выходящие за пределы шкал и потому не учтенные в конечной оценке прогноза.
Антибактериальная терапия
Если попытаться сформулировать основные вопросы, решаемые при проведении антибактериальной терапии (АБТ) ВП, их перечень мог бы выглядеть следующим образом:
I Стратификация пациентов. Выбор приемлемого антибиотика должен предполагать учет известных факторов риска неблагоприятного исхода и оценку степени тяжести заболевания (см. выше). Следует также иметь в виду наличие известных факторов риска появления отдельных возбудителей ВП у взрослых – лекарственно устойчивых Streptococcus pneumoniae 2, грамотрицательных энтеробактерий 3, Pseudomonas aeruginosa 4.
II Соотношение “цена/эффективность”. Идеальный антибиотик – это не самый дешевый препарат. Оценивая прямые затраты на лечение (прежде всего в амбулаторных условиях), необходимо со стоимостью лекарственного средства соотносить длительность временной нетрудоспособности, частоту терапевтических неудач, в т. ч. и повлекших за собой госпитализацию. При этом очевидно, что стоимость АБТ зачастую оказывается несопоставимой по сравнению с последствиями неэффективного лечения.
III Приверженность пациента лечебным рекомендациям. Известно, что серьезными препятствиями выполнению больным врачебных предписаний являются множественность лекарственных назначений, развитие нежелательных явлений, необходимость приема препарата чаще 2 раз в сутки, влияние проводимого лечения на сложившийся жизненный стереотип, минимальные последствия (в представлении больного) невыполнения врачебных рекомендаций.
Естественно, что эти вопросы находят соответствующее отражение и на страницах современных клинических рекомендаций.
При решении этих и других вопросов, связанных с проведением рациональной антибактериальной терапии ВП у взрослых, следует учитывать следующие обстоятельства:
а) традиционные диагностические тесты, направленные на этиологическую верификацию ВП, характеризуются ограниченной ценностью (их результативность не превышает 50 %);
б) антибактериальная терапия ВП носит эмпирический характер;
в) выбор и время начала АБТ имеют определяющее прогностическое значение;
г) ключевыми возбудителями большинства случаев ВП являются S. pneumoniae (пневмококк), Haemophilus influenzae, “атипичные” микроорганизмы (Chlamydophila pneumoniae, Mycoplasma pneumoniae);
д) доказан реальный вклад ко-инфекции (например, сочетания пневмококка и “атипичных” возбудителей) в развитии ВП;
е) все более актуальной становится проблема распространения лекарственно устойчивых штаммов основных возбудителей ВП.
В целом выбор обоснованной эмпирической антибактериальной терапии ВП строится на знании ограниченного перечня возбудителей заболевания и предсказуемых уровней резистентности в пределах обширных географических регионов. Так, к числу основных возбудителей ВП нетяжелого течения, т. е. не требующей госпитализации, относятся S. pneumoniae, M. pneumoniae, C. рneumoniaе. Среди микробиологических “находок” у больных ВП более тяжелого течения, нуждающихся в госпитализации (в т. ч. в ОИТ), наряду с пневмококком, H. influenzae фигурируют Legionella pneumophila, представители семейства Enterobacteriaceae (прежде всего Klebsiellapneumoniae, Escherichiacoli), Staphylococcusaureus.
В выборе рациональной АБТ помимо ориентированности в этиологии ВП не менее важно знание структуры лекарственной устойчивости ключевых возбудителей заболевания, прежде всего пневмококка. В некоторых странах устойчивость пневмококков к пенициллину достигает 60 %, причем многие из них обладают резистентностью к трем и более классам антибиотиков. Резистентность S. pneumoniae к пенициллину обычно сочетается с устойчивостью к цефалоспоринам I–II поколений, тетрациклинам, ко-тримоксазолу.
Данные мониторинга резистентности клинических штаммов S. pneumoniae в РФ в рамках многоцентрового исследования ПеГАС с 1999 по 2009 г., представленные в табл. 2, свидетельствуют о том, что уровень устойчивости пневмококков к пенициллину в нашей стране остается стабильным и не превышает 10–15 %. При этом в большинстве случаев выявляются умеренно резистентные штаммы.
Таблица 2.Устойчивость S. pneumoniae к различным антибиотикам (данные многоцентрового исследования ПеГАС I–III) [8].
Все пенициллинорезистентные пневмококки сохраняют чувствительность к амоксициллину (амоксициллину/клавуланату, амоксициллину/сульбактаму), а резистентность к цефтриаксону, цефотаксиму варьируется от 0 до 4,4 %. Невысокой остается резистентность S. pneumoniae и к макролидам (9,5–10,8 %). При этом в последние годы наметилось “сглаживание” различий между 14-, 15и 16-членными макролидами, что заставляет говорить о преобладании в нашей стране MLS-фенотипа резистентности. Высокую антипневмококковую активность демонстрируют “респираторные” фторхинолоны (левофлоксацин, моксифлоксацин): в РФ фактически отсутствуют штаммы, устойчивые к этим антибиотикам. Несмотря на отмечающееся в последние годы в амбулаторной практике существенное сокращение использования тетрациклинов и ко-тримоксазола при респираторных инфекциях, устойчивость к ним пневмококка сохраняется на высоком уровне.
Одновременно важно подчеркнуть, что устойчивость “атипичных” возбудителей ВП (M. pneumoniae, C. pneumoniae, L. pneumophila) к антибиотикам, активным в отношении внутриклеточных микроорганизмов (макролидам, фторхинолонам), отсутствует.
Переходя непосредственно к обсуждению вопросов АБТ, следует отметить, что в настоящее время имеются доказательства превосходства ряда подходов к лечению взрослых больных ВП. Так, целесообразность раннего применения антибиотиков (в первые 4–8 часов от момента госпитализации), равно как и использование в рамках эмпирической АБТ препаратов, активных в отношении “атипичных” возбудителей, подтверждаются результатами обсервационных исследований [9, 10] и согласуются с мнением экспертов [3, 4, 11].
Особое значение приобретает знание врачом следующих “правил” антимикробной химиотерапии ВП:
а) следует применять наиболее активные препараты, обладающие лучшей в группе биодоступностью (например, амоксициллин, амоксициллин/клавуланат; кларитромицин, азитромицин; левофлоксацин, моксифлоксацин);
б) применять антибиотики следует в высоких дозах (например, амоксициллин 3 г/сут);
в) при лечении ВП в стационаре использовать комбинацию β-лактама и макролида или монотерапию “респираторным” фторхинолоном.
Помимо этого следует учитывать и известные факторы риска инфицирования S. pneumoniae, устойчивых к β-лактамам: возраст > 65 лет, терапия β-лактамами в предшествующие 3 месяца, алкоголизм, сопутствующие заболевания, иммуносупрессивные состояния или иммуносупрессивная терапия, контакт с детьми, посещающими детские сады. И хотя относительное прогностическое значение каждого из этих факторов риска не установлено, недавнее лечение антибиотиками, вероятно, имеет среди них наибольшее значение.
Подобный подход к выбору антибиотика при лечении ВП у взрослых закреплен, в частности, и в согласительных рекомендациях РРО, а также МАКМАХ за 2010 г. [3] (рис. 3).
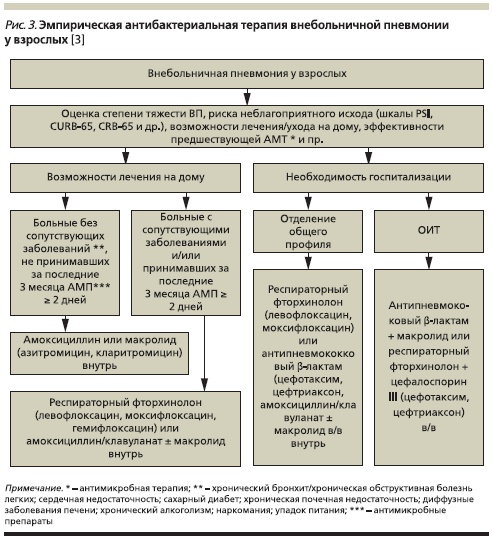
Снижение затрат на лечение может быть достигнуто использованием соответствующих положений современных рекомендаций, облегчающих выбор пациентов ВП, которые могли бы безопасно и эффективно лечиться в амбулаторных условиях. По возможности ранний переход с парентерального введения антибиотика на его прием внутрь 5 и следующая за этим выписка из стационара (когда пациент становится клинически стабильным) также способствуют снижению стоимости лечения.
Заключение
Алгоритмизация как определенная последовательность врачебных действий, представляющихся оптимальными, может оказаться весьма полезной, особенно на начальном этапе ведения больного ВП, когда врач испытывает известный информационный дефицит (этиология заболевания, чувствительность возбудителя ВП к антибиотикам, возможные осложнения ВП, “ответ” пациента на введение первых доз антибиотика и др.). Доказательством тому являются, в частности, многочисленные свидетельства, будто следование клиническим рекомендациям, приближающим нас к диагностическому и лечебному универсализму, минимизирует стоимость лечения, сокращает сроки госпитализации и сопровождается снижением летальности [12]. Вместе с тем доступность диагностических и терапевтических алгоритмов не освобождает нас от “индивидуального прочтения” актуальной клинической ситуации в отдельно взятой стране или регионе с учетом локальной антибиотикорезистентности, географической вариабельности этиологии ВП, сложившихся лечебных традиций (но не укоренившихся заблуждений) и особенностей организации медицинской помощи на амбулаторном и госпитальном этапах. Иными словами, широкая популяризация клинических рекомендаций или их отдельных элементов (включая диагностические и лечебные алгоритмы) вовсе не означает утраты врачом разумной автономии.
1 Краткая шкала оценки сознания (по K. Quereshi, H. Hodkinson. Evaluation of ten-question mental test in the institutionalized elderly. Age Aging 1974;3:152–57 с изменениями Л.С. Страчунского. Антимикробная терапия внебольничной пневмонии в условиях поликлиники. В кн. Пневмония / Ред. А.Г. Чучалин, А.И. Синопальников, Н.Е. Чернеховская. М., Экономика и информатика, 2002. С. 343). Вопросы, которые задают пациенту: 1) ваш возраст; 2) дата рождения; 3) время (в пределах часа); 4) год; 5) название стационара; 6) способность узнавать двух человек (например, врача, медицинскую сестру); 7) адрес; 8) дата начала Великой Отечественной войны; 9) фамилия Президента РФ; 10) обратный счет от 20 до 1. Правильный ответ оценивается как 1 балл; сумма ≤ 8 баллов свидетельствует о нарушении сознания.
2 Возраст > 65 лет, терапия β-лактамами в течение последних 3 месяцев, множественные сопутствующие заболевания внутренних органов (сахарный диабет, сердечная недостаточность, ХОБЛ...) и др.
3 Обитатели домов престарелых, проводимая антибактериальная терапия, множественные сопутствующие заболевания и др.
4 “Структурные” заболевания легких (например, бронхоэктазия, муковисцидоз), системная терапия глюкокортикоидами, упадок питания, терапия антибиотиками широкого спектра действия > 7 дней в течение последнего месяца.
5 Критерии перехода с парентерального на пероральный путь введения антибиотика: а) уменьшение кашля, объема экспекторируемой мокроты, одышки; б) нормальная температура тела при двух ее последовательных измерениях с 8-часовым интервалом; в) нормальное число лейкоцитов в периферической крови; г) отсутствие нарушений гастроинтестинальной абсорбции (J.A. Ramirez, L. Srinath, S. Ahkee, A. Huang, M.J. Raff. Early switch from intravenous to oral cephalosporins in the treatment of hospitalized patients with community-acquired pneumonia. Arch Intern Med, 1995; 155:1273–76).
Информация об авторе:
Синопальников Александр Игоревич – доктор медицинских наук, профессор, начальник кафедры пульмонологии
Российской медицинской академии последипломного образования.
E-mail: aisyn@ya.ru, aisyn@list.ru



