По данным Национального института рака, в США в 2010 г. ожидается 22,02 тыс. новых случаев первичных опухолей центральной нервной системы (1,3 % всех новых случаев рака) и 13,14 тыс. смертей от той же причины (2,3 % всех смертей от рака). Ежегодно в мире заболевают около 176 тыс. и умирают от опухолей головного мозга до 128 тыс. больных. В Российской Федерации точных данных о числе первичных опухолей ЦНС нет, что связано с особенностями организации учета онкологических больных. Ориентировочно новообразования головного мозга ежегодно выявляют у 10–20 тыс. пациентов. В последние годы заболеваемость первичными опухолями ЦНС сравнялась при раке яичников и раке желудка, а смертность превысила смертность от меланомы [1].
Анапластические глиомы III степени злокачественности (анапластические астроцитомы, олигодендроглиомы, олигоастроцитомы) и глиобластомы IV степени злокачественности составляют около 38 % всех первичных опухолей ЦНС. Прогноз при этих заболеваниях остается крайне неблагоприятным. Хирургическое лечение практически никогда не приводит к излечению больных, хотя выживаемость коррелирует с радикальностью удаления опухоли. В нескольких рандомизированных исследованиях доказано, что добавление лучевой терапии (ЛТ) к операции увеличивает медиану выживаемости (МВ) больных приблизительно в 2 раза – с 5,2 до 10,2 месяца [2].
Лучевая терапия
В 1980-х гг. была доказана возможность увеличения выживаемости больных при использовании ЛТ как самостоятельного метода терапии или в качестве послеоперационного метода лечения при злокачественных глиомах. Длительное время использовались различные варианты и объемы облучения. В настоящее время рекомендуется применять локальную ЛТ.
F.N. Hochberg и A. Pruitt опубликовали данные 35 больных, которым была выполнена компьютерная томография (КТ) не позднее чем за 2 месяца до аутопсии. До 78 % всех рецидивов располагались не далее 2 см от края опухоли, определяемого при КТ, а 56 % – в 1 см или ближе [3].
E.C. Halperin и соавт. сопоставили результаты КТ и патологоанатомического исследования мозга 15 больных глиобластомой, не получавших ЛТ или получавших ее в минимальных дозах. Если объем облучения был спланирован таким образом, чтобы очертить зону накопления контраста и зону отека с краем в 1 см, то гистологически определяемая опухоль полностью включалась в зону облучения только в 6 из 11 случаев. С другой стороны, увеличение границы облучения до 3 см позволяло включать в объем ЛТ всю гистологически определяемую опухоль [4].
И наконец, в исследовании BTCG 80-01 больные глиобластомой были рандомизированы в две группы: в одной группе облучали весь головной мозг до суммарной очаговой дозы (СОД) 43 Гр, а затем дополнительно проводили бустерное облучение на область ложа опухоли в дозе 17,2 Гр. В другой группе головной мозг облучали до СОД 62 Гр. Различия в выживаемости были недостоверными [5]. Результаты исследования указывали на равную эффективность тотального и локального облучения головного мозга, вследствие чего локальная ЛТ с включением в зону 2–3 см нормальной ткани мозга стала стандартом при глиомах высокой степени злокачественности (ВСЗ).
В настоящее время достаточно четко сформулированы требования к планированию и объему ЛТ при глиомах. Объем облучения определяется следующим образом:
- Макроскопический объем облучения – Gross Target Volume (GTV) – определяется как зона повышенного сигнала в Т2-взвешенном изображении при магнитно-резонансной томографии (МРТ) или в режиме FLAIR и соответствующая гиподенсная зона при КТ.
- Если пациент ранее был прооперирован, то GTV должен определяться как послеоперационная полость + остаточная опухоль (если есть).
- Клинический объем облучения – Clinical Target Volume (CTV) – определяется как GTV + дополнительный объем предполагаемого невидимого микроскопического распространения опухоли. При глиомах низкой степени злокачественности (НСЗ): CTV = GTV + 1,0–1,5 cм. При глиомах ВСЗ: CTV = GTV + 2–3 cм.
- CTV распространяется на противоположную гемисферу только в случаях, когда опухоль (визуализируемая при МРТ в Т2-взвешенном изображении) переходит на срединные структуры, такие как мозолистое тело. Предполагается, что мозжечковый намет и оболочки мозга являются анатомическими границами распространения опухоли, поэтому края в 5 мм достаточно для ликвидации микроскопического распространения в этом направлении.
- Планируемый объем облучения (PTV) зависит от параметров проведения лечения и разметки (толщины срезов при КТ, метода иммобилизации и т. д.). Обычно достаточно добавления к CTV 0,5–0,7 см.
- PTV должен находиться в 95 %-ной изодозе, возможной при близком расположении критических органов.
К самому процессу планирования ЛТ предъявляются следующие требования:
- Обязательное использование фиксирующих устройств, позволяющих добиваться точности < 5 мм.
- Планирование с использованием КТ строго обязательно.
- Максимальная толщина срезов при разметке на КТ должна составлять 3 мм для хорошего качества цифровой реконструкции.
- Одновременное использование КТ и МРТ и совмещение их изображений настоятельно рекомендуются и являются обязательными для учреждений, имеющих это оборудование.
- Рекомендуется использование позитронно-эмиссионной томографии (ПЭТ), если есть возможность.
- Верификация процесса планирования с использованием обычной или виртуальной симуляции.
Эскалация доз лучевой терапии
При анализе локализации рецидивов выяснилось, что более 90 % из них располагаются в зоне облучения. Только от 3 до 5 % всех рецидивов возникают вне зоны облучения, возникновение остальных – “краевых рецидивов”, можно связать с недостаточным объемом облучения [6]. Поэтому казалось логичным, что увеличение доз ЛТ может улучшить результаты лечения. К сожалению, эта гипотеза не получила подтверждения в клинических исследованиях. Так, J.L. Chan и соавт. использовали 3D-конформную IMRT (Intensity Modulated Radiation Therapy) ЛТ, СОД на основной очаг составила 90 Гр. Общая выживаемость (ОВ) не отличалась от исторического контроля [7]. В исследовании RTOG 83-02 (Radiation Therapy Oncology Group 8302) изучали эффективность интенсивных мультифракционных режимов. Лучевую терапию проводили двумя фракциями в день по 1,2 Гр до СОД 64,8; 72,0; 76,8 и 81,6 Гр. Другой режим предусматривал использование двух фракций в день по 1,6 Гр до СОД 48,0 и 54,4 Гр. В заключительный отчет вошли 747 больных. Различия в выживаемости в подгруппах отсутствовали [8]. Аналогично закончились попытки использования радиохирургического и брахиотерапевтического бустерного облучения.
Использование всего арсенала современной ЛТ, трехмерное планирование, адекватная фиксация пациентов позволили сделать ЛТ гораздо более безопасной, снизить на 20 % облучение нормальной ткани мозга, но, к сожалению, не повлияли на ее эффективность.
Использование радиосенсибилизаторов
Другой вариант усиления эффективности ЛТ – использование препаратов и методов, потенцирующих действие ионизирующего излучения. Исследование радиосенсибилизаторов, действие которых направлено на преодоление гипоксии, как правило, присутствующей при глиобластомах, разочаровывают. C.H. Chang использовал гипербарическую оксигенацию у 38 больных. ЛТ варьировалась от 36 Гр за 3 недели до 60 Гр за 6–7 недель. Увеличения выживаемости добиться не удалось [9]. В одном из исследований EORTC (European Organization for Research and Treatment Cancer) изучали возможность применения карбогена и никотинамида с целью купирования эффектов гипоксии, во многом ответственной за резистентность глиобластом к ЛТ. В исследовании I–II фаз 107 пациентов получали ЛТ одновременно с вдыханием карбогена во время каждого сеанса или ежедневно принимали внутрь никотинамид или и то и другое. У больных, получавших никотинамид, чаще отмечалась острая токсичность. ОВ была сходной во всех группах (МВ 10,1 против 9,7 против 11,1 месяца) и не отличалась от исторического контроля [10].
Галогенизированные пиримидины относятся к сенсибилизаторам S-фазы, они внедряются в ДНК делящихся клеток из-за их биохимического сходства с тимидином. После этого клетки, с одной стороны, становятся более чувствительными к однонитевому разрыву ДНК вследствие воздействия свободных радикалов, возникающих в процессе облучения, с другой – у них снижается способность к репарации ДНК. В ранних клинических исследованиях бромодиоксиуредин (BrdU) вводили внутриартериально, но позднее были получены данные о том, что длительная внутривенная инфузия эквивалентна внутриартериальному введению. В исследованиях NCOG отмечено увеличение времени до прогрессирования в группе больных, получавших более высокие кумулятивные дозы BrdU.
В дальнейших исследованиях получены противоречивые результаты. В M.D. Anderson Cancer Center гиперфракционированную ЛТ сочетали с BrdU в высоких дозах. МВ (12–13 месяцев) не отличалась от исторического контроля при наличии существенной токсичности на увеличенных дозах BrdU. NCOG опубликовала результаты сравнения выживаемости больных, получавших BrdU + ЛТ, со сходной популяцией из базы RTOG. МВ среди пациентов NCOG составила 16,9 месяца, среди больных RTOG (не получавших BrdU) – 9,8 месяца (р < 0,0001). Однако имеется ряд существенных ограничений (широкая вариация режимов фракционирования, суммарных доз, химиотерапии, использования других радиосенсибилизаторов), которые снижают ценность этого анализа [11]. Отсутствие исследования III фазы не позволяет объективно оценивать потенциал BrdU.
С появлением мотексафина гадолиния (MGd), потенциального сенсибилизатора ЛТ и химиотерапии, интерес к радиосенсибилизаторам возобновился. Этот препарат, обладающий высоким окислительно-восстановительным потенциалом, селективно накапливается в опухолевых клетках. Сенсибилизация опухоли происходит через генерацию активного кислорода, который дестабилизирует клеточный метаболизм. В исследовании I фазы MGd продемонстрировал эффективность как радиосенсибилизатор у больных глиобластомами [12]. До настоящего времени не существует радиосенсибилизатора с доказанной активностью в исследованиях III фазы.
Комбинированная химиолучевая терапия
Трудности лечения глиальных опухолей определяются не только их потенциальной устойчивостью к ЛТ и диффузным ростом, но и феноменальной способностью к распространению вдоль трактов белого вещества. Изначальная распространенность опухоли внутри головного мозга может оказаться абсолютно непредсказуемой. Так, даже при выполнении гемисферэктомии рецидивы возникали в противоположной гемисфере [13]. В настоящее время сформулировано несколько теорий, объясняющих подобное поведение опухоли. Большинство из них определяет данное новообразование как системное заболевание головного мозга с наличием повреждения генетического аппарата нейрональной стволовой клетки. Новые данные о патогенезе глиальных опухолей объясняют причины неудач при использовании локальных методов лечения, таких как хирургия и различные варианты ЛТ.
Использование системных подходов (химиотерапии) могло улучшить результаты лечения. Однако длительное время данные об эффективности послеоперационной химиотерапии оставались противоречивыми. A. Fine в 1993 г. опубликовал результаты метаанализа 16 рандомизированных исследований, в которые были включены более 3000 пациентов. Автор сравнивал выживаемость больных, получавших ЛТ или ЛТ и химиотерапию, которая была представлена преимущественно нитрозопроизводными. Добавление химиотерапии привело к увеличению одногодичной выживаемости на 10,1 % (95 % доверительный интервал [ДИ] – от 6,8 до 13,3 %) и двухлетней – на 8,6 % (95 % ДИ – от 5,2 до 12,0 %). Результаты исследования указывали на то, что преимущество химиотерапии было более выраженным у больных анапластическими астроцитомами, чем глиобластомами [14].
Наиболее привлекательно выглядит идея комбинированной химиолучевой терапии (ХЛТ). Во-первых, препараты, проникающие через гематоэнцефалический барьер, потенциально в состоянии элиминировать опухолевые клетки, находящиеся вне зоны ЛТ, и воздействовать на генетически скомпрометированные нейрональные стволовые клетки. Во-вторых, ряд химиопрепаратов обладает синергизмом с ЛТ. С середины 1990-х гг. началось активное изучение комбинации различных цитостатических агентов и ЛТ при злокачественных глиомах.
Топотекан является ингибитором топоизомеразы I. Он связывается с комплексом топоизомераза I–ДНК и предотвращает повторное сшивание нитей ДНК. Препарат проникает через гематоэнцефалический барьер и теоретически может усиливать эффективность ЛТ, блокируя топоизомеразу I, чем препятствует репарации ДНК. В исследовании RTOG 95-13 топотекан изучали у лиц с впервые диагностированной глиобластомой в сочетании с ЛТ. МВ (9,3 месяца) не отличалась от исторического контроля [15].
Паклитаксел в преклинических исследованиях продемонстрировал активность как радиосенсибилизатор в отношении клеточных линий глиобластомы. В исследовании RTOG 96-02 ЛТ проводили в сочетании с еженедельным введением паклитаксела. Объективный ответ был достигнут в 23 %, минимальный ответ – в 17 %, однако ОВ (9,7 месяца) не отличалась от исторического контроля [16].
Препараты платины в преклинических исследованиях не только ингибировали репарацию радиационнообусловленного повреждения ДНК, но и оказывали прямое цитотоксическое действие на клетки глиомы [17, 18]. Первые клинические исследования предполагали клиническое преимущество такой комбинации [19], но в исследовании III фазы, изучавшем эффективность ЛТ в сочетании с тремя курсами химиотерапии цисплатин/BCNU (кармустин) по сравнению со схемой ЛТ + BCNU, статистически значимых различий между группами не выявили [20]. В небольшом исследовании II фазы изучали комбинацию ежедневного карбоплатина в дозе 25 мг/м2 до СОД 600 мг/м2 и ЛТ. Всего были оценены данные 14 больных. Медиана времени до прогрессирования (МВДП) и ОВ не отличались от исторического контроля [21].
С 1997 г. началось активное преклиническое, а позже и клиническое изучение препарата группы имидазотетразинов – Темодал® (темозоломид). В ряде исследований были получены данные об эффективности темозоломида в монотерапии в отношении глиобластом, а in vitro показан синергизм темозоломида и ЛТ: темозоломид блокирует клеточный цикл в фазе G2/M в клеточных линиях глиобластомы, наиболее чувствительной к ЛТ. Темозоломид, ингибируя интегрины, блокирует радиационно-обусловленную инвазию и усиливает повреждение ДНК, наносимое ионизирующим излучением, но только в случае одновременного, а не последовательного применения его с ЛТ.
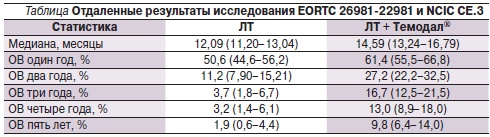
Имеющаяся информация о препарате послужила основанием для проведения многоцентрового рандомизированного исследования EORTC 26981– 22981 и NCIC CE.3. В исследовании у пациентов с впервые диагностированной мультиформной глиобластомой изучалась эффективность ЛТ в комбинации с темозоломидом (Темодал®) (75 мг/м2 ежедневно с 1-го по последний дни ЛТ) + адъювантная химиотерапия темозоломидом (200 мг/м2 по 5 дней/через 28 дней) – 6 курсов по сравнению с ЛТ (рис. 1).
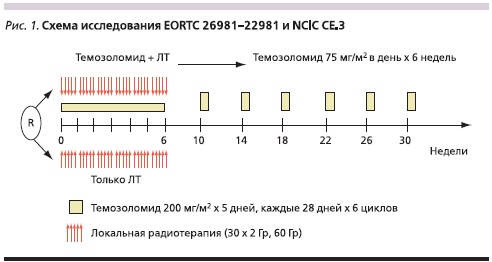
Больные были стратифицированы в соответствии с известными на момент исследования факторами прогноза. Основной целью исследования явилась оценка ОВ.
В качестве дополнительных целей исследования определяли:
выживаемость без прогрессирования заболевания;
качество жизни;
переносимость терапии.
В исследовании удалось продемонстрировать статистически значимое преимущество комбинированной ХЛТ по сравнению с ЛТ в отношении как безрецидивной, так и общей выживаемости [22, 23].
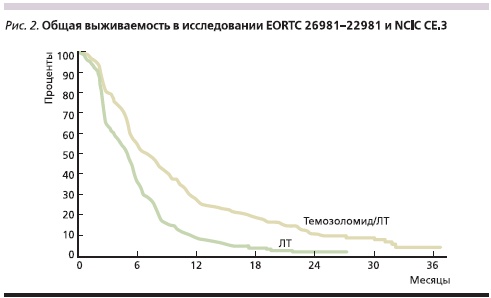
Как и при многих других злокачественных новообразованиях, при глиобластоме имеется ряд прогностических факторов, оказывающих влияние на выживаемость, зачастую большее, чем само лечение. Обновленный анализ исследования EORTC 26981-22981 и NCIC CE.3 показал, что во всех прогностических группах ХЛТ с темозоломидом была эффективнее ЛТ (рис. 2). Это относится и к когорте пациентов с низким общесоматическим статусом, и к больным RPA (recursive partitioning analisis) класса V. Ранее в этой группе больных различия в выживаемости были пограничными и не достигали статистически значимых величин. В более благоприятной прогностической группе RPA класса III двухлетняя выживаемость составила 41 %, а пятилетняя – 28 %, что в целом говорит о том, что наибольший выигрыш от лечения получают больные моложе 50 лет с хорошим общесоматическим статусом. В данном исследовании не изучалось отдельно влияние объема резекции опухоли на выживаемость. Но при дополнительном анализе были получены данные о том, что пациенты с более полной резекцией жили дольше. Худший прогноз был у больных, которым выполнялась только биопсия.
В ходе исследования EORTC 2698122981 были получены данные о влиянии MGMT (метилгуанинметилтрансферазы) на эффективность комбинированной ХЛТ. MGMT – фермент, восстанавливающий ДНК после повреждения, нанесенного темозоломидом. Повышение активности MGMT приводит к снижению эффективности темозоломида. Выработка фермента MGMT кодируется соответствующим геном. Метилирование гена MGMT означает его “выключение”. Именно у больных с метилированным геном MGMT эффективность комбинированного режима была максимальной. В отсутствие метилирования около 20 % больных получают выигрыш в выживаемости. В исследовании RTOG 0525 все образцы опухолей больных, включенных в исследование, были протестированы на наличие метилирования MGMT, обнаруженного только у трети больных.
При наличии подобных данных не может не возникнуть идея об использовании MGMT для отбора больных на комбинированную ХЛТ с темозоломидом.
Но оснований к использованию такого подхода недостаточно, ибо:
- до настоящего времени нет ни одного проспективного исследования, оценившего такой подход;
- в анализе, проведенном через 5 лет после окончания исследования, комбинированная ХЛТ в группе пациентов с неметилированным MGMT была эффективнее ЛТ в отношении ОВ (р = 0,035).
Таким образом, новые данные этого исследования демонстрируют статистически значимое увеличение выживаемости при использовании ХЛТ во всех подгруппах больных мультиформной глиобластомой, которое сохраняется и через пять лет после завершения исследования. Была доказана безопасность и хорошая переносимость темозоломида в комбинации с ЛТ. Этот режим лечения в настоящее время стал стандартным в большинстве стран мира.
Псевдопрогрессирование
После начала активного использования ХЛТ с темозоломидом стали появляться сообщения о случаях увеличения объема контрастируемых очагов в ранние сроки после окончания ЛТ, не связанных с продолженным ростом опухоли, а обусловленных лечением. Подобный феномен, проявляющийся обычно в первые три месяца после окончания ХЛТ, был назван “псевдопрогрессированием”. По различным данным, псевдопрогрессирование встречается у 15–20 % больных, получивших ХЛТ, более того, с ней связана половина случаев увеличения очагов в ранние сроки после ХЛТ. В отличие от истинного прогрессирования эти очаги со временем или уменьшаются, или остаются стабильными без дополнительного лечения, что зачастую не сопровождается развитием симптомов. Причем, вероятно, некроз после ХЛТ с темозоломидом развивается чаще и в более ранние сроки, чем после ЛТ. Механизм, лежащий в основе этого феномена, не совсем ясен. Возможно, ХЛТ индуцирует выраженный некроз опухолевых клеток и клеток эндотелия, следствием чего становится развитие вторичных реакций, таких как отек, нарушение проницаемости сосудов, нарушение гематоэнцефалического барьера в зоне, подвергшейся облучению. Радиологические изменения в подобной ситуации очень трудно отличить от продолженного роста опухоли. Только появление нового очага поражения вне зоны облучения является достоверным признаком прогрессирования заболевания. В остальных случаях необходимо проводить дифференциальную диагностику между продолженным ростом и некрозом, для этого может быть предложено выполнение ПЭТ с метионином.
В настоящее время при выявлении ранних признаков прогрессирования заболевания после ХЛТ в отсутствие симптомов рекомендуется продолжить терапию темозоломидом. В некоторых случаях при наличии симптомов может быть предложено хирургическое лечение. Если после операции при гистологическом исследовании выявляется преимущественно некроз, целесообразно продолжение химиотерапии темозоломидом.
Тем не менее некоторые вопросы остались неизученными. В доступной нам литературе не встречались данные о сравнительной оценке эффективности различных вариантов ХЛТ.
Собственное исследование
Мы изучали два режима ХЛТ, один из которых основан на использовании нитрозопроизводных, другой – с темозоломидом. Исследование является ретроспективным, и лечение больных нитрозопроизводными началось до появления темозоломида. Выбор препаратов был обусловлен наличием данных об их активности в отношении глиобластом и синергизма с ЛТ.
В оценке эффективности лечения мы в первую очередь ориентировались на выживаемость до прогрессирования. Это было обусловлено в основном двумя причинами. Во-первых, больные получали различные варианты терапии 2-й линии, которая могла повлиять на ОВ и исказить результаты исследования. А во-вторых, в ряде работ, посвященных оценке эффективности лечения глиобластом, показано, что выживаемость без прогрессирования является суррогатным маркером ОВ.
Целью исследования явилась оценка эффективности различных вариантов ХЛТ в составе комплексного лечения глиобластом головного мозга.
Материал и методы
В исследование были включены 127 больных ГБМ. Медиана возраста – 51 год. Общесоматический статус ECOG (Eastern Cooperative Oncology Group) – 0–3. Оценивали МВДП. У 56 (44,1 %) больных опухоль удалена “радикально”, у 63 (49,6 %) удалено менее 90 % опухоли, у 8 (6,3 %) проведена стереотаксическая биопсия. В последующем (после операции) всем больным проведена ЛТ или ХЛТ. ЛТ осуществлялась в разовой очаговой дозе 2 Гр до СОД 60–62 Гр на область ложа удаленной опухоли с включением в объем облучения от 2 до 3 см окружающей неизмененной ткани. Первая группа (23 пациента) получала только ЛТ, 2-я группа (45 больных) – ломустин (CCNU) в дозе 80 мг/м2 (однократно в первый день), гидроксикарбамид (Гидреа) 1 г/м2 (1–14-й дни), 3-я (59 больных) – темозоломид (Темодал®) по 75 мг/м2 во время ЛТ. По окончании ХЛТ больным была продолжена химиотерапия (во 2-й группе – по прежней схеме, в 3-й – доза темозоломида составила 200 мг/м2 по 5 дней через 28).
Результаты
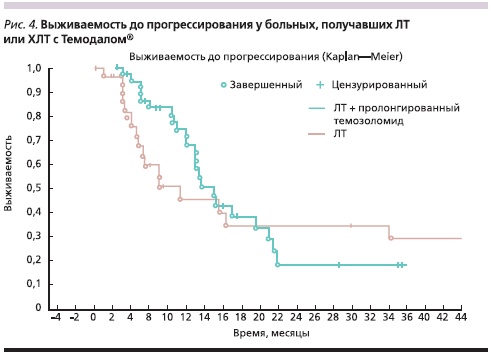
МВДП в 1-й группе составила 5 месяцев, во второй – 7 (рис. 3), в 3-й – 13 месяцев (рис. 4). Статистически значимые различия в ВДП по сравнению с группой ЛТ получены в группе, получавшей ХЛТ на основе темозоломида (р = 0,01). Имеется отчетливая тенденция к увеличению ВДП в группе, получавшей темозоломид, по сравнению с группой, получавшей препараты на основе нитрозопроизводных (р = 0,07). Токсичность во всех группах была приемлемой. Гематологическая токсичность III–IV степени развилась у 4 (8 %) пациентов 2-й группы и у 3 (5,0 %) больных 3-й группы. Обращает на себя внимание тот факт, что в группе больных, получавших темозоломид, лейкопения IV степени тяжести развилась только у женщин (у 3 пациенток).

Выводы
Одновременная ХЛТ с использованием препаратов нитрозомочевины или темозоломида обладает приемлемым профилем токсичности. Отмечена тенденция к увеличению частоты развития тяжелой гематологической токсичности у лиц женского пола, получавших темозоломид в сочетании с ЛТ. Выявлено статистически значимое увеличение медианы ВДП в группе больных, получавших комбинированную ХЛТ с использованием темозоломида.
Таргетная и химиолучевая терапия
После появления таргетной терапии началось ее активное изучение в комбинации с ЛТ при мультиформных глиобластомах. Отсутствие гематологической токсичности, характерной для химиотерапии, делает эти препараты идеальными для комбинации с ХЛТ.
Известно, что глиомы – одни из наиболее хорошо васкуляризированных опухолей человека, что делает их прекрасной мишенью для антиангиогенной терапии [24]. Семейство VEGF (vascular endothelial growth factor) и рецепторов к нему является ключевым сигнальным путем ангиогенеза при глиомах. VEGF – главный фактор, влияющий на проницаемость сосудов и выживаемость эндотелиальных клеток [25, 26]. Теоретические обоснования использования антиангиогенной терапии при злокачественных глиомах были следующими. Во-первых, ингибирование экспрессии VEGF с использованием антител к VEGF в эксперименте приводило к существенному снижению роста глиальных клеток [27]. Во-вторых, антиангиогенная терапия может восстанавливать нормальный кровоток, уменьшать гипоксию и таким образом делать клетки более чувствительными к химиотерапии и ЛТ [28, 29]. И наконец, недавно были получены данные о том, что стволовые опухолевые клетки глиобластомы стимулируют ангиогенез и в свою очередь требуют ангиогенеза для собственного развития. Таким образом, опухолевые стволовые клетки глиобластомы также становятся мишенью при использовании антиангиогенных препаратов [30–33].
В ходе исследований с множеством клеточных линий глиобластомы при экспозиции их с ингибитором ангиогенеза SU5416 был обнаружен синергический эффект с ЛТ [34]. Одним из первых ингибиторов ангиогенеза, применявшимся с химиотерапией и ЛТ, был талидомид. F. Baumann и соавт. изучали комбинацию талидомида и ЛТ (СОД = 60 Гр), причем более половины больных получали темозоломид. Время до прогрессирования составило 8,4 месяца; ОВ в группе больных, получавших ЛТ, темозоломид, талидомид, составила 24 месяца [35].
Другие антиангиогенные препараты исследуются как в монотерапии (AZD2171, сорафениб и т. д.), так и в комбинации с ЛТ. Бевацизумаб (Авастин) – моноклональное антитело к VEGF, продемонстрировал высокую эффективность при рецидивах глиобластомы в комбинации с иринотеканом и в монотерапии [36]. Данные исследования II фазы указывают на возможность увеличения медианы выживаемости до 25 месяцев при добавлении бевацизумаба к ХЛТ с темозоломидом [37]. В настоящее время минимум два препарата, обладающих антиангиогенной активностью, испытываются в рамках исследования III фазы в комбинации с темозоломидом и ЛТ – бевацизумаб и целенгитид (ингибитор интегринов).
Другим перспективным механизмом усиления эффективности ЛТ является блокирование EGFR (рецепторов эпидермального фактора роста). В нескольких преклинических исследованиях продемонстрировано увеличение радиочувствительности через ингибирование EGFR [38]. А. Chakravarti и соавт. обнаружили, что несколько клеточных линий глиомы, гиперэкспрессирующих EGFR, были резистентны как к ЛТ, так и к BCNU [39]. Очень важно, что резистентность к BCNU и ЛТ удалось преодолеть через блокирование EGFR препаратом AG1478.
M. Prados и соавт. опубликовали результаты по изучению ХЛТ с использованием темозоломида и эрлотиниба (Тарцева). В исследование были включены 65 пациентов. МВ составила 19,3 месяца, что статистически значимо превосходило исторический контроль (14,3 месяца). Выявлена отчетливая положительная корреляция между метилированием MGMT и выживаемостью, а также ассоциация между метилированием MGMT, положительной экспрессией PTEN (по данным иммуногистохимического исследования) и выживаемостью [40].
Заключение
За последние 5 лет в лечении глиобластом произошли существенные изменения. ХЛТ с темозоломидом, ставшая “золотым стандартом” 1-й линии терапии глиобластомы, стала основой для появления новых высокоэффективных режимов лечения. Если предварительные данные проводимых исследований оправдаются, то можно будет говорить о том, что в скором времени выживаемость больных увеличится до 25 месяцев при комбинации ЛТ с темозоломидом и бевацизумабом. Дальнейшее понимание патогенеза глиальных опухолей позволит разделить их на несколько нозоформ с разным патогенезом, общими у которых будут только клинические и морфологические проявления. Более четкое представление о механизмах развития опухоли позволит целенаправленно и абсолютно точно использовать таргетные препараты. До этого времени прогрессирование будет достигаться за счет комбинации различных цитостатических и нескольких таргетных препаратов для максимального блокирования одного из ведущих путей прогрессирования опухоли. Одним из принципов, который может быть чрезвычайно эффективным при глиобластомах, является условие “максимальной ангиогенной блокады”, которая теоретически достигается комбинацией препаратов, действующих на разные элементы неоангиогенеза: блокирование лиганда и рецептора VEGF, ингибирование внутриклеточной передачи сигнала с использованием мультикиназных ингибиторов и воздействие на эндотелиальные клетки с помощью метрономной химиотерапии.
Информация об авторах:
Смолин Алексей Владимирович – врач-радиолог 31-го радиологического (терапевтического) отделения,
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-56-31, e-mail: sirano68@gmail.com;
Конев Андрей Владимирович – заведующий 31-м радиологическим (терапевтическим) отделением,
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-03-66, e-mail: avkonev@mail.ru;
Кобяков Григорий Львович – кандидат медицинских наук, руководитель группы химиотерапии
опухолей ЦНС НИИ нейрохирургии им. Н.Н. Бурденко РАМН.
E-mail: GKobiakov@nsi.ru;
Николаева Светлана Николаевна – врач-радиолог 31-го радиологического (терапевтического) отделения,
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-57-31;
Шаманская Юлия Евгеньевна – врач-радиолог 31-го радиологического (терапевтического) отделения,
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-57-31