Варикоцеле является одной из самых частых причин мужского бесплодия. Распространенность варикоцеле достигает 15 % среди всего мужского населения, а среди бесплодных мужчин – 40 % [1]. Приблизительно у 70 % пациентов с вторичным бесплодием варикоцеле является главным этиологическим фактором [2]. Понимание патофизиологии, лечения и результатов лечения варикоцеле за последние десятилетия значительно возросло.
История изучения проблемы варикоцеле уходит в глубину веков. Впервые о варикоцеле упоминается в трудах Celsius в I в. н. э., он описал расширение вен семенного канатика и отметил связь варикоцеле с атрофией яичка [3]. Позднее, в XIII в., Ambroise Pare (1500–1590) описал эту сосудистую аномалию как содержащую “меланхоличную кровь”. В 1856 г. Curling был первым, кто связал варикоцеле с мужским бесплодием и отметил снижение “секреторной силы желез” при наличии варикоцеле [4]. В XX столетии многие хирурги доказали наличие взаимосвязи между “снижением выработки сперматозоидов”, варикоцеле и последующим улучшением фертильности после его коррекции. В 1955 г. Tulloch первым продемонстрировал положительные результаты лечения бесплодия после оперативной коррекции варикоцеле. В настоящее время лечение варикоцеле является самым частым оперативным пособием при мужском бесплодии [5].
В 1978 г. Greenberg S.H. и соавт. [6] не только выяснили, что варикоцеле связано с атрофией яичка, но и то, что эти изменения прогрессируют с годами. У бесплодных пациентов с варикоцеле выявлено снижение концентрации, подвижности сперматозоидов и аномалии морфологии. В работе была также показана связь варикоцеле с аномальными показателями тестостерона и фолликулостимулирующего гормона [7]. Множество теорий пыталось объяснить причину нарушения сперматогенеза у бесплодных пациентов с варикоцеле. Наиболее принятой в настоящее время является теория “тепловой кастрации” – нарушение венозного оттока приводит к нарушениям теплообмена семенного канатика и местному повышению температуры в мошонке. Повышение температуры в свою очередь нарушает сперматогенез. Таким образом, одностороннее варикоцеле может оказывать влияние на теплообмен обоих яичек [8, 9]. Повышенная скротальная температура вызывает снижение синтеза тестостерона клетками Лейдига, повреждение термолабильных мембран герминативных клеток, снижение биосинтеза белка, нарушение транспорта аминокислот, функции и морфологии клеток Сертоли [10–14].
Другие теории не настолько детально описывают влияние варикоцелна сперматогенез, включая депривацию кислорода, сниженный венозный отток, приводящий к нарушению выделения гонадотропинов из ткани яичек и снижению содержания оксидантов в сперме. Allamaneni S.S. и соавт. [15] продемонстрировали наличие связи между активными формами кислорода (АФК) эякулята и степенью варикоцеле. Авторы доказали, что повышение уровня АФК чаще наблюдается у мужчин со II и III степенями варикоцеле, чем у мужчин с I степенью. Еще в одном из последних исследований выявлено, что уровни оксидантов значительно выше в сперме бесплодных, чем в сперме здоровых мужчин [16]. Эта работа показала, что варикоцеле значительно увеличивает уровень оксидантов в семени бесплодных пациентов и то, что после лечения варикоцеле уровень оксидантов снижается. На самом же деле обычно повреждение ткани яичка вызывает не один, а множество факторов, что в итоге и приводит к бесплодию.
После лечения варикоцеле параметры эякулята и гормонов улучшаются. Например, стало известно, что после коррекции варикоцеле не только повышаются подвижность и концентрация сперматозоидов, улучшается их морфология, но и восстанавливаются специфические функциональные дефекты этих клеток [7, 17–20]. Так, после лечения варикоцеле увеличивается способность сперматозоидов к пенетрации [18], снижаются уровни АФК [19] и фрагментации ДНК [17, 20]. После коррекции отмечается нормализация уровней фолликулостимулирующего гормона и тестостерона [7, 21]. Su L.M. и соавт. [21] продемонстрировали значительное увеличение уровня сывороточного тестостерона с 319 ± 12 до 409 ± 23 нг/дл после оперативного лечения варикоцеле. Cayan S. и соавт. [7] показали значительное снижение уровня фолликулостимулирующего гормона с 15,21 до 10,82 мЕД/мл после операции. В 1987 г. Kass E.J. и Belman A.B. [22] были первыми, кто продемонстрировал, что после оперативного лечения варикоцеле увеличивается объем яичка. В итоге частота наступления беременности после лечения варикоцеле увеличивалась, несмотря на отсутствие серьезных изменений спермограммы [23]. Предполагается, что в этом случае улучшение функциональных факторов невозможно измерить рутинными методами.
В 1955 г. Tulloch W.S. [24] был одним из первых хирургов, предложивших коррекцию варикоцеле у пациентов с азооспермией. Он доказал, что хирургическое лечение варикоцеле приводит к восстановлению сперматогенеза и последующему увеличению частоты наступления беременностей у партнерш пациентов с азооспермией. С тех пор результаты многочисленных исследований подтвердили эти результаты. Matthews G.J. и соавт. [25] показали, что у 55 % мужчин с азооспермией и 69 % мужчин с отсутствием подвижных сперматозоидов до лечения после коррекции варикоцеле в эякуляте появляются подвижные формы. Kim E.D. и соавт. [26] приводят данные об улучшении показателей спермограммы у мужчин с азооспермией с гистологически подтвержденными тяжелыми формами нарушения сперматогенеза. Некоторые авторы демонстрируют лучшие результаты оперативного лечения варикоцеле в отношении фертильности при обнаружении сперматозоидов или сперматид в дооперационном биоптате яичка [25–27]. Тем не менее существуют работы, в которых показано редкое достижение значительного улучшения параметров эякулята у мужчин с необструктивной азооспермией после коррекции варикоцеле [28].
В настоящее время диагностика варикоцеле не представляет трудностей. Первично варикоцеле диагностируется при физикальном обследовании. Пациентов нужно осматривать в положении стоя и лежа. В ортостазе больного следует попросить выполнить пробу Вальсальвы для того, чтобы врач смог оценить обратный заброс крови. Дуплексное ультразвуковое исследование (УЗИ) улучшает диагностику варикоцеле. С момента его внедрения в практику использование таких методов, как венография, допплеровская стетоскопия и радиоизотопные исследования, значительно сократилось. Тем не менее стоит отметить, что диагноз варикоцеле устанавливается при физикальном обследовании и УЗИ следует использовать для дополнения, а также подтверждения результатов первичного осмотра. Большинство клиницистов могут согласиться с тем, что диагноз варикоцеле, установленный с помощью УЗИ, должен базироваться на том, что у пациента имеются расширенные до 2–3 мм вены семенного канатика и обратный венозный сброс при пробе Вальсальвы. В настоящее время отсутствуют стандарты и четкие критерии установления ультразвукового диагноза варикоцеле. Субклиническое варикоцеле, непальпируемое при физикальном обследовании, чаще выявляется рентгенологически. Большинство авторов согласны с тем, что субклиническим считается варикозное расширение вен семенного канатика менее 3 мм диаметром [29]. В отношении клинической значимости субклинического варикоцеле всегда существовало много дебатов. Исследования показали, что субклиническое варикоцеле не имеет значимого влияния на фертильность и что хирургическая коррекция субклинического варикоцеле не оказывает значимого улучшения фертильности [30]. Тем не менее, по данным наших собственных наблюдений, это далеко не всегда так. Рентгенологические методы исследования должны применяться только в спорных случаях или для диагностики рецидивного или персистирующего варикоцеле.
Несмотря на отсутствие единых подходов к определению показаний к оперативному лечению, Американская урологическая ассоциация рекомендует выполнение операции при варикоцеле у мужчин в случае наличия следующих четырех условий [31]:
1. Нормальная фертильность партнерши или потенциально излечимые факторы нарушения ее фертильности.
2. Подтвержденное бесплодие пары.
3. Пальпируемое варикоцеле или (в случае подозрения) выявленное по данным УЗИ.
4. У партнера имеется один или более нарушенных показателей спермограммы.
Мужчинам, имеющим варикоцеле и измененные показатели эякулята, планирующим зачатие ребенка в будущем, должна быть предложена коррекция варикоцеле. Подросткам оперативное лечение варикоцеле проводят в случае наличия болей в яичке или уменьшения его объема. Если у таких пациентов нет гипотрофии яичка, нужно проводить ежегодное физикальное обследование и анализ эякулята. Эти пациенты и их семьи должны быть информированы о проблемах и противоречиях в определении показаний к оперативному лечению варикоцеле у подростков.
В настоящее время существует несколько общепринятых хирургических доступов при выполнении варикоцелэктомии. Скротальный доступ был предложен первым. В 1904 г. Hartman впервые описал радиальную резекцию мошонки и наружную перевязку варикозно расширенных вен [32]. В настоящее время скротальный доступ не применяется ввиду высокого риска повреждения тестикулярной артерии и высокой частоты рецидивов. Используют три основных хирургических доступа: паховый, подпаховый и ретроперитонеальный (см. рисунок). Ретроперитонеальный доступ можно осуществлять открыто или лапароскопически. Каждый из этих доступов имеет свои достоинства и недостатки. Открытый ретроперитонеальный доступ (Palomo) подразумевает межмышечный доступ. Брюшина сдвигается медиально, и семенные сосуды лигируются латеральнее мочеточника. Лапароскопический ретроперитонеальный доступ также описан с методикой сохранения или резекции артерии. По данным крупных исследований, эффективность лапароскопического оперативного вмешательства не выше открытого, вследствие чего лапароскопия применяется редко [33].
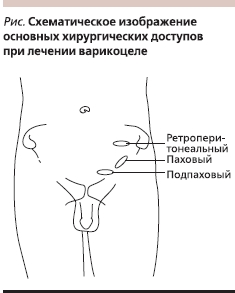
При паховом доступе разрез производят выше наружного пахового кольца и рассекают наружную косую фасцию. Можно выполнить 3–4-сантиметровый “мини”-паховый разрез. Варикоцеле в этой области в основном представлено типичным сосудистым пучком, в котором артерия следует позади или прилегает к венам. Часто рядом присутствуют изолированные вены. Яичковая артерия прилегает к расположенной поверхностно крупной вене приблизительно в 50 % случаев [34].
Подпаховый доступ не требует рассечения фасции, теоретически снижает болезненность и ускоряет заживление раны в послеоперационном периоде. В этой области вены имеют рассыпной тип строения, в связи с чем требуется перевязка большого числа вен малого калибра. Hopps C.V. и соавт. [35] в своей работе продемонстрировали, что внутренние сперматические артерии были окружены сопутствующими венами на подпаховом уровне в 3 раза чаще, чем при паховом доступе. Артерии на этом уровне оканчиваются, и их случайное повреждение вызывает высокий риск развития атрофии яичка. Chan P.T. и соавт. [36] отметили 19 случаев повреждения тестикулярной артерии при 2102 выполненных ими микрохирургических варикоцелэктомиях паховым доступом. Последующая атрофия яичек была отмечена лишь у одного пациента. Тем не менее общий риск развития атрофии яичек был менее 1 %.
Впервые о чрескожной эмболизации варикозно расширенных вен было сообщено в 1978 г. [37]. С тех пор эта методика претерпела множество модификаций. Чрескожная эмболизация варикозно расширенных вен семенного канатика, как правило, не является первичным методом лечения по причине высокой частоты рецидивов. Pryor J.L. и Howards S.S. показали [38], что успех операции достигается в 68 % случаев c учетом неудачных попыток первичного лечения и частоты рецидивов. Использование данной методики оперативного вмешательства оправданно в случаях рецидива варикоцеле, когда требуется проведение рентгенологического исследования.
С широким внедрением новых технологий в хирургическую практику оперативное пособие при варикоцеле также дополнилось некоторыми нововведениями. Хирургический микроскоп и интраоперационное использование допплеровского УЗИ значительно усовершенствовали хирургические методы лечения варикоцеле и как следствие – результаты лечения. Главное преимущество микрохирургического метода перед простой хирургической техникой выполнения варикоцелэктомии заключается в значительном сокращении частоты послеоперационных осложнений, таких как повреждение тестикулярной артерии, развитие гидроцеле и рецидив варикоцеле. Частота развития гидроцеле после немикрохирургической операции варьируется от 3 до 39 % [39, 40], в то время как при использовании хирургического микроскопа такие осложнения редки [41]. Эти результаты обусловлены возможностью более тщательного выделения и сохранения лимфатических сосудов. Частота рецидивов при использовании микрохирургической методики паховым доступом составляет 1–2 % по сравнению с 9–16 % при простой варикоцелэктомии паховым доступом [41–43]. При выполнении стандартной варикоцелэктомии подпаховым доступом рецидив возникает в 5–20 % случаев [40, 44].
В большинстве исследований демонстрируется улучшение параметров эякулята после варикоцелэктомии [5]. Однако в отношении частоты наступления беременности и фертильности данные противоречивы [45–47]. Мета-анализ 22 исследований, включивших 2989 пациентов, перенесших варикоцелэктомию, принес следующие результаты. У 71 % пациентов происходило улучшение показателей спермограммы после операции, а в 37 % случаев отмечено наступление беременности [48].
В последнем Кокрановском обзоре дана оценка всем рандомизированным контролируемым исследованиям, посвященным оперативному лечению варикоцеле [49]. Только 3 из 8 такого рода исследований включали пациентов с изменениями в спермограмме и пальпируемым варикоцеле. В этих работах оценивали результаты лечения 120 больных с варикоцеле и 117 пациентов группы контроля. Анализ показал значительное увеличение частоты наступления беременности у партнерш пациентов, перенесших варикоцелэктомию (36,4 %), по сравнению с группой контроля (20 %). Однако методологическое качество и статистическая сила данных работ были весьма слабыми.
Факторы, обусловливающие эффективность оперативного вмешательства, всегда вызывали интерес у исследователей, поскольку помогали определять группу пациентов с наиболее благоприятными результатами лечения. Marks J.L. и соавт. [50] отметили четыре предоперационных фактора, ассоциирующихся с повышенной частотой наступления беременности у партнерш в послеоперационном периоде:
1) малая степень атрофии яичка;
2) концентрация сперматозоидов более 50 млн;
3) подвижность сперматозоидов более 60 %;
4) уровень сывороточного фолликулостимулирующего гормона менее 300 нг/мл.
Kamal K.M. и соавт. [51] показали, что в группе пациентов с числом сперматозоидов более 5 млн/мл частота наступления беременности партнерши после коррекции варикоцеле составила 61 % по сравнению с 8 % в группе мужчин, у которых число сперматозоидов было менее 5 млн/мл. Хотя в ранних работах отмечали необходимость проведения предоперационного стимулирующего теста с гонадотропин-рилизинг гормоном для определения результатов микрохирургической варикоцелэктомии, в настоящее время доказано отсутствие необходимости в использовании этой методики [52]. Наша клиника в течение длительного времени занимается проблемами диагностики и лечения варикоцеле у мужчин с бесплодием: 355 больным с патозооспермией и варикоцеле (средний возраст – 34,5 ± 8,3 года), из которых 204 были с левосторонним и 151 с двусторонним варикоцеле, после проведения УЗИ сосудов мошонки, оценки гормонального статуса и анализа спермограммы была выполнена подпаховая микрохирургическая варикоцелэктомия слева под эпидуральной анестезией с последующим контрольным обследованием. У всех больных была выявлена астенозооспермия, в 87 % случаев сочетающаяся с тератозооспермией, а в 45 % случаев – с олигозооспермией.
Средняя разница между объемами левого и правого яичек составила 12,3 ± 3,8 %. Средняя длительность операции составила 49 ± 10,3 минуты. В послеоперационном периоде увеличение числа активно подвижных сперматозоидов отмечено у 63,9 % больных, улучшение морфологии – у 54,7 %, наступление беременности у партнерш – в 47,9 % случаев. Частота наступления беременности у партнерш после микрохирургической варикоцелэктомии слева у пациентов с двусторонним варикоцеле была почти 2 раза меньше, чем при одностороннем. Ближайшие и отдаленные послеоперационные осложнения отсутствовали. Наш опыт свидетельствует о необходимости выполнения двусторонней операции у лиц с двусторонним варикоцеле. При контрольной допплерографии через 12 месяцев послеоперационный рецидив выявлен у 2 (0,6 %) больных.
Подводя итоги, следует сказать, что со времени первого упоминания о варикоцеле в I в. наше понимание патофизиологии, методов и результатов лечения значительно возросло. Доказанным считается влияние варикоцеле на мужское бесплодие, что может быть обусловлено нарушением подвижности сперматозоидов, их морфологии и числа, повышением уровней АФК и частоты фрагментаций ДНК. Коррекция варикоцеле, как было показано, улучшает качество эякулята и повышает частоту наступления беременности у партнерш. Методы лечения эволюционировали от скротальных методик до паховых и подпаховых методов с применением микроскопов и допплеровского УЗИ. Применение этих усовершенствований значительно снизило частоту развития интраоперационных осложнений и рецидива варикоцеле. Нам известны положительные результаты лечения варикоцеле у пациентов с азооспермией. Поскольку варикоцеле является главной причиной мужского бесплодия в мире, неудивительно, что исследователи продолжают искать новые пути диагностики и лечения этой сосудистой аномалии.



