Лихорадка является частым симптомом у больных с нейтропенией, возникшей в результате основного заболевания или проведенной химио- и/или лучевой терапии.
Для понимания природы фебрильной нейтропении (ФН) у онкологических или онкогематологических больных следует четко определить понятия “лихорадка” и “нейтропения” [5].
Определение и классификация
Лихорадкой формально считается любое повышение температуры тела выше нормы, но, согласно консенсусу, принятому Обществом по проблемам иммунокомпрометированных больных (Immunocompromised Host Society – ICHS), фебрильной лихорадкой считается повышение температуры (измеренной орально) > 38,5 °С однократно или > 38,0 °С более 2 раз в течение 12-часового периода времени. Однако рабочая комиссия Американского общества по инфекционным заболеваниям (Infectious Diseases Society of America – IDSA) учитывает как фебрильную лихорадку однократное повышение температуры ≥ 38,3 °С или ≥ 38,0 °С в течение по меньшей мере часа. Оральное или ректальное измерение температуры в нашей стране не является общепринятым. Поэтому следует иметь в виду, что оральная температура 38,0 °С соответствует 37,4 °С при измерении в подмышечной впадине (разница составляет 0,6 °С).
Под нейтропенией (критерии токсичности по шкале NCIC-CTC) понимается снижение числа гранулоцитов < 2000 кл/мм³ (0 степень) или 1000–1500 кл/мм³ (1-я степень, легкая), или 1400–1000 кл/мм³ (2-я степень, средняя), или 900–500 кл/мм³ (3-я степень, тяжелая), или < 500 кл/мм³ (4-я степень, угрожающая жизни). Понятие ФН включает только 3-ю и 4-ю степени гематологической токсичности, что требует внутривенного использования противомикробных препаратов, в то время как при 2-й степени антибиотики назначаются перорально, а более легкие степени назначения антибиотиков не требуют.
NCCN (National Comprehensive Cancer Network) было предложено практическое руководство по лечению и профилактике ФН у онкогематологических больных. Под ФН было предложено понимать однократное повышение оральной температуры до 38,3 °С или выше или 38,0 °С или выше в течение более часа. При этом число нейтрофилов должно быть ниже 500/мкл или ниже 1000/мкл с ожидаемым снижением ниже 500/мкл в течение следующих 48 часов [5].
Инфекцию у больных с нейтропенией относят к одной из трех стандартных категорий:
1. Микробиологически доказанная инфекция (МДИ; с инфекцией кровотока или без нее).
2. Клинически доказанная инфекция (КДИ).
3. Лихорадка неясного генеза (ЛНГ, или FUO – fever of unknown origin).
Связь лихорадки с бактериемией более вероятна, если число гранулоцитов составляет < 100 кл/мм³, чем при числе нейтрофилов > 500 кл/мм³.
Диагностика инфекции у больных ФН
В настоящее время не существует достоверных быстрых методик идентификации микроорганизмов и быстрого определения чувствительности к антибиотикам. В отсутствие надлежащего лечения эпизоды инфекции могут быстро стать фатальными, вот почему больные должны получать эмпирическую терапию антибиотиками широкого спектра действия.
Перед началом эмпирической терапии каждый больной должен подвергнуться тщательному клиническому осмотру, рентгенографии легких; ему должны быть произведены клинический и биохимический анализы крови, общий анализ мочи, посев крови, аспирационная биопсия из всех очагов, подозрительных в отношении инфекции [1, 2, 6].
У пациента с выраженной нейтропенией, особенно если она сопровождается анемией, симптомы воспаления могут быть минимальными или даже отсутствовать. Лечение высокими дозами кортикостероидов также может маскировать клинические симптомы инфекции и воспаления, которые и так приуменьшены за счет нейтропении. Слабая реакция или ее отсутствие в ответ на бактериальную инфекцию сопровождается отсутствием типичной картины целлюлита у больного с инфекцией кожи и мягких тканей, инфильтратов на рентгенограмме у больных легочной инфекцией, плеоцитоза в спинномозговой жидкости у больных менингитом, пиурии при инфекции мочевых путей.
Вот почему при едва заметных симптомах, включая болевую реакцию в местах наиболее частой локализации инфекции, необходимо предпринять диагностический поиск в отношении следующих областей: периодонт, глотка, нижний отдел пищевода, легкое, промежность, включая область ануса, глазное дно (фундус) и кожа, включая места аспирации костного мозга, установки сосудистых катетеров, и ткани вокруг ногтей.
Первоначальная оценка должна включать тщательный осмотр больного, клинический анализ крови с подсчетом формулы крови, измерение сывороточных уровней креатинина, мочевины и трансаминаз, посев крови из периферической вены и/или катетера, аспирационные биопсии из всех очагов, подозрительных на наличие инфекции. Рентгенограммы грудной клетки показаны больным, имеющим симптомы со стороны дыхательных путей, и пациентам, которым планируется амбулаторное лечение.
Определение креатинина и мочевины, а также трасаминаз в сыворотке крови необходимо с целью мониторинга возможной лекарственной токсичности. В период проведения интенсивной антибиотикотерапии эти анализы должны производиться не реже 1 раза в 3 дня, а при использовании нефро- и/или гепатотоксичных препаратов (в частности, амфотерицина В) необходимо более частое определение креатинина, трансминаз, а также уровней электролитов.
При бактериемии у больных ФН могут меняться уровни C-реактивного белка, интерлейкина-6 (ИЛ-6), ИЛ-8 и прокальцитонина. Исследования их значения при ФН продолжаются.
Ниже представлены обобщенные рекомендации по использованию микробиологических и других методов диагностики инфекции у больных ФН [2, 4].
Кровь
При подозрении на наличие инфекции кровотока требуется исследование культуры крови.
Микробиологическая диагностика сепсиса основана на исследовании крови, т. е. на установлении бактериемии. Наличие бактериемии – важнейшая предпосылка для развития сепсиса. В то же время в свете последних научных данных факт высева микроорганизма из крови сам по себе не является доказательством сепсиса. Однако диагностика бактериемии – это основная возможность получить данные о возбудителе сепсиса, его чувствительности к антимикробным препаратам. Интерпретация результатов посева крови не проста. На этом этапе необходимо иметь надежные критерии оценки клинической значимости результатов диагностики бактериемии, чтобы “отсекать” ложноположительные случаи и не пропускать истинную бактериемию.
В последние десятилетия отмечается возрастание медицинского значения группы микроорганизмов, называемых факультативно патогенными или оппортунистическими возбудителями инфекций. В сравнении с “классическими” патогенами оппортунистические возбудители относятся к нормальной микрофлоре человека или присутствуют в окружающей среде.
Режимы высокодозной химиотерапии часто становятся причиной глубокой и длительной нейтропении, энтеропатии, мукозита. В таких условиях собственная (эндогенная) микрофлора больного и нормальные обитатели окружающей среды (сапрофиты) становятся возбудителями инфекций кровотока. Микроорганизмы попадают в кровеносное русло главным образом через поврежденные слизистые оболочки, кожу или через внутрисосудистые устройства. У онкогематологических больных желудочно-кишечный тракт часто является источником бактериемии. Внутрисосудистые устройства, высокодозная химиотерапия, профилактика инфекционных осложнений, обусловленных грамотрицательными бактериями, привели к сдвигу в структуре возбудителей бактериемий в сторону грамположительных бактерий. Вследствие этого в условиях онкологического стационара, где сосредоточены все наиболее важные факторы риска развития инфекционных осложнений, трактовка полученных микробиологами результатов является весьма нелегкой задачей.
Наиболее тяжелым инфекционным осложнением с высокой летальностью является сепсис. Летальность повышается с 10 % при его начальных стадиях до 82 % при явлениях сепсиса с полиорганной недостаточностью.
Наиболее распространенный подход по определению клинической значимости эпизода бактериемии определен Центрами по контролю над заболеваемостью США (CDC – Centers for Disease Control, 1988). В соответствии с критериями CDC эпизод бактериемии можно отнести к одной из четырех групп.
Первая группа – эпизоды бактериемии, при которых из крови получен рост “патогенных” микроорганизмов (S. aureus, E. coli, P. aeruginosa, другие грамотрицательные бактерии, Corynebacterium J-K., Candida spp. и прочие грибы).
Вторая группа – эпизоды бактериемии, обусловленные микроорганизмами, имеющими клиническое значение, если их рост получен не менее чем из двух образцов крови в течение суток. При этом обязательно должны быть клинические признаки инфекции (лихорадка, озноб, гипотензия и проч.). К этой группе относятся микроорганизмы, которые обычно являются нормальной микрофлорой открытых биотопов человека (кожа, слизистые оболочка) или окружающей среды (сапрофиты) и часто оказываются “контаминантами” (случайно попавшими).
Для третьей группы используются такие же критерии, как и для 2-й, но рост “контаминантов” может быть получен лишь из одного образца; к этой группе также относятся эпизоды, при которых подозревается катетер-ассоциированная инфекция.
Четвертая группа – все другие ситуации.
В соответствии с критериями CDC, только эпизоды бактериемии 1–3-й групп считаются клинически значимыми [1, 5] .
Существует и иной подход к оценке клинической значимости бактериемии, предложенный иностранными авторами. Он основан на количестве гемокультур, при инкубировании которых получен рост: эпизод бактериемии считается “вероятно клинически значимым”, если рост микроорганизма получен не менее, чем в двух образцах крови в течение суток. Другие эпизоды (однократный рост) относятся к категории “сомнительная клиническая значимость”.
В течение 7 лет в РОНЦ им. Н.Н. Блохина РАМН была зарегистрирована 421 положительная гемокультура, из которой только 224 (53,2 %), согласно вышеуказанным критериям, были признаны значимыми.
Более 80 % всех клинически значимых эпизодов бактериемии были обусловлены следующими микроорганизмами:
• коагулазонегативные стафилококки – 19,2 %;
• E. coliи Enterococcusspp. – 14,7 и 14,3 % соответственно;
• S. aureus – 12,2 %;
• неферментирующие грамотрицательные палочки (кроме P. aeruginosa) – 11,6 %;
• P. aeruginosa – 5,8 %;
• Candida spp. – 6,3 %.
Нижние дыхательные пути
При подозрении на инфекцию нижних дыхательных путей необходим тщательный клинический осмотр, включающий аускультацию для выявления влажных и сухих хрипов, шума трения плевры и признаков плеврального выпота. Рентгенограммы грудной клетки должны производиться при наличии симптомов со стороны дыхательных путей. Дальнейшие исследования включают компьютерную (КТ) и магнитно-резонансную (МРТ) томографии грудной клетки. Показано, что КТ высокой степени разрешения позволяет выявить пневмонию более чем у половины больных ФН, у которых отсутствуют изменения на рентгенограммах. Наличие локальных инфильтратов и особенно полостей предполагает возможную туберкулезную или грибковую инфекцию либо формирование бактериальных абсцессов. Диагноз может быть подтвержден с помощью бронхоальвеолярного лаважа. Однако более доказательной является трансбронхиальная или трансторакальная биопсия, или открытая биопсия легких, что полностью исключает ложноположительные результаты и принятие “колонизаторов” за истинных возбудителей инфекции.
Ротовая полость и верхние дыхательные пути
Необходимо осмотреть рот на наличие язв, пузырей и гингивита, а также рот и глотку – на наличие белых пятен и псевдомембранозного воспаления, указывающего на вероятное наличие грибов рода Candida. Эритема, стоматит, язвы могут указывать на инфекцию, вызванную вирусом простого герпеса. Полость носа должна быть осмотрена на предмет ринита, наличия корок, язв, кровотечения. Мазки или соскобы из полости рта, с десен или повреждений слизистой оболочки глотки должны быть исследованы микробиологически, а также серологически на наличие вирусов. Язвы и бляшки требуют биопсии и гистологического исследования. Параназальные синусы должны быть обследованы с помощью КТ или МРТ для исключения утолщения слизистой оболочки, облитерации просвета пазухи и эрозии кости.
Рутинные посевы из передних носовых ходов, ротоглотки (как и посевы мочи и фекалий) в отсутствие поражения органов дают мало клинически полезной информации и могут быть использованы только в целях инфекционного контроля.
Кожа и мягкие ткани
На коже могут присутствовать как изменения, характерные для первичной инфекции, так и вторичные повреждения вследствие диссеминации инфекции. Особое внимание следует уделять осмотру кожи на предмет выявления покраснения, отека, напряжения или патологических выделений в периоральной, паховой или перианальной областях. При наличии вышеуказанных повреждений отделяемое должно быть подвергнуто микробиологическому исследованию, а сами изменения сфотографированы.
Пищеварительный тракт
При наличии симптомов со стороны пищевода (ощущение дискомфорта за грудиной, боль или дисфагия) даже в случае нейтропении следует выполнять эндоскопическое исследование пищевода с забором материала для микробиологического исследования. Если имеется сопутствующая тромбоцитопения, процедура должна быть выполнена после переливания тромбоконцентрата.
При подозрении на тифлит/некротизирующий энтероколит производятся ультразвуковое исследование (УЗИ), КТ, МРТ, которые могут показать утолщение слизистой оболочки слепой или восходящей кишки. У больных ФН, имеющих диарею, колоно- и сигмоскопии часто противопоказаны.
При наличии диареи, следует выполнить анализ кала на патогенную группу. При этом могут быть выделены Clostridium spp., Salmonella spp., Shigellaspp., Campylobacterspp., Aeromonasspp., Yersiniaspp. и такие простейшие, как Cryptosporidium. Особое внимание следует обратить на возможность инфекции, вызванной С. difficile, определяемой в посевах и путем определения выделяемых ею токсинов А и В. Соответствующие меры должны быть приняты для предотвращения распространения нозокомиальной инфекции, вызываемой этим микроорганизмом.
Перианальные повреждения в сочетании с болями, индурацией, наличием отделяемого, кровоточивостью указывают на развитие парапроктита. Мазки и отделяемое из этой области исследуются бактериологически с целью идентификации возбудителя.
Печень
При подозрении на гепатолиенальный кандидоз в дополнение к лабораторным исследованиям целесообразно выполнять УЗИ, КТ, МРТ, способные показать увеличение печени с локальными очагами или без них.
Мочевыводящие пути
Бактериологическому исследованию подвергается средняя порция мочи или моча, взятая катетером. Посевы мочи показаны при наличии симптомов мочевой инфекции, изменений в анализах мочи. Следует помнить, что у больных нейтропенией пиурия может отсутствовать даже при развитии уроинфекции. Рентгенорадиологические исследования могут выявить наличие обструкции или расширение почечных лоханок.
Сердечно-сосудистая система
Инфекции кровотока могут быть причиной или следствием эндокардита. Вегетации на клапанах могут быть обнаружены при трансторакальной или чреспищеводной УЗИ или КТ/МРТ. Септический тромбофлебит может быть следствием присутствия постоянных внутрисосудистых катетеров и способен увеличить тяжесть инфекции кровотока. Протяженность тромбофлебита может быть определена с помощью УЗИ/допплеровского метода исследования.
Опорно-двигательный аппарат
При наличии остеомиелита рентгенография кости в прямой проекции, КТ или МРТ часто подтверждают наличие очагового поражения. Дополнительная информация может быть получена при скенировании костей с 99mTc. Подозрение на септический артрит, возникший в результате септицемии, должно быть подтверждено взятием аспирата с посевом и окраской по Граму.
Центральная нервная система
Исследование спинномозговой жидкости в качестве рутинной процедуры не рекомендуется. Посев ликвора следует производить только при клиническом подозрении на инфекцию ЦНС в отсутствие выраженной тромбоцитопении. При этом у больных с менингитом на фоне ФН лейкоцитоз в ликворе может отсутствовать. Симптомы менингита, очагового или диффузного энцефалита требуют выполнения КТ или МРТ головного мозга. При наличии очаговых повреждений показана биопсия.
Факторы риска инфекции при нейтропении
Данные о риске тяжелых инфекций в зависимости от характера нейтропении представлены в табл. 1.
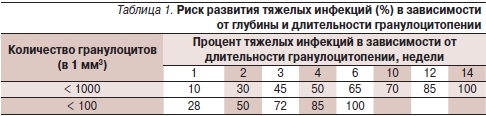
Нейтропения 500 кл/мм³ в течение 7 дней и более считается основным фактором риска развития первичной инфекции, ее рецидивов или вторичной инфекции, несмотря на проведенную антибиотикотерапию. Пациенты с ФН, попадающие в эту группу, считаются больными с высоким риском тяжелой инфекции [3, 6]. Более подробно факторы риска инфекционных осложнений при ФН представлены в табл. 2.
* Не во всех случаях имеется высокий риск осложнений: например, катетер-ассоциированная бактериемия, вызванная коагулонегативными стафилококками или грамотрицательными бактериями, без гемодинамических нарушений потенциально может лечиться амбулаторно.
К факторам, свидетельствующим в пользу низкого риска тяжелой инфекции среди больных нейтропенией, относятся:
• абсолютное число нейтрофилов ≥ 100 кл/мм³;
• абсолютное число моноцитов ≥ 100 кл/мм³;
• нормальная рентгенограмма грудной клетки;
• нормальные или близкие к норме биохимические показатели функции почек и печени;
• длительность нейтропении < 7 дней;
• ожидаемое разрешение нейтропении в течение < 10 дней;
• отсутствие инфекции в месте стояния внутривенного катетера;
• ранние признаки восстановления костного мозга;
• наличие злокачественной опухоли в стадии ремиссии;
• максимальная температура < 39,0 °С;
• отсутствие неврологических и ментальных нарушений;
• отсутствие признаков заболевания;
• отсутствие болей в животе;
• отсутствие серьезных осложнений (шок, гипоксия, пневмония или другие инфекции внутренних органов, рвота, диарея).
В международном кооперированном исследовании, включившем 1139 онкологических больных ФН, была создана и ратифицирована балльная система для определения в момент начала лихорадки пациентов с низким риском осложнений, включая низкий риск смерти.
К факторам, ассоциирующимся с низким риском осложнений и более высокой частотой благоприятных исходов (p < 0,001), были отнесены: возраст до 60 лет (дети не включались); достижение частичного или полного регресса опухоли; отсутствие симптомов или слабые/умеренные симптомы заболевания; нахождение вне стационара в момент начала лихорадки; температура < 39,0 °С; нормальная рентгенограмма грудной клетки; отсутствие гипотензии; частота дыхательных движений ≤ 24/мин; отсутствие хронических легочных заболеваний, сахарного диабета, спутанного сознания или других нарушений менталитета, кровопотери, дегидратации; отсутствие в анамнезе грибковой инфекции и противогрибковой терапии в течение 6 месяцев до начала лихорадки. Весомость семи характеристик была обозначена целыми числами, и на этой основе разработана шкала индекса риска. Оценка по шкале индекса риска ≥ 21 балла позволяла выявить больных с низким риском осложнений с положительной прогностической точностью 91 %, специфичностью 68 % и чувствительностью 71 % (табл. 3). Максимальное число баллов составляет 26.
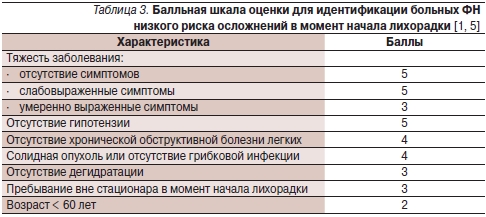
Данная оценочная шкала не применима к пациентам моложе 16 лет. Первоначальное число моноцитов ≥ 100 кл/мм³, отсутствие сопутствующих заболеваний, нормальные рентгенограммы грудной клетки указывают на то, что у ребенка низкий риск значимых бактериальных инфекций.
Ожидаемая частота ФН в зависимости от режимов применяемых цитостатических препаратов отражена в табл. 4.
Рациональные подходы к терапии ФН на основе факторов риска
При выборе первоначального режима антибиотикотерапии следует учитывать вид, частоту выявления и антибиотикочувствительность микроорганизмов, выделенных в том же учреждении от других пациентов (т. е. данные микробиологического мониторинга) [5].
В табл. 5 показан алгоритм выбора первоначальной эмпирической терапии. Чтобы сделать правильный выбор, необходимо определить, имеет ли больной низкий или высокий риск серьезных, угрожающих жизни инфекций в момент начала ФН. Если риск высокий, следует использовать внутривенные антибиотики. Если риск низкий, больной может получать лечение как внутривенными, так и пероральными антибиотиками.
Примечание. Повторная оценка через 3–5 дней лечения.
Противовирусные препараты показаны, только если имеются клинические или лабораторные признаки вирусного заболевания.
Терапия ФН у больных с низким риском развития инфекции
Схемой выбора при проведении пероральной антибиотикотерапии у этой категории пациентов является комбинация: ципрофлоксацин 500–750 мг × 2–3 раза в сутки + амоксициллин/клавуланат 625 мг × 3 раза в сутки.
Альтернативой при аллергии к пенициллинам является схема: ципрофлоксацин (в том же режиме) + клиндамицин 600 мг × 3 раза в сутки.
Следует иметь в виду, что фторхинолоны не должны использоваться в первой линии терапии ФН у больных, ранее получавших профилактику препаратами этой группы.
Помимо пероральной терапии в лечении больных с ФН низкого риска развития инфекции может использоваться внутривенная комбинация: цефтриаксон 2–4 г в сутки + амикацин 15 мг/кг в сутки. По эффективности она эквивалентна комбинации: цефтазидим 6 г в сутки + амикацин (в том же режиме).
Возможно лечение цефтриаксоном в монорежиме, но только в тех стационарах, где синегнойная инфекция является редкостью.
Вопрос о проведении больному с ФН пероральной антибиотикотерапии может рассматриваться только в отсутствие явного очага инфекции или симптомов (например, гипотензии), позволяющих заподозрить начинающийся сепсис.
Как альтернатива амбулаторной терапии возможна кратковременная госпитализация отдельных больных для проведения первоначальной внутривенной терапии, обследования и последующего перехода на пероральную терапию в поликлинических условиях.
Лечение антибиотиками больных ФН группы низкого риска должно продолжаться в течение 7 дней или более, если не было достигнуто исчезновения симптомов и не произошла эрадикация возбудителя инфекции. Желательно, чтобы при отмене антибиотиков число нейтрофилов превышало 500 кл/мм³.
Если после нескольких дней лечения антибиотиками у пациента с нейтропенией < 500 кл/мм³ отсутствуют симптомы и очаги инфекции, по усмотрению врача антибиотикотерапия может быть прекращена, но в этом случае необходимо самое тщательное наблюдение за состоянием больного.
Если через 5 дней от начала антибиотикотерапии повышение температуры сохраняется и причина лихорадки не ясна, возможен выбор 1 из 3 вариантов:
• продолжить лечение первоначальным антибиотиком(ами);
• сменить или добавить антибиотик(и);
• добавить противогрибковый препарат, иногда со сменой антибиотиков.
Четвертый вариант – отмена всех антимикробных препаратов – используется при подозрении на неинфекционное происхождение лихорадки.
В период проведения амбулаторной терапии ФН оценка состояния больного должна производиться ежедневно, а при ухудшении состояния, развитии серьезных инфекций или нежелательных явлений необходима госпитализация пациента.
Терапия ФН у больных с высоким риском развития инфекции (внутривенная терапия)
Существует три основные схемы внутривенной антибиотикотерапии, обладающие схожей эффективностью: монотерапия, двухкомпонентная терапия без гликопептида (ванкомицина) и комбинированная терапия, включающая гликопептид (ванкомицин) + 1 или 2 антибиотика. Следует иметь в виду, что у конкретного больного и в конкретном учреждении любая из вышеупомянутых схем может подходить в большей степени (табл. 5).
При наличии показаний к внутривенной антибиотикотерапии ФН прежде всего необходимо решить, нуждается ли больной в терапии ванкомицином. Если нуждается, следует начать лечение с двух- или трехкомпонентной комбинации (ванкомицин + цефепим или цефтазидим или карбапенем ± аминогликозид). Если ванкомицин не показан, в неосложненных случаях можно начать внутривенную монотерапию цефалоспорином или карбапенемом. Двухкомпонентная комбинация без ванкомицина может быть использована для лечения осложненных случаев или если в стационаре существует серьезная проблема антибиотикорезистентности микроорганизмов.
Тактика антибиотикотерапии в течение первой недели лечения
Если лихорадка у больного ФН прекратилась в первые 3–5 дней лечения, при неизвестном возбудителе следует продолжить начальную антибиотикотерапию, а при идентификации патогенна лечение следует, соответственно, скорректировать. Если пациент группы низкого риска находился в стационаре, он может быть выписан на амбулаторное лечение.
Если через 3–5 дней от начала антибиотикотерапии повышение температуры сохраняется, необходимо повторно оценить больного. Может быть продолжена первоначальная антибиотикотерапия, но если в состоянии больного нет существенных изменений, показана отмена ванкомицина. Если состояние пациента ухудшается, показана смена антибиотикотерапии. При этом необходимо обсудить вопрос о назначении ванкомицина, если он ранее не применялся. В случаях, когда лихорадка сохраняется в течение 5–7 дней и нейтропения будет долго сохраняться, к терапии следует добавить противогрибковые средства (со сменой антибиотикотерапии или без нее).
Тактика в отношении длительности антибиотикотерапии в зависимости от наличия или отсутствия лихорадки, группы риска и уровня нейтропении представлена в табл. 6.
Примечание. АЧН – абсолютное число нейтрофилов, АТ – антибиотикотерапия.
Антибиотикопрофилактика (АБП) при нейтропении
Начиная с 1980-х гг. в ряде исследований было показано, что частота фебрильных эпизодов и инфекций при нейтропении может быть снижена при назначении антибиотиков в ее раннем афебрильном периоде. Однако, несмотря на возможную выгоду от назначения антибиотиков широкого спектра действия, АБП имеет свои отрицательные стороны, такие как токсичность, рост антибиотикорезистентности бактерий и развитие грибковых суперинфекций [1–3].
Афебрильные пациенты, у которых ожидается глубокая нейтропения (< 100 кл/мм³), имеют больший риск развития резистентных инфекций, чем больные, у которых ожидаемое число нейтрофилов будет > 500 кл/мм³. Другими важными факторами риска инфекций, вызванных резистентными микроорганизмами, являются использование постоянных внутрисосудистых катетеров, неодноразового инструментария (например, эндоскопического), наличие заболеваний периодонта, зубоврачебные процедуры в анамнезе, постобструктивная пневмония, наличие злокачественного новообразования, трансплантация органа, иммунокомпрометированное состояние больного. Следует также считаться с личностными факторами, такими как согласие больного с предписанной АБП (комплаентность), гигиенические навыки, и факторами, связанными с окружающей средой (пациент находится в стационаре или дома).
В прошлом для профилактики инфекций у больных ФН использовались комбинации неабсорбируемых препаратов, таких как аминогликозиды, полимиксины и ванкомицин. Проспективные рандомизированные исследования последовательно показали, что применяемые с той же целью перорально абсорбируемые препараты, такие как триметоприм/сульфаметоксазол (ко-тримоксазол) и фторхинолоны, более эффективны и лучше переносятся больными. Кроме того, растущая частота антибиотикорезистентности настоятельно рекомендует отказаться от использования ванкомицина с профилактической целью.
В настоящее время с целью АБП при нейтропении используются в основном два типа перорально абсорбируемых антибиотиков. Это ко-тримоксазол и фторхинолоны (ципрофлоксацин, левофлоксацин и моксифлоксацин).
АБП ко-тримоксазолом рекомендуется всем больным, имеющим риск развития пневмонии, вызываемой P. carinii, независимо от того, есть у них нейтропения или нет.
В то же время нет консенсуса в отношении целесообразности рутинного использования ко-тримоксазола или фторхинолонов у всех афебрильных больных с нейтропенией. Это в значительной степени связано с возможным увеличением числа антибиотикорезистентных бактерий в результате чрезмерного использования антибиотиков. В отдельных случаях у больных с глубокой и пролонгированной нейтропенией АБП комбинацией фторхинолонов с пенициллином или ко-тримоксазолом может применяться в критические периоды времени, если целесообразность АБП перевешивает риск, связанный с увеличением числа резистентных микроорганизмов.
Рутинное использование флуконазола или итраконазола для профилактики грибковой инфекции при нейтропении не рекомендуется. Однако в определенных обстоятельствах, в которых частота системной инфекции, вызванной C. albicans, высока, а частота системной инфекции, вызванной другими представителями Candida spp. и Aspergillus spp., низка, ряд врачей могут выбрать назначение противогрибковой профилактики.
Таким образом, несмотря на эффективность АБП ко-тримоксазолом, фторхинолонами, флуконазолом и итраконазолом в отношении снижения числа эпизодов инфекции в период нейтропении, следует иметь в виду возможность возникновения и распространения резистентных штаммов бактерий и грибов. Имеются данные о влиянии профилактики на смертность больных. Рутинное назначение TMPSMZ показано и пациентам с нейтропенией, а также повышенным риском развития пневмонии, вызываемой P. carinii. Аксиомой профилактики является то, что используемый антибиотик должен назначаться в течение возможно более короткого периода времени и у возможно меньшего числа больных.
Защита кроветворения
Профилактика ФН тесно связана с вопросами защиты кроветворения при проведении химиотерапии у онкологических больных. В процессе химиотерапии происходит не только количественное подавление числа гранулоцитов, но и снижение их функциональной способности. Это подтверждается уменьшением числа маркеров миелоидной дифференцировки, особенно у больных с III–IV стадиями болезни. В связи с этим, коррекция миелосупрессии при проведении химиотерапии должна быть направлена не только на предупреждение гибели клеток, но и на восстановление утраченных функций клеток-предшественников миелоидного ряда.
Используемые в настоящее время в клинической практике колониестимулирующие факторы уменьшают степень гематологической токсичности, в основном, за счет стимуляции пролиферации клеток-предшественников, поврежденных в результате цитотоксической химиотерапии, а также частично за счет дифференцировки и выброса в периферическую кровь зрелых гранулоцитов из депо [9].
Российскими учеными разработан пероральный препарат дикарбамин, который представляет собой 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты с молекулярной массой 225. Препарат Дикарбамин® изучен в эксперименте и показал свойства гематопротектора, действие которого состоит в уменьшении степени нейтро- и лейкопении, а также сокращении сроков восстановления кроветворения при комбинированной миелосупрессивной химиотерапии с использованием циклофосфамида, доксорубицина, гемцитабина и препаратов платины.
При этом показано, что Дикарбамин® запускает дифференцировку на этапе ранних миелоидных предшественников, сдвигая блок дифференцировки на несколько ступеней, о чем свидетельствует модуляция антигена CD3.
Также продемонстрировано, что Дикарбамин®, защищая клетки костного мозга от неблагоприятного влияния на них химиопрепаратов, в то же время в определенной степени подавляет пролиферацию опухолевых клеток, способствует их дифференцировке, замедляет рост экспериментальных новообразований и не оказывает тормозящего влияния на эффект цитостатической химиотерапии у онкологических больных [7].
На основании ряда доклинических экспериментальных данных препарат Дикарбамин® был разрешен для клинического изучения.
Клиническое исследование Дикарбамина® было проведено у 34 больных раком яичников, получавших миелосупрессивную химиотерапию по схеме циклофосфамид 600 мг/м² и карбоплатин 400 мг/м². Показано, что ежедневный прием дикарбамина в дозе 100 мг/сут по профилактической схеме начиная за 5 дней до химиотерапии, на фоне проведения химиотерапии и затем до следующего курса, приводит к статистически значимому снижению частоты нейтропении III–IV степеней (р = 0,047) и не влияет на показатели лейко- и тромбоцитопении (р = 0,92 и 0,505 соответственно).
Сравнительное электронно-микроскопическое исследование гемопоэтических клеток костного мозга больных раком яичников при комбинированной химиотерапии с применением Дикарбамина® и без него позволило выявить механизм его защитного эффекта от цитотоксического влияния использованных препаратов. Показано, что схема циклофосфамимид + карбоплатин вызывает выраженное цитотоксическое действие на различные типы гемопоэтических клеток гранулоцитарного, лимфоидного и эритроидного рядов, которое проявляется в виде дистрофических изменений в цитоплазме и гибели специфических гранул. Эти изменения наиболее выражены в гранулоцитарных клетках уже на ранних стадиях их дифференцировки. В результате образуется дефицит дифференцированных функционально полноценных форм гемопоэтических клеток. Кроме того, в элементах гранулоцитарного ряда усиливается генетически запрограммированная клеточная гибель – апоптоз. В целом дистрофические изменения и апоптоз ведут к развитию лейкопении, нейтропении, тромбоцитопении и других нарушений гемопоэза и ограничивают возможности химиотерапии.
Дикарбамин®, применяемый до, на фоне и после химиотерапии, защищает гемопоэтические клетки от миелосупрессивного действия и, что особенно важно, способствует дифференцировке молодых форм нейтрофильного ростка в зрелые клеточные элементы, а также снижает явления апоптоза. Этот феномен обусловливает защитный эффект Дикарбамина® в отношении клеток-предшественников гранулоцитарного ряда. Полученные авторами данные позволяют заключить, что дикарбамин может рассматриваться в качестве протектора гематологической токсичности у онкологических больных, получающих миелосупрессивную химиотерапию.
В другом исследовании Дикарбамин® вводили 138 онкологическим больным раком яичников, получившим 403 курса различных схем комбинированной миелосупрессивной химиотерапии. Было показано, что Дикарбамин® в дозе 100 мг при приеме за 5 дней до, на фоне и после химиотерапии приводит к статистически значимому уменьшению лимитирующей нейтро- и лейкопении III + IV степеней как по числу пациентов, так и по курсам лечения. Прием Дикарбамина® позволяет проводить лечение в запланированные сроки без снижения доз цитостатиков и уменьшает риск гематологических осложнений в 2–4 раза. Механизм защитного действия дикарбамина на кроветворные клетки костного мозга был связан с индукцией дифференцировки молодых форм до зрелых клеточных элементов и с уменьшением явлений апоптоза [10].
При применении Дикарбамина® у 33 больных лимфомой Ходжкина положительный эффект дикарбамина отмечен у 27 больных, т. е. в 81,8 % наблюдений [11]. Протекторный эффект отсутствовал только у 6 из 33 больных, причем у 1 из них имелись поражения печени и гепатит в анамнезе, у 2 кроме химиотерапии ранее проводилось лучевое лечение по радикальной программе – в 2 наблюдениях при поражении костей. Примечательно, что у этих больных предыдущие курсы (без Дикарбамина®) сопровождались тяжелой миелодепрессией, требовавшей интенсивной гемостимуляции деринатом, интерлейкином-1β или даже препаратом гемопоэтических колониестимулирующих факторов – филграстимом. Углубленный анализ обнаруженного феномена, протекторного действия Дикарбамина®, показывает, что наиболее выраженный эффект препарата наблюдается именно при глубоких лейкопениях и нейтропениях III–IV степеней.
В частности, не оказалось достоверных различий между циклами полихимиотерапии (ПХТ), проводившимися с Дикарбамином® или без него при изначальных минимальных исходных нарушениях лейкопоэза – лейкопении и гранулоцитопении I–II степеней по шкале CTC-NCIC. Наоборот, высокая достоверность (p < 0,001) феномена протекторного действия Дикарбамина® наблюдалась при лейкопении и гранулоцитопении III и IV степеней.
Подобные же закономерности отмечаются при сопоставлении частоты гранулоцитопений различной степени после циклов ПХТ без Дикарбамина® (“контрольных”) и последующих – с дикарбамином. При “контрольных” курсах без Дикарбамина® нейтропении той или иной степени (I–IV) наблюдались у 100 % больных, в период же проведения цикла с Дикарбамином® у 30,3 % больных число гранулоцитов оставалось в пределах нормы (лейкопения 0 степени). Указанные различия оказались статистически высокодостоверными (р = 0,003). Таким образом, Дикарбамин® при начале приема за 5 дней до планируемого цикла и продолжении его в течение 15 дней в дозе 100 мг/сут при назначении внутрь обладал протекторным действием в отношении токсического угнетения лейкопоэза, у 82 % больных при 100 % миелодепрессии в “контрольных” предыдущих циклах. Подобный статистически достоверный эффект выражается в уменьшении глубины лейкопении и гранулоцитопений (нейтропении), а также сокращении сроков восстановления лейкопоэза до нормы, что в свою очередь позволило проводить химиотерапию в планируемые сроки и с должной интенсивностью [8].
Дикарбамин® не обладал в вышеуказанной дозе каким-либо токсическим действием (в т. ч. и при длительном приеме) или отрицательным влиянием на опухоль и эффективность химиотерапии.
Таким образом, препарат Дикарбамин® может быть рекомендован в качестве средства снижения гематологической токсичности у онкологических больных, получающих миелосупрессивную химиотерапию.


