Рак молочной железы (РМЖ) является гетерогенным заболеванием, в настоящее время классифицированным в четыре основных подтипа:
1. базально-подобный, обычно не экспрессирующий рецепторы стероидных гормонов (ЭР-/ПР-) и HER2 (часто трижды негативный);
2. люминальный А (ЭР-позитивный, низкой степени злокачественности);
3. люминальный В (ЭР-позитивный, высокой степени злокачественности);
4. HER2-позитивный [1].
Установление этих подтипов базируется на профиле генной экспрессии, а также на традиционных клинических и патоморфологических (имунногистохимических) параметрах, таких как статус ЭР, ПР и HER2, гистологическая степень злокачественности и наличие специфических маркеров пролиферации (Ki67).
На сегодняшний день очевидна клиническая значимость определения субпопуляций больных РМЖ и установлено, что один и тот же подход к лечению не пригоден для всех пациентов. Мы вступаем в эру выделения субпопуляций, и основные задачи на сегодняшний день – обновление подходов к лечению для каждого подтипа опухоли, а также подбор лечения в соответствии с риском рецидива, эффектом лечения и нежелательными побочными эффектами терапии. В случае ЭР-положительных HER2-негативных опухолей основным вопросом является выделение категории больных, для которых химиотерапия принесет дополнительную пользу эндокринотерапии. В случае трижды негативных (или базальноподобных) опухолей речь идет об оптимизации схем химиотерапии и поиске новых таргетных агентов, способных существенно улучшить результаты лечения. Наконец, в 15–20 % случаев РМЖ, характеризующихся гиперэкспрессией HER2, успешное применение трастузумаба привело к значительным улучшениям результатов лечения. В обзоре, выполненном Spector и Blackwell [2], подчеркивается ряд областей, нуждающихся в дальнейшем исследовании. Проводящиеся исследования позволят более точно объяснить механизмы действия трастузумаба и понять, какие опухолевые маркеры помимо гиперэкспрессии HER2 предсказывают эффективность его применения.
На доклиническом этапе выделено минимум пять вне- и внутриклеточных механизмов противоопухолевого действия трастузумаба. К ним относятся активация антитело-опосредованной цитотоксичности, блокада отделения внеклеточного домена, нарушение внутриклеточных сигналов, снижение активности процесса ангиогенеза, снижение процессов восстановления повреждений ДНК. Эти эффекты приводят к остановке клеточного цикла и/или гибели клетки [2]. Преимущества терапии, в основе содержащей трастузумаб, уже были продемонстрированы как при раннем, так и при распространенном РМЖ. Кроме того, продемонстрирована польза от применения трастузумаба после прогрессирования, что подтверждает необходимость длительной супрессии сигнального пути HER2. Различные подходы к таргетному воздействию как на HER2, так и на другие сигнальные пути могут усилить клинический эффект, наблюдаемый при применении трастузумаба.
HER2 является привлекательной мишенью для таргетной терапии по ряду причин. В настоящее время считается, что от 20 до 25 % всех случаев РМЖ сопряжены с амплификацией гена HER2 или гиперэкспрессией протеина HER2 [3–4]. Поскольку каждый год в мире выявляется свыше миллиона новых случаев РМЖ, HER2-положительные опухоли представляют достаточно значимую подгруппу [5]. Гиперэкспрессия HER2 при РМЖ – предиктор худшего исхода и нарушает работу сигнальных сетей, регулирующих процессы роста и выживания. Примером может служить одновременная стимуляция сигнального пути, ответственного за выживание клетки PI3К-Akt и ядерного фактора κВ (NF-κB) – мощного медиатора воспаления, защищающего клетку от стимуляторов апоптоза (например, химиотерапии) [6, 7]. Сурвивин, представитель семейства ингибиторов апоптоза, эффекты которого при злокачественных опухолях человека связаны с резистентностью к химиотерапии, также управляется HER2 [8]. Блокада активации HER2 в доклинических моделях РМЖ и при раннем раке у женщин, подвергшихся анти-HER2-терапии, приводит к блокировке сигнальных путей выживания, что вызывает апоптоз [9].
Было проведено четыре крупных исследования адъювантного лечения трастузумабом больных с HER2-позитивным ранним РМЖ. В двух из этих исследований, NSABP B-31 и NCCTG N9831, производилось сравнение терапии доксорубицином и циклофосфамидом с последующим применением паклитаксела с трастузумабом или без него. В связи со схожестью дизайна этих двух исследований данные были объединены для анализа [10]. Обновленный анализ (средняя продолжительность наблюдения – 2,9 года) показал повышение безрецидивной выживаемости на 52 % и общей выживаемости на 35 % при добавлении 1-годичной адъювантной терапии трастузумабом к химиотерапии [11]. Повышение безрецидивной выживаемости наблюдалось вне зависимости от размера опухоли, числа пораженных лимфоузлов и статуса рецепторов стероидных гормонов и возраста.
В исследовании HERA проводилось сравнение химиотерапии с последующим назначением адъювантной монотерапии трастузумабом на 1 или 2 года в сравнении с наблюдением [12].
С декабря 2001 по июнь 2005 г. в исследование были включены 5102 женщины с HER2-положительным операбельным РМЖ, завершившие местно-регионарную терапию (хирургическое лечение ± радиотерапия) и получившие минимум 4 цикла химиотерапии (неоадъювантной или адъювантной).
На основе рандомизации пациентки были распределены в 3 группы: 1698 – в группу наблюдения, 1703 – в группу 1-летнего лечения трастузумабом и 1701 – в группу 2-летнего лечения трастузумабом. Терапия трастузумабом проводилась посредством внутривенных инфузий более 90 минут каждые 3 недели (начальная нагрузочная доза – 8 мг/кг, затем – 6 мг/кг) [12].
При промежуточном анализе в группе наблюдения 50,7 % больных позже вошли в группу перехода “crossover” на лечение трастузумабом [13].
Среди 827 “событий”, принятых для определения безрецидивной выживаемости, 458 (27 %) “событий” отмечено в группе наблюдения и 369 (21,7%) –в группе одногодичного лечения трастузумабом. Среди “событий” чаще всего фигурировали отдаленные метастазы (320,0–8,8 против 251,0–4,8 %), метастазы в головной мозг (32 против 37 случаев), местно-регионарный рецидив (100,0–,9 против 79,0–,6 %); рак противоположной молочной железы (19,0–,1 против 14,0–,8 %); второе злокачественного заболевание (немолочной железы) (14,0–,8 против 19,0– 1,1 %); смерть без предшествующего рецидива (5,0–,3 против 6,0–,4 %). Нескорректированное относительное сокращение риска в отношении безрецидивной выживаемости у больных, рандомизированных в группу одногодичного лечения трастузумабом, в сравнении с группой наблюдения составило 0,76 (95 % доверительный интервал [95 % ДИ] – 0,66, 0,87; p = 0,001; рис. 1). Это означает 24 %-ное относительное и 6,4 %-ное абсолютное увеличение безрецидивной выживаемости (78,6 против 72,2 %) в течение 4 лет. Сводные данные крупных клинических испытаний адъювантного применения трастузумаба представлены в таблице [13–17].
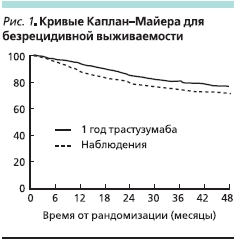
Среди общего числа 395 смертельных исходов 213 зарегистрировано в группе наблюдения и 182 в группе одногодичного лечения трастузумабом. Нескорректированный риск смерти (HR) равнялся 0,85 (95 % ДИ – 0,70, 1,04; p = 0,11), что означает тенденцию к увеличению показателей общей выживаемости на 15 % у больных, рандомизированных в группу 1-годичного лечения трастузумабом в сравнении с группой наблюдения (рис. 2). Абсолютное увеличение общей выживаемости равнялась лишь 1,6 % (89,3 против 87,7 %) за 4 года наблюдения.
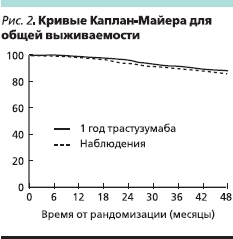
Результаты исследования HERA подтверждают, что одногодичное лечение трастузумабом имеет заметные преимущества у женщин с операбельным РМЖ, имеющих гиперэкспрессию HER2. Значительные выгоды в отношении безрецидивной выживаемости отмечены при медиане годичного наблюдения и сохраняются при медиане наблюдения, равной 4 годам, несмотря на переход значительной части женщин группы наблюдения на лечение трастузумабом. Преимущества в отношении общей выживаемости еще недостаточно достоверны, но наблюдается тенденция к ее увеличению.
Наблюдаемое “затухание” эффективности трастузумаба с течением времени, по-видимому, связано с тем, что более половины (52 %) пациенток группы наблюдения перешли на лечение трастузумабом. Данный эффект не наблюдался при 2-летней медиане наблюдения, наиболее вероятно, вследствие короткого периода наблюдения после перехода на тот момент (медиана – 2,6 месяца против 29,1 в данном анализе).
Невозможно точно определить вклад “перехода” на трастузумаб на исход заболевания. “Переход” не был рандомизирован, и “перешедшие” пациентки не имели ранних рецидивов заболевания, причем именно их отсутствие и было критерием перехода на трастузумаб. Другие крупные исследования по оценке одногодичного лечения трастузумабом показали, что эффективность при переходе значительно ниже. Клиническое исследование международной группы по РМЖ 006 (BCIRG – c участием НИИ онкологии им Н.Н. Петрова) оценивает трастузумаб в комбинации или с доцетакселом после доксорубицина/циклофосфамида (АС-ТН) или с доцетакселом плюс карбоплатин (TCarboH) в сравнении с контрольной группой АСТ. Только 1,6 % пациенток контрольной группы перешли на трастузумаб. В третьем плановом анализе эффективности (медиана наблюдения – 5,5 лет), АС-ТН и TCarboH обе были ассоциированы с достоверным увеличением безрецидивной выживаемости на 36 и 25 % (AC-TH: HR – 0,64; 95 % ДИ – 0,53, 0,78; p < 0,01; TCarboH: HR – 0,75; 95 % ДИ – 0,63, 0,90; p = 0,04) и общей выживаемости на 37 и 23 % (AC-TH: HR – 0,63; 95 % ДИ – 0,48, 0,81; p < 0,001; TCarboH: HR – 0,77; 95 % ДИ – 0,60, 0,99; p = 0,038) в сравнении с группой АСТ [17]. В комбинированном анализе клинического исследования NCCTG N9831/NSABP В-31 20,9 % пациенток контрольной группы перешли на лечение трастузумабом. Обновленный анализ эффективности (медиана наблюдения – 2,9 года) показывает, что комбинация трастузумаба с паклитакселом после АС статистически достоверно увеличивает безрецидивную выживаемость на 51 % (HR – 0,49; 95 % ДИ – 0,41, 0,58; p = 0,0001) и общую выживаемость на 37 % (HR – 0,63; 95 % ДИ – 0,49, 0,81; p = 0,0004) в сравнении с одной химиотерапией [15]. Последний пересмотр исследования № 9831 при медиане наблюдения 5,5 лет свидетельствует о превосходстве группы “перехода” над контрольной (HR – 0,70; 95 % ДИ – 0,57, 0,86; p < 0,001), что подтверждает клиническую выгоду последовательного подхода, который используется в исследовании HERA.
Больные, “переходящие” на трастузумаб в исследовании НЕRA, не являются уникальными, т. к. в настоящее время достаточно много исследований, предполагающих такой переход. Проведение многофакторного анализа Кокса для определения показателей безрецидивной выживаемости в группе наблюдения позволяет определить, имеют ли пациенты, перешедшие на трастузумаб, другое течение заболевания в отличие от тех, кто остался в группе наблюдения. Анализ показывает значительную разницу – с 31 %-ным снижением риска рецидивов в когорте, получавшей трастузумаб начиная с 23 месяцев от первичной рандомизации.
Как сообщалось ранее [12, 13], общая встречаемость кардиологических осложнений в исследовании HERA остается низкой (4,5 %) при увеличении периода наблюдения. По сообщениям о кардиологической токсичности в других крупных исследованиях адъювантной терапии трастузумабом, она также незначительна и редка [18]. Факторы риска, ассоциированные с развитием трастузумаб-связанных кардиологических осложнений, включают возраст, индекс массы тела и базовую фракцию выброса левого желудочка [19]. Другие возможные факторы риска идентифицированы, включают артериальную гипертензию, сахарный диабет, курение и гипотиреоидизм. Кардиологические осложнения в группе “перехода” были менее частыми и имели меньшую степень выраженности, чем при изначальном приеме трастузумаба, но их проспективного сравнения не планировалось и данные находки не должны приниматься во внимание. Благоприятная кардиологическая безопасность в проекте HERA может быть связанной с более продолжительным периодом времени между окончанием приема антрациклинов и началом лечения трастузумабом.
Таким образом, адъювантное лечение трастузумабом связано со значительными и постоянными выгодами, являясь приемлемым методом лечения больных HER2-положительным операбельным РМЖ. В течение 4 лет наблюдения очевидным становится преимущество адъювантного лечения трастузумабом в отношении безрецидивной выживаемости; что касается общей выживаемости, то разница пока не столь значительна, но четко прослеживается тенденция к ее увеличению. Большая группа “перехода” на трастузумаб сглаживает потенциальные отличия, особенно с учетом отсутствия рандомизации в этой группе, что приводит к возможным ошибкам. Анализ показывает, что больные, получавшие трастузумаб отсрочено (при медиане около 2 лет после завершения химиотерапии), имеют более низкий риск рецидива заболевания. Эти данные согласуются с гипотезой о том, что риск рецидива при HER2-положительном операбельном РМЖ сохраняется с течением времени и что заболевшие могут получить дополнительные преимущества при длительной терапии трастузумабом. Эта гипотеза изучается в сравнении с 1- и 2-летним лечением трастузумабом в ходе продолжающегося клинического исследования HERA.
Ключевым объектом внимания основной массы исследований были больные с относительно высоким риском – с HER2-позитивным РМЖ и поражением лимфоузлов [20]. Информация о результатах лечения больных без поражения лимфоузлов довольно скудна, хотя результаты говорят о снижении риска, пропорциональном таковому при пораженных лимфоузлах. Рандомизированные исследования не содержат данных о лечении маленьких опухолей (менее 1 см) без поражения лимфоузлов. Тем не менее некоторая информация относительно таких опухолей получена в результате назначения трастузумаба сроком на год. В одном исследовании (FinHER) препарат назначался всего на 9 недель [21], тогда как в исследовании HERA изучалось назначение трастузумаба сроком до 2 лет.
Общеизвестно, что минимальные опухоли (менее 1 см) без поражения лимфоузлов имеют в основном благоприятный прогноз. Существует только одно рандомизированное проспективное исследование, разработанное для РМЖ Т1а, Т1b, которое показало, что применение тамоксифена при мелких ЭР-позитивных опухолях снижает риск рецидива [22]. Ретроспективный анализ случаев лечения опухолей размером 1 см и менее, выделенных из других исследований, куда включались больные с различными стадиями Т, показал, что адъювантная химиотерапия снижает риск рецидива в случае ЭР-негативной опухоли, в то время как тамоксифен обладает преимуществами у женщин с ЭР-положительным РМЖ [3]. Исследователи из M.D. Anderson Cancer Center Техасского университета проанализировали результаты лечения женщин с опухолями Т1а/T1b и подтвердили важность оценки патоморфологических маркеров даже при опухолях ≤ 1 см. Более высокий риск имеют опухоли с высокой степенью злокачественности, инвазией лимфатических и кровеносных сосудов и высоким пролиферативным индексом [20].
Проведена масса ретроспективных исследований по определению риска рецидива опухолей менее 1 см в зависимости от ЭР- и HER2-статуса. Их целью было охарактеризовать риск рецидива минимальных опухолей РМЖ с гиперэкспрессией HER2 и исходя из этого осуществить выбор адъювантной терапии между химиотерапией и трастузумабом. Наиболее ранние работы в этом направлении, строившиеся на данных канцер-регистра Финляндии [21] и Британской Колумбии [23], показали, что при стадии РМЖ T1abN0 гиперэкспрессия HER2 являлась фактором, определяющим риск рецидива. Наибольшую тревогу вызывает величина этого риска: от 15 до 30 % при опухолях размером от 1 до 10 мм. Этот риск был значительно выше, нежели у HER2-негативных опухолей такого же размера.
Curigliano и соавт. [24], Gonzales-Angulo и соавт. [25], основываясь на клиническом опыте Европейского Института онкологии в Милане и центра M.D. Anderson, соответственно, дополнили эти наблюдения. Каждый из этих центров обнаружил гораздо более высокие значения риска рецидива РМЖ при стадии T1abN0 в случае наличия гиперэкспрессии HER2 по сравнению с HER2-негативными опухолями независимо от статуса ЭР. Оценка величины риска свидетельствует в пользу того, что гиперэкспрессия HER2 повышает риск рецидива заболевания от двух до пяти раз, с 10 до 23 % при 5-летнем периоде наблюдения, несмотря на минимальный размер опухоли и различные схемы адъювантной терапии, получаемой пациентами. Со статистической точки зрения эти значения соответствуют промежуточному риску. Такие значения рисков определенно ниже, чем в других когортах с более крупной опухолью и/или поражением лимфоузлов, а также гиперэкспрессией HER2, но значительно выше, чем при минимальных HER2-негативных опухолях без поражения лимфоузлов, особенно в случае наличия рецепторов стероидных гормонов.
Пока не понятно, с чем связана относительная разница в данных, представленных в сообщениях Миланского института онкологии и центра M.D. Anderson в США. Лучшие результаты лечения по сравнению с другими когортами, полученные итальянскими исследователями, возможно, объясняются более частым применением адъювантной гормоно- и химиотерапии, хотя и без трастузумаба.
Еще нет прямых доказательств, свидетельствующих в пользу того, что применение трастузумаба позволит снизить частоту рецидивирования у пациентов с минимальными HER2-позитивными опухолями. Однако есть значительное число косвенных данных, подтверждающих это. На сегодняшний день ретроспективное изучение основных исследований адъювантной терапии трастузумабом не показало различий в снижении риска рецидива при опухолях с гиперэкспрессией HER2 в зависимости от статуса лимфоузлов или размера опухоли. В недавней публикации из института Кюри сообщается, что после начала применения трастузумаба в адъювантном режиме частота рецидивов у женщин с опухолями менее 1 см и гиперэкспрессией HER2 существенно снизилась [26]. Однако ценность этих данных ослабляется фактом одновременного назначения химиотерапии этим пациентам. Тем не менее авторам представляется очевидным, что минимальный РМЖ T1a,bN0M0 сопряжен со значимым риском и ожидаемая польза от применения химиотерапии и трастузумаба – достоверное снижение относительного риска рецидива – является поводом для серьезного размышления.
В адъювантных испытаниях трастузумаб применялся одновременно с химиотерапией либо последовательно после химиотерапии с продолжением лечения им до года. Не вполне ясно, какая из этих стратегий лучше, но непрямое сравнение величин риска показало, что наибольшее снижение риска отмечено при сочетанном применении трастузумаба и химиотерапии (см. таблицу).
Предварительные испытания North Central Cancer Treatment Group N9831 (USA) свидетельствуют в пользу предпочтительности сочетанной терапии, продемонстрировавшей лучший эффект по сравнению с одной химиотерапией [28]. В следующем цикле исследований адъювантной терапии HER2+-опухолей необходимо будет оценить эффект лечения трастузумабом с одновременно проводимой химиотерапией или вообще без нее. В проходящем в настоящее время исследовании ALTTO (Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization) пациенткам предоставляется возможность получать анти-HER2-терапию либо последовательно, либо одновременно с химиотерапией. Результаты этого исследования могут серьезно повлиять на существующие представления о том, что наиболее эффективным вариантом применения таргетной терапии против HER2 является назначение ее одновременно с химиотерапией.
В настоящее время ведутся исследования по профилированию генной экспрессии (Oncotype DX, Mammaprint), индивидуализированному анализу биомаркеров и определению особенностей организма больных. Это позволит выявить, какие случаи HER2-позитивного РМЖ представляют наибольшую угрозу в эпоху таргетной терапии, основанной на трастузумабе. Эти исследования также позволят клиницистам обновить варианты лечения, основываясь на стадии заболевания конкретной больной, биологических особенностях опухоли и ожидаемой эффективности как существующей, так и разрабатываемой в настоящее время анти-HER2-терапии. Использование этой информации для индивидуализации лечения, “подгонки” его в соответствии с молекулярно-генетическими особенностями подгрупп из ранее выделенных групп – следующий шаг в рациональной терапии РМЖ.


