Нарушения кишечного всасывания у детей, связанные с изменением функции слизистой оболочки тонкой кишки различного происхождения, приводят к существенным изменениям внутрикишечного метаболизма, обусловливающим, в частности, развитие основного симптома данного состояния – нарушение характера стула. Хотя и степень выраженности рассматриваемых расстройств, и некоторые особенности их развития зависят от этиологии заболевания, многие закономерности носят универсальный характер. В качестве примера тотальной мальабсорбции, при которой страдает всасывание всех пищевых компонентов, может рассматриваться целиакия – заболевание, сопровождающееся формированием атрофии ворсинок слизистой оболочки тонкой кишки в связи с непереносимостью злакового белка глютена. Актуальность рассмотрения целиакии в данном контексте связана не только с серьезным повреждением слизистой оболочки тонкой кишки, но и с высокой ее распространенностью в мире вообще и в нашей стране в частности. Еще не так давно целиакия считалась относительно редким заболеванием, однако данные последних десяти–пятнадцати лет опровергли это представление. Согласно результатам серьезных эпидемиологических исследований, распространенность целиакии в Европе составляет в среднем 1 : 100 (ранее считалось 1 : 1000), причем больше половины случаев приходится на атипичные формы заболевания, представляющие значительные диагностические трудности.
Повреждение слизистой оболочки тонкой кишки при целиакии приводит к существенному изменению метаболических процессов, протекающих в кишечнике. Эти нарушения являются патофизиологической основой характерных для целиакии изменений со стороны стула: разжижение, учащение, полифекалия. При этом между морфологическими изменениями слизистой оболочки тонкой кишки и клинической выраженностью синдрома нарушенного кишечного всасывания существует прямая зависимость. Так, по данным Сабельниковой Е.А., при целиакии существует отрицательная корреляционная связь между степенью тяжести синдрома нарушенного кишечного всасывания и высотой кишечных ворсинок (Rs = -0,61, p < 0,01), соотношением высота ворсинки/глубина крипты (Rs = -0,56, p < 0,01), количеством межэпителиальных лимфоцитов (Rs = +0,40, p < 0,01) и степенью лимфоплазмоцитарной инфильтрации (Rs = +0,40, p < 0,01). Выявлена также отчетливая зависимость между нарушением кишечного всасывания и степенью атрофии по Marsh [1].
Глобальным последствием мальабсорбции являются повышение осмотического давления в просвете кишечника, пассивное поступление в просвет кишки воды и электролитов, рефлекторное ускорение моторики, учащение и разжижение стула.
Повреждение слизистой оболочки тонкой кишки, уменьшение ее поверхности, значительное снижение активности ферментов энтероцитов являются основой нарушения расщепления и всасывания углеводов, в первую очередь моно- и дисахаридов. Так, по нашим данным, в активный период заболевания у всех детей выявляются снижение всасывания ксилозы и у 90 % – нарушения расщепления лактозы. Это приводит к повышению осмотического давления в просвете кишки, а также к значительному поступлению углеводов в толстую кишку, где они активно утилизируются сахаролитической кишечной микрофлорой. Следствием этого является увеличение численности микробной популяции толстой кишки и повышение ее метаболической активности, а результатом микробного метаболизма углеводов становится существенное повышение продукции газа (водорода) и короткоцепочечных жирных кислот (ЖК; уксусной, масляной, пропионовой, молочной), что приводит к снижению рН в просвете толстой кишки, ускорению моторики, усилению секреции воды и увеличению содержания газов. Клинически у детей эти процессы проявляются метеоризмом, учащением стула, его кашицеобразным характером, “пышностью” стула, у части больных детей – кислым его запахом. Другим последствием описанных процессов становится избыточный бактериальный рост в тонкой кишке, усугубляющий уже имеющиеся метаболические нарушения. Указанные выше процессы также лежат в основе патогенеза и развития клинических проявлений при мальабсорбции дисахаридов, в частности при широко распространенной в мире лактазной недостаточности.
Нарушения белкового обмена при целиакии связаны с нарушением функции пептидаз щеточной каймы и транспортных систем энтероцита, приводящих к мальабсорбции пептидов и аминокислот, однако возможна также их потеря в результате развития вторичной экссудативной энтеропатии, наблюдающейся, по нашим данным, почти у каждого второго ребенка в активный период заболевания.
Нарушение расщепления белков и всасывания аминокислот приводит к поступлению пептидов различной длины и свободных аминокислот в просвет толстой кишки, что способствует повышению активности протеолитической флоры. С одной стороны, это обеспечивает утилизацию белковых продуктов, но, с другой стороны, меняет состояние кишечного микробиоценоза с уменьшением доли нормальной сахаролитической флоры и появлением в просвете кишки нехарактерных и даже токсических метаболитов, в частности изомеров короткоцепочечных ЖК. Проявлением данного процесса являются также учащение стула и гнилостный его запах. Дальнейшее нарастание активности протеолитической флоры может привести к повышенной утилизации ею белков слизи и нарушению состояния слизистого барьера толстой кишки с повышением его проницаемости. Вместе с тем у таких детей нарастает потеря аминокислот. По данным Мухиной Ю.Г. и соавт., в активный период целиакии экскреция с калом гистидина составляет 1000–3100 ммоль/сут, серина – 850–8625, аланина – 850–2100, триптофана – около 500, глицина – 400–600 ммоль/сут при том, что в норме экскреция указанных аминокислот крайне незначительна [2].
Чаще всего у детей при заболеваниях с поражением поджелудочной железы (ПЖ) нарушения внутрикишечного метаболизма белков обусловлены панкреатической недостаточностью, что наблюдается при муковисцидозе и некоторых более редких состояниях, таких как врожденная изолированная недостаточность трипсина или врожденная недостаточность энтерокиназы. При целиакии ПЖ также страдает, однако эти нарушения носят вторичный характер и на первый план с клинической точки зрения не выходят.
При целиакии в значительной степени нарушается всасывание липидов, в первую очередь ЖК и холестерина, что оказывает существенное влияние как на внутри-, так и на внекишечные метаболические процессы. Отражением этих нарушений является повышение экскреции с калом свободных ЖК, холестерина и его метаболитов, фосфолипидов и др., что было показано многими авторами, в т. ч. и в исследованиях, проведенных на нашей кафедре (табл. 1). На экскрецию триглицеридов первостепенное влияние оказывает состояние экзокринной функции ПЖ, которая при целиакии может нарушаться вторично. В то же время изменение соотношения свободных ЖК к триглицеридам в стуле больных целиакией однозначно указывает на преобладание мальабсорбции ЖК над нарушением расщепления триглицеридов (7,80 ± 2,34 при норме 1,67 ± 0,20; собственные данные).
Таблица 1. Липиды кала у больных целиакией (ммоль/кг) (по данным Урсовой Н.И. [3]).
По нашим данным, при целиакии у детей в активном периоде заболевания поражение ПЖ наблюдается у 88 % больных, в периоде ремиссии – у 79 %. Повышение в крови активности трипсина, говорящее о деструктивном процессе в ПЖ – скорее всего обострении хронического панкреатита, наблюдается у 37 % детей в активном периоде целиакии и у 12 % больных в периоде ремиссии. Что касается повышенной экскреции триглицеридов с калом, указывающей на экзокринную недостаточность ПЖ, нами была выявлена обратная картина: низкая частота в активный период (18 %) и более высокая – в периоде ремиссии (52 %). Данная закономерность совпала с таковой при оценке частоты выявления признаков хронического панкреатита по данным ультразвукового исследования. Повышенная эхогенность и неоднородность ткани ПЖ не выявлялись в активном периоде целиакии, но встречались у 58 % больных детей с целиакией в периоде ремиссии. У них можно предположить постепенное формирование хронического панкреатита по мере течения процесса даже на фоне стойкой ремиссии целиакии с развитием экзокринной панкреатической недостаточности.
При целиакии в раннем детском возрасте нарушение экзокринной функции ПЖ является следствием нарушения гуморальной регуляции ее функции со стороны тонкой кишки (снижение продукции секретина и холецистокинина), обусловленным гиперрегенераторной атрофией слизистой оболочки и как следствие – гиперпродукцией кишечного соматостатина. Кроме того, нарушения трофики ПЖ в условиях белковоэнергетической недостаточности и снижения микроциркуляции могут приводить к повреждению ее ткани и формированию хронического панкреатита, в большей степени проявляющего себя уже в период ремиссии. Нельзя также исключит и аутоиммунный механизм повреждения ПЖ.
При муковисцидозе, т. е. при первичном повреждении ПЖ, при врожденной изолированной недостаточности липазы или при тяжелом хроническом панкреатите нарушения расщепления триглицеридов выходят на первый план как в патогенетическом, так и в клиническом плане, обусловливая жирный вязкий обильный стул.
Значительный эффект на переваривание триглицеридов и всасывание ЖК оказывает замедление моторики желчевыводящих путей при целиакии, обусловленное снижением продукции в тонкой кишке холецистокинина и повышением – соматостатина.
По результатам гепатобилиарной сцинтиграфии, поступление радиофармпрепарата (РФП) в гепатоцит замедлено у всех детей в активном периоде целиакии, а выход в желчь – у 87,5 %. В период ремиссии сниженное поступление РФП в гепатоцит сохранялось (через год – у 67 % детей, через 3 года – у 90 %!), так же как и сниженный выход РФП из гепатоцита (через год – у 58,3 % детей; через 3 года – у 30,0 %). Таким образом, имеет место как внутри так и внепеченочный холестаз, а функция гепатоцита остается нарушенной даже в ремиссии заболевания (собственные данные: Калинцева В.А., Бубнова Л.В., Бельмер С.В. и др.)
Нарушение всасывания ЖК у детей в тонкой кишке связано с несколькими факторами:
- нарушение функции энтероцита;
- нарушение образования мицелл вследствие дефицита желчных кислот;
- нарушение транспорта жирных кислот в лимфу при развитии вторичной экссудативной энтеропатии.
Невсосавшиеся в тонкой кишке ЖК образуют мыла – соли с моно- и дивалентными катионами. Образование кальциевых мыл приводит к нарушению всасывания кальция, а также уменьшению связывания кальцием оксалатов. Последние, образуя растворимые соединения, имеют возможность для более интенсивного всасывания и поступления в кровоток как в тонкой, так и в толстой кишке, что может проявиться развитием оксалурии. Нарушение всасывания жиров нарушает и всасывание жирорастворимых витаминов.
Поступая в толстую кишку, ЖК тормозят всасывание воды и электролитов, а также стимулируют секрецию воды в просвет кишки, способствующую нарастанию диареи. Кроме того, ЖК обладают определенным бактерицидным действием и нарушают состояние кишечного микробиоценоза.
Микроорганизмы толстой кишки в некоторой степени способны расщеплять триглицериды, восстанавливать некоторые ненасыщенные ЖК, гидроксилировать ЖК. Они также способны расщеплять фосфолипиды, причем эта возможность усиливается в присутствии желчных кислот. Эти метаболические особенности кишечной микрофлоры могут влиять на спектр липидов в стуле.
По данным Мухиной Ю.Г. и соавт., в активный период целиакии у детей наблюдается резкое повышение экскреции фосфолипидов с калом (260 ± 42 мг/сут при норме 95 ± 5,12 мг/сут). Также повышается экскреция 2-аминоэтилфосфоната фосфонового соединения, аналога фосфоэтаноламина, а также конъюгатов этаноламина с ЖК (41,6 ± 10 и 10,870 ± 980 мкмоль/ сут при норме 18,6 ± 6,2 и 2320 ± 368 мкмоль/сут). Представленные находки указывают как на нарушение синтеза фосфолипидов в печени, т. к. они в норме полностью ею утилизируются, так и на изменение метаболических процессов в кишечнике [2].
Мальабсорбция холестерина нарушает его энтерогепатическую циркуляцию, снижая общее содержание в организме. Следует отметить, что нарушение всасывания холестерина при целиакии в большей степени опосредовано нарушением состояния эпителия, но не дефицитом желчных кислот [4]. Поступление холестерина в двенадцатиперстную кишку с желчью увеличивается почти в два раза, однако эта компенсаторная реакция сводится на нет значительной его потерей с калом [5]. Меняется и характер метаболизма холестерина в толстой кишке. Показано, что при целиакии фекальная экскреция холестерина повышается за счет нейтральных стероидов [6].
В норме в толстой кишке при участии кишечной микрофлоры из холестерина путем восстановления двойной связи между атомами С5 и С6 образуется копростерол (синонимы: копростанол, копростерин), который в кишечнике не всасывается. В дальнейшем из копростерола путем окисления может образовываться копростанон, который также не всасывается и выводится с калом. По нашим данным, в норме соотношение в кале детей холестерина (холестанона), копростерола и копростанона составляет 1 : 1 : 1. При целиакии увеличение поступления холестерина в толстую кишку активизирует метаболическую активность кишечной микрофлоры, в результате чего количество двух последних метаболитов значительно увеличивается, что приводит к изменению соотношения между ними.
В условиях нарушения кишечного всасывания у детей нарушается энтерогепатическая циркуляция желчных кислот, что приводит к быстрому сокращению их общего пула в организме и к дальнейшему нарушению всасывания ЖК вследствие нарушения образования мицелл. Более того, этот процесс усугубляется в результате деконъюгации желчных кислот в условиях избыточного бактериального роста в тонкой кишке.
Конъюгированные желчные кислоты, попав в толстую кишку, тормозят всасывание воды и электролитов, а также стимулируют секрецию воды в просвет кишки, способствующую диарее [7]. Микрофлора толстой кишки обеспечивает синтез вторичных желчных кислот, обладающих выраженными детергентными свойствами, способных повреждать эпителий и повышать проницаемость кишечного барьера [8]. В то же время, по мнению многих исследователей, фекальная экскреция желчных кислот при целиакии у детей существенно не меняется, что позволяет считать их прямое влияние на протекающие в толстой кишки процессы минимальным [6].
Таким образом, характер нарушений процессов внутрикишечного метаболизма при синдроме мальабсорбции многообразны и зависят от характера основного патологического процесса. В то же время во многих случаях нарушается экзокринная функция ПЖ. В одних это нарушение носит абсолютный первичный врожденный или приобретенный характер, как, например, при муковисцидозе и хроническом панкреатите соответственно, в других – вторичный, как, например, результат нарушения регуляции функции органа при целиакии, в третьих – относительный, когда условия среды, в которой должны действовать ферменты, не являются оптимальными, или нагрузка, предъявляемая к органу, не соответствует его возможностям. Относительная панкреатическая недостаточность у детей – распространенная ситуация, наблюдающаяся не только при нарушении кишечного всасывания, но и при функциональных нарушениях моторики органов пищеварения или при повышении желудочной секреции.
Во всех перечисленных случаях важным аспектом коррекции нарушенных процессов переваривания и всасывания у детей является применение препаратов панкреатических ферментов. В ряде исследований показано, что у взрослого здорового человек в течение 6 часов после еды выделяется около 140 тыс. ЕД панкреатической липазы, причем клинические признаки экзокринной панкреатической недостаточности развиваются при снижении функции органа на 95 % от исходной [9]. Несложный расчет показывает, что в этом случае требуется назначение примерно 40 тыс. ЕД липазы на каждый прием еды в составе препаратов, способном донести фермент до субстрата.
В связи с этим современный препарат данной группы должен отвечать ряду строгих требований. Препарат должен производиться из высококачественного сырья – панкреатина, который должен быть помещен в микрогранулы размером не более 2 мм, способные поступать в двенадцатиперстную кишку одновременно с пищей. При размере частиц более 2 мм наблюдается асинхронное поступление пищи и панкреатина, что затрудняет абсорбцию жира, а клинически не удается достичь полной редукции стеатореи даже при использовании больших доз липазы. Кроме этого микрогранулы должны быть покрытыми энтеросолюбильной оболочкой, предотвращающей высвобождение фермента в кислой желудочной среде, а сами микрогранулы должны помещаться в желатиновую капсулу, растворяющуюся в желудке.
В настоящее время в арсенале отечественных врачей появился новый микротаблетированный препарат – Эрмиталь, сразу привлекший к себе внимание высокой эффективностью в составе заместительной терапии, показанной в ряде исследований как у взрослых пациентов, так и у детей [10]. Препарат Эрмиталь (Германия) выпускается в трех дозировках, различающихся по активности, представленных в табл. 2.
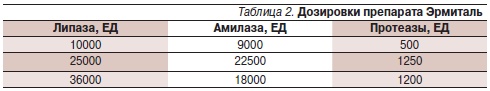
Первый опыт применения препарата Эрмиталь 10 тыс. ЕД на базе РДКБ (Москва) показал его хорошую эффективность и переносимость у детей в возрасте от 3 до 9 лет с функциональными расстройствами органов пищеварения (9 детей), а также при целиакии (3 ребенка) и пищевой аллергии (4 ребенка). При применении препарата в составе комплексной терапии во всех случаях наблюдались купирование проявлений вторичной экзокринной панкреатической недостаточности, снижение активности основного патологического процесса, восстановление функции желудочно-кишечного тракта и прибавка в массе.
Диагноз экзокринной панкреатической недостаточности ставился на основании клинических данных (изменение стула) и лабораторных признаков (стеаторея 1-го типа, снижение активности эластазы-1 в стуле ниже 200 ЕД). Доза препарата подбиралась эмпирически, с упором на клинические (характер стула) и лабораторные (количество нейтрального жира в копрограмме) данные. Хотя существуют формулы расчета стартовой дозы панкреатических ферментов исходя из массы больного, все они носят весьма приблизительный характер, т. к. дефицит панкреатических ферментов связан не только с массой тела, но и с особенностями функционального состояния органа, а также всей пищеварительной системы, характером питания и многими другими причинами. Пример такого расчета для больных с тяжелой экзокринной панкреатической недостаточностью (в частности, при муковисцидозе) предусматривает для детей грудного возраста назначение от 2500 до 5000 ЕД липазы на 100–150 мл молока, а детям старше одного года – 2000–6000 ЕД/кг/сут или 500–1000 ЕД/кг на основной прием пищи и 250–500 ЕД /кг – на дополнительный [11, 12].
В целом у детей старше 2 лет стартовой дозой может быть 10 тыс. ЕД липазы (что имело место в нашем случае) с последующим индивидуальным ее подбором. Важно, что капсулы препарата Эрмиталь можно раскрывать и подсчитывать дозу по числу микротаблеток, что особенно важно для детей первых лет жизни (начиная от четверти капсулы). Препараты панкреатина показаны в первую очередь при абсолютной недостаточности ПЖ, при которой им придается ключевая роль в тактике лечения больного ребенка. При относительной панкреатической недостаточности первым шагом на пути коррекции нарушенной функции ферментов ПЖ является восстановление оптимальных условий для их действия, но и в этом случае показаны, хотя и в меньших дозах, высокоактивные препараты панкреатических ферментов.
Препарат Эрмиталь показал себя высокоэффективным во всех перечисленных случаях. Приведенный положительный опыт применения дает нам основание говорить о применении Эрмиталя в педиатрической практике как препарата выбора для коррекции всех вариантов панкреатической недостаточности. В дальнейшем необходимы сравнительные контролируемые исследования эффективности этого препарата в соответствии с принципами современной доказательной медицины.
Таким образом, при нарушениях процессов кишечного переваривания и всасывания развиваются серьезные нарушения внутрикишечного метаболизма, вызывающие вторичные расстройства пищеварительных функций и усугубляющие течение основного патологического процесса. Лечение причины мальабсорбции в сочетании с заместительной терапией панкреатическими ферментными препаратами является основным направлением в коррекции представленных выше состояний.
Информация об авторах:
Гасилина Татьяна Владимировна – кандидат медицинских наук, старший научный
сотрудник кафедры детских болезней № 2 РГМУ, ДРКБ.
Тел. 8 (495) 936-94-74;
Карпина Лариса Михайловна – заведующая отделением гастроэнтерологии ДРКБ, РГМУ.
Тел. 8 (495) 936-91-38;
Бельмер Сергей Викторович – доктор медицинских наук, профессор РАМТН,
кафедра детских болезней № 2 РГМУ, ДРКБ


