Введение
Остеоартроз (ОА) – заболевание, развивающееся в результате взаимодействия различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса, прежде всего в суставном хряще [1]. В настоящее время ОА рассматривают как органную патологию, т. к. в процесс вовлекаются все ткани сустава: субхондральная кость, синовиальная мембрана, капсула, связки и периартикулярные мышцы. ОА – наиболее частая форма поражения суставов. Распространенность заболевания в популяции коррелирует с возрастом, достигая максимальных значений у людей старше 65 лет. Женщины болеют ОА почти в 2 раза чаще мужчин. Наиболее часто поражаются нагрузочные суставы (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые, первый пястно-запястный сустав) и суставы позвоночника. Развитие заболевания приводит к ухудшению качества жизни пациентов, ограничивает их физические возможности, а зачастую и социальные функции, становясь причиной инвалидности. Так, ОА коленных суставов выходит на 4-е место среди причин нетрудоспособности у женщин и на 8-е – у мужчин [2–4].
В настоящее время все большее внимание уделяется проблеме ОА суставов кистей. Распространенность этой разновидности ОА в европейских популяциях увеличивается от 10 % в возрасте 40–49 лет до 92 % — в возрасте старше 70 лет. Несмотря на большую социальную значимость болезни, патогенез ОА изучен недостаточно. По современным представлениям ОА – многофакторное заболевание с большим числом признанных факторов риска, в качестве которых рассматриваются возраст, пол, наследственная предрасположенность, избыточный вес и др. Основными клиническими признаками ОА являются боль и нарушение функциональной способности суставов. Рентгенологически ОА характеризуется сужением суставной щели, остеофитозом, субхондральным склерозом и образованием кист.
Установлено, что в основе патогенеза ОА лежат деградация хрящевой ткани, воспаление синовиальной оболочки и перестройка субхондральнойкости. Процесс хрящевой деградации не характеризуется строго прогрессирующим течением: время от времени предпринимаются попытки восстановления утраченного хряща, что предполагает способность хондроцитов к синтезу даже на конечном этапе заболевания [5–7].
Предполагается, что одним из патогенетических механизмов ОА является нарушение равновесия между деградацией матрикса и его синтезом хондроцитами. При деградации хряща происходит избыточная выработка металлопротеиназ, включая коллагеназы (ММР-1, 8, 13) [8–10], аггреканазы (ADAM-TS4 и TS5) [11], стромелизин-1 (ММР-3) [12, 13] и желатиназы (ММР-2, 9) [14, 15], хондроцитами. Продукция металлопротеиназ повышается интерлейкином 1β (ИЛ-1β), представляющим собой цитокин, обнаруживаемый в повышенных количествах в пораженной ОА хрящевой ткани [16–18]. ИЛ-1β вносит существенный вклад в деградацию хряща, тормозя синтез компонентов матрикса (аггрекан и коллаген II типа) [19, 20]. Он стимулирует также синтез цитокинов ИЛ-6, ИЛ-8, макрофагового воспалительного протеина, усиливающих воспалительный процесс [21–23].
В настоящее время терапия ОА направлена на облегчение боли и ослабление функциональных нарушений. Медикаменты, используемые в терапии ОА, делятся на две основные группы: симптом-модифицирующие препараты (анальгетики и нестероидные противовоспалительные средства – НПВС), которые снимают боль и воспаление в суставах, и структурно-модифицирующие препараты, способные модифицировать структуру хряща. Эта группа препаратов не только замедляет прогрессирование заболевания, но и активно влияет на основные симптомы ОА – воспаление и боль, т. е. обладает и симптом-модифицирующим эффектом [4]. Эту группу препаратов называют также SYSADOA (symptomatic slow acting drugs for osteoarthritis), и одним из ее представителей является Пиаскледин (ПС), обладающий доказанной клинической эффективностью и потенциальными хондропротективными свойствами.
ПС представляет собой неомыляемые соединения авокадо и соевых бобов (НСАС), получаемые в результате гидролиза, в пропорции 1 : 2 (Пиаскледин, A1S2, Laboratoires Pharmascience, Courbevoie, France). Было показано, что сочетанное применение экстрактов авокадо и сои вызывает более выраженную ингибицию цитокинов по сравнению с их изолированным применением, а степень ингибиции зависит от соотношения этих ингредиентов [30]. Инкубация препаратов с различным соотношением указанных компонентов – 1 : 2 (A1S2), 2 : 1 (A2S1) и 2 : 2 (A2S2) с культурой человеческих хондроцитов в течение 72 часов в отсутствие или присутствии ИЛ-1β показала, что НСАС в пропорциях 1 : 2 и 2 : 2 вызывали значительное снижение активности стромелизина в культуре клеток (р < 0,5) с падением экспрессии ИЛ-6 и ИЛ-8. Достоверное снижение коллагеназной активности отмечено только при применении этих НСАС (в концентрации 10 мкг/мл), тогда как снижение уровня простагландина Е2, стимулируемого ИЛ-1β, было одинаковым при применении всех смесей. Установлено, что смесь, содержащая две части экстракта соевых бобов и одну часть авокадо (А1S2), представляет собой наиболее эффективное вещество, которое и стало использоваться в качестве лекарственного средства.
Основным механизмом действия ПС является влияние на экспрессию цитокинов. Он ингибирует ИЛ-1, стимулирует синтез коллагена в культуре хондроцитов и продукцию протеогликанов, блокирует ИЛ-1, подавляя его коллагенолитический эффект на хондроциты и синовиоциты [29, 30]. При воздействии на человеческие хондроциты ПС ингибирует синтез коллагеназы, стромелизина, ИЛ-6 и ИЛ-8, а также простагландина Е2, т. е. тех биологических субстанций, которые активно участвуют в развитии воспалительной реакции и как следствие – последующем повреждении хряща при ОА. Кроме того, ПС повышает экспрессию трансформирующих факторов роста β1 и β2, а также ингибитора активатора плазминогена-1 (ИАП-1). Трансформирующие факторы роста синтезируются хондроцитами и остеобластами и регулируют синтез макромолекул межклеточного вещества суставного хряща. Они обладают анаболическим эффектом, являсь не только мощными стимуляторами синтеза макромолекул гиалинового хряща, но и блокаторами их деградации. Действие ИАП-1 направлено на подавление продукции активатора плазминогена, который принимает участие в повреждении хряща как вследствие прямого воздействия (путем деградации протеогликанов), так и опосредованно – через стимуляцию металлопротеиназ [32].
Многочисленные исследования in vivo подтвердили данные исследований in vitro, показавшие, что НСАС повышают уровень стимуляторов тканевой продукции и могут оказывать хондропротективный эффект при индуцированном ОА. В эксперименте на животных было продемонстрировано, что НСАС обладают превентивным действием на развитие посттравматического ОА у кроликов. Altinen и соавт. [34] выявили, что уровень трансформирующих факторов роста β1 и β2 в синовиальной жидкости коленных суставов собак достоверно повышался в группах, получавших высокие и низкие дозы НСАС, по сравнению с контролем. В другом исследовании in vivo, проведенном на собаках с индуцированным ОА коленного сустава, первая группа собак получала в течение 8 недель НСАС в дозе 10 мг/кг, вторая – плацебо. У собак, получавших НСАС, отмечено достоверное ослабление макроскопических повреждений хряща на поверхности большеберцовой кости. Гистологическое исследование тоже подтвердило, что тяжесть повреждения хрящевой ткани у собак, получавших НСАС, была достоверно ниже [35].
Изучение эффективности и безопасности ПС проводилось в ряде рандомизированных клинических исследований (РКИ).
Симптом-модифицирующий эффект ПС был доказан в двойном слепом плацебо-контролируемом РКИ [24], включившем 164 пациента с ОА коленных и тазобедренных суставов. В течение 3 месяцев больные с умеренными или сильными болями получали ПС по 300 мг/сут или плацебо. Основным критерием оценки эффективности препарата являлась потребность в НПВС: в интервале между 60-м и 90-м днями терапии она была достоверно меньше в группе ПС (43,4 против 69,7 % в группе плацебо; р<0,001). Кроме этого кумулятивная доза НПВС, используемая пациентами в интервале между 45-м и 90-м днями лечения, была достоверно ниже в группе ПС (р < 0,01).
Через год Maheu и соавт. [25] опубликовали результаты другого РКИ, длительность которого составила 8 месяцев (6 месяцев – терапия, 2 месяца – оценка последействия препарата). По всем основным показателям ПС превосходил плацебо. Так, средняя выраженность боли к концу лечения в основной группе снизилась с 56,1 ± 1,6 до 35,3 ± 2,3 мм по визуальной аналоговой шкале (ВАШ; р = 0,003), а в группе сравнения – с 56,1±1,8 до 45,7 ± 2,6 мм. Отмечено также достоверное улучшение функционального состояния суставов и уменьшение индекса Лекена (-2,1 ± 0,5; р < 0,001) по сравнению с группой плацебо. Потребность в НПВС в период лечения была ниже в основной группе, составив 48 против 63 % в группе плацебо (р = 0,054). Особого внимания заслуживает проведенная в этом исследовании оценка потребности в НПВС через 2 месяца после прекращения приема ПС и плацебо: она составила 40,5 и 56,4 % соответственно (р < 0,05). Данное исследование подтвердило клинически значимое превосходство ПС над плацебо в течение всего периода терапии. Авторы сделали вывод, что НСАС представляет собой медленнодействующее симптоматическое лекарственное средство со стойким эффектом и высокой степенью безопасности, а сохранение симптоматического эффекта после прекращения приема ПС свидетельствует о наличии у препарата выраженного последействия.
В 3-месячном многоцентровом РКИ, проведенным Аppelboom и соавт. [26], оценивались эффективность и безопасность разных доз ПС (300 и 600 мг/ сут) у 260 пациентов с гонартрозом. Результаты исследования показали, что эффективность ПС в дозах 300 и 600 мг/сут была значительно выше плацебо во всех контрольных точках, разницы между двумя дозировками обнаружено не было. Кроме того, 71 % больных, принимавших ПС, смогли уменьшить дозу НПВС больше чем в 2 раза, тогда как в группе плацебо такой эффект был достигнут только у 36 % пациентов.
Структурно-модифицирующий эффект НСАС продемонстрирован в работе Lequesne и соавт. [27]. В этом двухлетнем РКИ проводилась оценка влияния ПС на прогрессирование сужения суставной щели у 163 больных с клинически и рентгенологически выраженным коксартрозом. В конце исследования сходное сужение суставной щели определялось в обеих группах. Однако при анализе подгрупп оказалось, что сужение суставной щели у наиболее тяжелых больных с коксартрозом (исходная ширина ≤ 2,45 мм) через 2 года лечения было достоверно меньшим в основной группе по сравнению с плацебо (-0,43 мм и -0,86 мм соответственно; р < 0,01), что позволило авторам высказать мнение о наличии у ПС хондропротективного действия.
В 2009 г. Maheu и соавт. [38] представили результаты исследования структурно-модифицирующего действия ПС у 345 больных коксартрозом (ERADIAS). Пациенты были стратифицированы по тяжести коксартроза (ширина суставной щели < 2,5 мм или > 2,5 мм) и рандомизированы в 2 группы, одна из которых получала 300 мг ПС (166 больных), а другая – плацебо (179 больных) в течение 3 лет. И хотя различие в сужении суставной щели за 3 года между группами ПС и плацебо оказалось статистически недостоверным (-0,64 и -0,67 мм соответственно; р = 0,72), больных с прогрессированием ОА в группе ПС было на 20 % меньше, чем в группе плацебо (р = 0,039), что свидетельствует о наличии у препарата структурно-модифицирующих свойств.
В большом сравнительном исследовании, в которое были включены 364 больных ОА коленных суставов, проведенном Pavelka и соавт. [31], изучались эффективность и безопасность ПС (300 мг/сут) в сравнении с хондроитин сульфатом (400 мг 3раза в день) в течение 6 месяцев лечения. Препараты показали сходные результаты. В середине и в конце исследования у больных обеих групп функциональные индексы WOMAC и Лекена уменьшились приблизительно на 50 %, а в течение последующих 2 месяцев наблюдения эти показатели продолжали снижаться, демонстрируя наличие эффекта последействия. Почти 80 % пациентов в сравниваемых группах оценили эффективность терапии как “значительное улучшение” и “улучшение”, и практически все больные смогли снизить суточную дозу НПВС. Переносимость ПС, как и хондроитин сульфата, была хорошей. Следует отметить, что однократный прием ПС наиболее удобен для больных и может значительно повысить комплаентность терапии.
Мета-анализ 4 контролируемых клинических исследований НСАС включил 664 пациента с ОА тазобедренных (41,4 %) и коленных суставов (58,6 %), из которых 336 больных получали ПС по 300 мг/сут и 328 –плацебо в течение 6 месяцев [37]. ПС превосходил плацебо по влиянию на боль (среднее уменьшение боли по ВАШ составило 10,7 % при гонартрозе и 11,3 % при коксартрозе; р = 0,04) и функциональный индекс Лекена (р = 0,0003).
Вместе с тем в относительно недавнем систематическом обзоре указывается на необходимость дальнейшего изучения ПС, поскольку 3 из 4 РКИ рекомендуют ПС для применения как симптом-модифицирующий препарат, но одно исследование не подтвердило его эффективность при длительном (в течение года) использовании [36]. Однако в этой работе первичной конечной точкой была оценка структурно-модифицирующего действия, что может отчасти объяснить отсутствие симптом-модифицирующего эффекта ПС при длительном его применении. Действительно хорошо известна слабая корреляция между симптомами и структурными изменениями при ОА, и у большинства больных с достигнутым структурно-модифицирующим действием симптом-модифицирующий эффект отсутствует. Этот феномен описан и при длительном применениидругих т. н. хондропротективных препаратов.
Высокая безопасность ПC отмечена во всех клинических исследованиях, в которых не было зарегистрировано каких-либо значимых побочных эффектов или случаев передозировки препарата при длительном его приеме. Немаловажным аспектом безопасности является отсутствие значимых лекарственных взаимодействий ПС с известными лекарственными средствами, особенно это важно для пожилых больных ОА, принимающих довольно широкий набор препаратов для лечения сопутствующих заболеваний.
В России эффективность и безопасность ПС изучались в открытом многоцентровом 6-месячном исследовании, включившем 92 больных ОА коленных и тазобедренных суставов. Первая группа пациентов (46 человек) получала ПС по 300 мг/сут и НПВС, вторая (также 46 человек) – только НПВС. Эффект проводимой терапии оценивался по интенсивности боли в пораженном суставе при нагрузке и в покое, утренней скованности, функциональному индексу Лекена, а также суточной потребности в НПВС. Уже к 3-му месяцу лечения наблюдалось статистически значимое уменьшение боли у больных основной группы. К концу курса терапии интенсивность боли в покое в основной группе уменьшилась в 3,5 раза, а в контрольной – только в 1,9 раза. Интенсивность боли при движении в 1-й группе снизилась с 63,7 до 23,4 мм по ВАШ, а во 2-й – с 57,3 до 35,8 мм. Индекс Лекена у больных, получавших ПС, к 3-му месяцу наблюдения снизился более чем в 2 раза по сравнению с исходным уровнем, а к концу 6-го месяца – почти в 3 раза. Менее отчетливую положительную динамику наблюдали в контрольной группе, где она оказалась статистически недостоверной. Снижение выраженности основных симптомов ОА позволило постепенно снизить дозу НПВС у больных, которые лечились ПС: через 3 месяца суточная потребность в НПВС уменьшилась более чем в 2 раза, а к концу терапии – в 3 раза [32].
Эти данные подтверждены многочисленными исследованиями, проведенными в регионах России, где была показана высокая эффективность и хорошая переносимость ПС у больных ОА коленных и тазобедренных суставов. К настоящему времени имеются доказательства эффективности ПС в терапии ОА крупных суставов, однако нет данных по влиянию его на ОА суставов кистей, чему и было посвящено наше исследование.
Цель исследования состояла в оценке эффективности и безопасности ПС в сравнении с терапией ибупрофеном (ИП) у пациентов с ОА суставов кистей.
Материал и методы
В исследование были включены 40 амбулаторных пациентов обоего пола (37 женщин и 3 мужчины; средний возраст – 65,3 ± 6,9 года) с ОА суставов кистей, удовлетворяющих критериям Althman и соавт., (1995), с болью в суставах кистей более 40 мм по ВАШ, регулярно принимавших НПВС в течение не менее 30 дней за последние 3 месяца, подписавших информированное согласие на участие в исследовании. Двадцать больных (основная группа) принимали ПС по 300 мг/сут и ИП по 1200 мг/сут, остальные 20 пациентов (группа сравнения) – ИП по 1200 мг/сут. Длительность наблюдения составила 4 месяца. Далее части больных терапия Пиаскледином была продолжена в течении еще 8 месяцев для оценки эффективности и безопасности, а также влияния препарата на рентгенологические изменения при ОА суставов кистей. ИП назначался после периода отмывки в дозе 400 мг 3 раза в сутки с возможностью последующего снижения дозы.
Обе группы больных до начала терапии были сопоставимыми по возрасту, давности болезни и индексу массы тела (ИМТ; табл. 1). Из 40 пациентов, включенных в исследование, полный курс лечения завершили 29 больных (72,5 %). Четырнадцать пациентов продолжили исследование в течении 12 месяцев, из них 13 больным было проведено повторное рентгенологическое исследование. Одна больная выбыла из основной группы на визите 2 (через месяц лечения) в связи с нарушением протокола. Остальные 10 выбыли из группы сравнения: 3 пациента – через месяц от начала лечения, из них 2 – в связи с появлением гастралгий и 1 – из-за головокружения; 5 пациентов выбыли через 2 месяца терапии, из них 3 – в связи с появлением гастралгий и 2 – из-за отсутствия эффекта. Еще 2 больных выбыли через 3 месяца в связи с появлением болей в эпигастрии.
Таблица 1. Сравнительная характеристика больных до начала лечения.
Больных имели следующие сопутствующие заболевания: артериальную гипертензию – 12 (60 %) человек 1-й группы и 9 (45 %) – 2-й, ишемическую болезнь сердца – 5 (25 %) и 4 (20 %) пациента, хронический гастрит – 3 (15 %) и 4 (20 %), варикозное расширение вен – 1 (5 %) и 2 (10 %), заболевания щитовидной железы (узловой зоб) – 2 (10 %) и 3 (15 %). Частота сопутствующей патологии была примерно одинаковой в обеих группах больных.
Оценка эффективности лечения проводилась по следующим критериям:
- Функциональный индекс AUSCAN (боль, скованность, состояние функции суставов).
- Модифицированный функциональный индекс Дрейзера (FIHOA).
- Оценка эффекта от проводимой терапии врачом (лучше, хуже, без изменений).
- Оценка эффекта от проводимой терапии пациентом (лучше, хуже, без изменений).
- Суточная потребность в пероральных НПВП и/или анальгетиках.
Эти параметры анализировались до начала лечения (визит 1) и каждый месяц в последующем. Нежелательные явления (НЯ) и оценка эффективности от проводимой терапии регистрировались на каждом визите.
Статистический анализ проведен с использованием общепринятых статистических методик.
Результаты и обсуждение
Оценка боли, скованности и состояния функции суставов проводилась с помощью индекса AUSCAN. Достоверные показатели уменьшения боли были зарегистрированы у всех больных через 2 месяца терапии и сохранялись до конца лечебного периода (табл. 2). В конце терапии через год 100 % больных оценили изменение своего состояния как улучшение. Показатели боли на фоне приема ПС + ИП были гораздо ниже, чем при приеме одного ИП (97,6 ± 63,9 против 131,5 ± 89,4 мм соответственно), но статистически значимых различий выявлено не было, возможно из-за малочисленности групп. Достоверное уменьшение показателей боли сохранялось у всех больных через 12 месяцев терапии. При оценке скованности достоверные различия с исходным показателем отмечены на всех визитах только в основной группе. Поскольку боль часто сочетается с утренней скованностью и является признаком вторичного синовита, данные результаты подтверждают, что ПС обладает хорошей противовоспалительной активностью. Анализсостояния функции суставов показал достоверное улучшение показателей в 1-й группе уже через 2 месяца терапии, в то время как во 2-й группе улучшение отмечено только на 3-м месяце лечения. В конце наблюдения достоверно лучшие результаты по функциональному состоянию суставов отмечены в основной группе (235,5 ± 116,8 против 318,3 ± 131,0 мм в группе сравнения; р < 0,05), что свидетельствует о большей эффективности комбинации ПС + ИП. Суммарный индекс AUSCAN достоверно снижался через 2 месяца терапии в 1-й группе и только через 3 месяца в группе сравнения. При оценке функционального состояния суставов (индекс Дрейзера) достоверные изменения отмечены у всех больных через 2 месяца терапии и сохранялись до конца терапии. Динамика функционального индекса AUSKAN через год применения Пиаскледина у части больных представление на рис. 1.
Таблица 2. Динамика показателей функциональных индексов у больных с ОА суставов кистей на фоне приема ПС + ИП и ИП.

Из 14 больных, леченных в течении 12 месяцев, повторное рентгенологическое исследование сделано у 13 больных, которое показало отсутствие динамики на рентгенограммах. Из 6 больных, леченных только 4 месяца, у 2-ах пациентов выявлена небольшая отрицательная рентгенологическая динамика: у одной больной – увеличение размеров остеофитов во 2–3-м дистальных межфаланговых суставов и нарастание кистовидных просветлений; еще у одной больной отмечено увеличение размеров остеофитов в костях запястья.
Нежелательные явления наблюдались у 13 больных: у 3 – из основной группы и у 10 – из группы сравнения (табл. 3).

В основной группе гастралгии исчезли после снижения дозы ИП в 2 раза, и больные продолжили лечение. В группе сравнения у 7 больных, несмотря на уменьшение дозы ИП, боли в эпигастрии сохранялись, в связи с чем препарат был отменен и пациенты выбыли из исследования. Кроме того, у одной больной из группы, получавшей ИП, через 2 недели терапии появилось стойкое головокружение, что тоже потребовало отмены препарата.
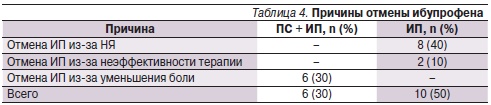
За время исследования ИП отменили 6 больным 1-й группы из-за уменьшения боли, в то время как в группе 2 препарат отменили 10 пациентам,в т. ч. 8 – из-за появления НЯ и 2 – из-за неэффективности терапии (табл. 4).
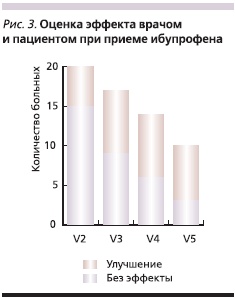
Оценки эффективности проведенного лечения пациентом и врачом представлены на рис. 2 и 3. Через месяц от начала терапии (визит 2) улучшение состояния отмечено у 50 % больных основной группы и только у 25 % – группы сравнения. Через 2 месяца (визит 3) улучшение зарегистрировано у 79 % больных 1-й группы и только у 47 % – 2-й, а отсутствие эффекта от проводимой терапии – у 21 и 53 % соответственно. В конце лечебного периода, т. е. через 4 месяца терапии, улучшение отмечено у всех больных, получавших ПС + ИП, по сравнению с 65 % в группе, принимавшей один ИП.

Таким образом, ПС является эффективным и безопасным препаратом для лечения ОА суставов кистей: уменьшает боль, сохраняет и улучшает функцию суставов, позволяет снизить дозу применяемых НПВС, а в ряде случаев даже отказаться от них. Кроме того, ПС характеризуется прекрасной переносимостью. Хотя и на небольшой выборке, получены некоторые свидетельства влияния препарата на рентгенологические признаки заболевания, а именно, отсутствие рентгенологической динамики через год от начала лечения. Однако эти интересные данные требуют дальнейшего подтверждения на большей выборке больных.
Информация об авторах:
Алексеева Людмила Ивановна – заведующая лабораторией остеоартроза НИИР РАМН. E-mail: Alekseeva@irramn.ru;
Чичасова Наталия Владимировна – профессор кафедры ревматологии ФППОВ ММА им. И.М. Сеченова. Тел. 8 (499) 614-35-22;
Кашеварова Наталия Гаврииловна – врач НИИР РАМН. Тел. 8 (499) 614-44-78;
Шарапова Евгения Павловна – научный сотрудник НИИР РАМН. Тел. 8 (499) 614-44-78;
Братыгина Елена Александровна – младший научный сотрудник НИИР РАМН. Тел. 8 (499) 614-44-78;
Зайцева Елена Михайловна – младший научный сотрудник НИИР РАМН. Тел. 8 (499) 614-44-78;
Иммаметдинова Гюзель Рашидовна – ассистент кафедры ревматологии ФППОВ ММА им. И.М. Сеченова. Тел. 8 (499) 614-35-22



