К витамину А относится несколько соединений, близких по структуре: ретинол (витамин А1), дегидроретинол (витамин А2), ретиналь (витамин А-альдегид), ретиноевая кислота (витамин А-кислота), эфиры витамина А. Преимущественно в виде эфира – ретинола пальмитата – витамин А содержится в животных продуктах (яичном желтке, рыбьем жире, печени млекопитающих и рыб, молочных продуктах). В растительных продуктах (морковь, красный перец, петрушка, шпинат, лук, черная смородина, облепиха, шиповник) содержится провитамин А – β-каротин, который в организме человека превращается в витамин А (каждая молекула каротина является источником двух молекул витамина А) [1].
Функции витамина А
В организме человека витамин А выполняет ряд важнейших функций, участвуя в окислительно-восстановительных процессах, синтезе белков, жиров, углеводов, а также глюкокортикостероидов. Витамин А-альдегид (ретиналь) обеспечивает процессы фоторецепции, соединяясь со специфическим белком сетчатки опсином с образованием родопсина, представляющего собой важнейшую составную часть зрительного пигмента [2–4]. Под влиянием света родопсин расщепляется на ретиналь и опсин, а освобождающаяся при этом энергия возбуждает рецепторы зрительного анализатора. В темноте освободившийся в процессе фоторецепции ретиналь вновь вступает в реакцию с опсином, восстанавливая таким образом запасы родопсина [5].
Установлено также, что ретинол, ретиналь и ретиноевая кислота повышают митотическую активность эпителиальных клеток и препятствуют накоплению в них кератогиалина, что обеспечивает эпителизацию кожи и слизистых оболочек и предотвращает гиперкератоз. Возможный путь реализации этого эффекта заключается в том, что витамин А способствует синтезу РНК и сульфатированных мукополисахаридов, играющих важную роль в проницаемости клеточных мембран [6].
Витамин А поступает в организм человека с пищей и всасывается в тонкой кишке с участием желчных кислот. В крови ретинол транспортируется в связанном с белками виде. Большая часть витамина А (до 90 %) депонируется в печени в виде ретинола пальмитата, а продукты метаболизма выделяются почками и кишечником.
Суточная потребность в витамине А взрослого человека составляет около 3000–3500 МЕ, у беременных достигает 5000 МЕ.
История изучения витамина А
Расстройство сумеречного зрения (гемералопия) было хорошо известно еще жителям Древнего Египта, которые для лечения этого заболевания употребляли в пищу печень.
Современная история изучения применения витамина А в медицинских целях началась в 1876 г., когда американский биохимик Snell E. успешно применил рыбий жир для лечения гемералопии и ксерофтальмии.
В 1880 г. российский педиатр Лунин Н.И. обнаружил, что лабораторные животные быстро погибают при их кормлении только чистыми белками, жирами и углеводами. Оказалось, что для полноценного питания необходим еще один пищевой компонент, содержащийся в сухом молоке (как впоследствии оказалось – витамины, в т. ч. витамин А) [7].
Спустя 29 лет, в 1909 г., немецкий исследователь Stepp W., изучая вопрос о способности организма животных синтезировать необходимые для жизни компоненты, показал, что пища, вполне достаточная для обеспечения нормального роста и развития лабораторных мышей (хлеб и молоко), теряет питательные качества после обработки ее спиртом и эфиром. Добавление к экстрагированной пище полученного из нее экстракта вновь делало ее пригодной для полноценного питания. Таким образом, Stepp впервые выделил из молока жизненно необходимые жирорастворимые вещества, включая витамин А, без которого подопытные мыши выживали в течение не более трех недель [8].
Дальнейшее развитие изучение витамина А получило в работе Collum D. и Davis J. (1913), проводивших исследование на молодых растущих крысах. Кормление животных пищевой смесью из специально обработанных продуктов – белка, углеводов и смеси солей – приводило к остановке роста, который возобновлялся после добавления к диете сливочного масла или эфирного экстракта яичного желтка. Collum D. и Davis J. установили, что активные начала сливочного масла и рыбьего жира связаны с неомыляемой фракцией, и дали ему название “растворимый в жирах фактор А”. В исследованиях, опубликованных в 1913 г., Osborne O. и Mendel G. подтвердили, что добавление сливочного масла к искусственно составленной пищевой смеси обеспечивает нормальный рост животных. Ими же была выделена активная фракция сливочного масла и обращено внимание на то, что у молодых крыс, получавших искусственно составленные пищевые смеси, помимо остановки роста наблюдалось заболевание глаз, излечивавшееся после добавления к пище сливочного масла или трескового жира. В 1916 г. Drummond D. назвал этот фактор витамином А [8].
В дальнейшем было показано, что ряд растительных продуктов обладает действием, сходным с таковым витамина А. Подобная активность таких продуктов связана с наличием в них растительного пигмента – β-каротина. По данным Steenbock S., растения, наиболее богатые каротином, одновременно обладают и наиболее выраженной А-витаминной активностью, а выделенный из растений кристаллический каротин способен поддерживать нормальный рост и развитие животных, получающих пищу, лишенную витамина А. Однако все эти исследования не дали удовлетворительного объяснения существа связи между витамином А и желтым растительным пигментом каротином. Характер этой связи был установлен Moore L. в 1930 г., который показал, что каротин, содержащийся в пище, в организме превращается в витамин А и является, таким образом, его биологическим предшественником.
В 1931 г. швейцарский химик Kar -rer P. получил чистый ретинол из рыбьего жира и определил молекулярную структуру витамина А [9]. Шесть лет спустя этому ученому была присуждена Нобелевская премия по химии за работу “Исследование каротиноидов и флавинов”, а также за изучение витаминов А и В2.
В 1946 г. Isler O. впервые синтезировал витамин А, после чего было налажено его промышленное производство [10], а 3 года спустя на рынке появился препарат витамина А [11].
В 1987 г. одновременно две группы ученых – Chambon P. и соавт. во Франции, а также Evans R.M. и соавт. в США – обнаружили рецепторы к ретиноевой кислоте в клеточном ядре. В 1997 г. UNICEF (Международный чрезвычайный фонд помощи детям ООН) и ВОЗ, а также правительства Канады, США, Великобритании и некоторых других стран начали программу по обеспечению детей с недостаточностью питания высокими дозами витамина А [12].
Интоксикация витамином А
В настоящее время в клинической практике витамин А применяют для лечения и профилактики недостаточности витамина А, а также при некоторых кожных и глазных заболеваниях. Витамин А назначают внутрь, внутримышечно и местно. Дозируют препарат в микрограммах (мкг) или международных единицах (МЕ): 1 мкг = 3,33 МЕ.
В настоящее время острая интоксикация витамином А не описывается, а широкое распространение поливитаминных препаратов и биологически активных добавок к пище, содержащих высокие дозы витамина А, приводит к увеличению частоты случаев хронической интоксикации этим витамином. Так, в США ежегодно регистрируется 10–15 наблюдений хронической интоксикации данным витамином.
Первые наблюдения острой интоксикации витамином А были связаны с употреблением в пищу печени белого медведя, содержащей высокие концентрации витамина А, что приходится на период освоения Арктики в XVIII–XX вв. исследователями Нансеном Ф., Амундсеном Р., Колчаком А.В., Ушаковым Г.А. [13, 14]. Клиническая картина острой интоксикации определяется острым повышением внутричерепного давления, сопровождающимся головной болью, головокружением, рвотой, диплопией, светобоязнью, судорогами. Наряду с полиморфной неврологической симптоматикой развивается эксфолиативный дерматит [15]. Зачастую острая интоксикация витамином А заканчивается летальным исходом [16].
Развитие хронической интоксикации витамином А у взрослых возможно при употреблении его в дозе более 50 тыс. МЕ в течение нескольких лет или 100 тыс. МЕ в течение нескольких месяцев [17–19]. Клиническими проявлениями хронического гипервитаминоза А являются сухость кожи и слизистых оболочек (глоссит, хейлит), выпадение волос, ломкость ногтей, оссалгии и артралгии, гиперостоз, диспепсические явления, головная боль, увеличение лимфатических узлов, аменорея [20]. Нередко выявляются гиперкальциемия, гиперлипидемия, повышение внутричерепного давления [21]. Характерным проявлением длительной хронической интоксикации витамином А является формирование цирроза печени (ЦП) [16, 22–26].
Механизм формирования ЦП при хронической интоксикации витамином А связан с аккумуляцией ретинола в виде липидных вакуолей в клетках Ито с их гиперплазией и гипертрофией, вызывающих на начальных этапах компрессию печеночных синусоидов [27]. В последующем отмечается неконтролируемая активация звездчатых клеток с трансформацией в миофибробласты и массивной выработкой компонентов экстрацеллюлярного матрикса, реализующегося в прогрессирующий перисинусоидальный фиброз печени [28–43]. Кроме того, показано, что ретинол вызывает апоптоз гепатоцитов [44].
На начальных этапах поражение печени потенциально обратимо [45–48], но в случае формирования ЦП оно становится необратимым, несмотря на отмену витамина А [37, 41, 49].
Представляем клиническое наблюдение хронической интоксикации витамином А с поражением различных органов и систем, ведущим среди которых явился ЦП.
Клиническое наблюдение
Больной И. 36 лет, предприниматель (см. рисунок). В сентябре 2007 г. отметил появление постоянного озноба, выпадение волос на кожных покровах тела, атрофию мышц. В конце ноября присоединился дискомфорт в правом подреберье. К декабрю развилась тотальная алопеция (в небольшом количестве волосы сохранились только на волосистой части головы). С декабря отметил появление жажды, болей в спине, в плечевых суставах умеренной интенсивности, появление выраженных болей в паховых областях, постепенно распространившихся на внутреннюю поверхность бедер, сопровождавшихся цианозом кожного покрова бедер и усиливающихся на фоне физической нагрузки, появление продольной исчерченности и истончения ногтей. В анализах крови имели место увеличение СОЭ, уровней С-реактивного белка, глюкозы, отмечалось снижение протромбинового индекса, содержания альбумина.
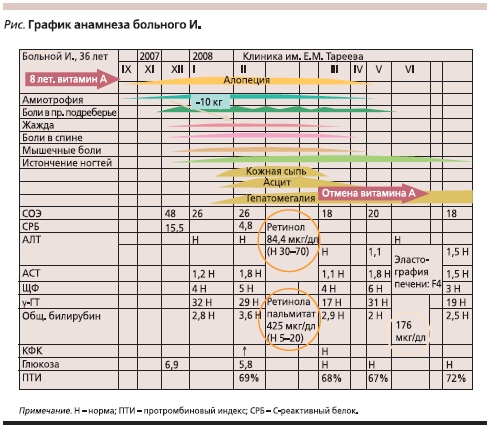
В январе 2008 г. отметил резкое увеличение живота в объеме, появилась мигрирующая ярко-розового цвета сыпь на коже передней поверхности туловища и бедер (кожа в области высыпаний была липкой на ощупь). За 2 месяца больной похудел на 10 кг.
По данным ультразвукового исследования брюшной полости выявлены выраженная гепатомегалия, спленомегалия, асцит, расширение воротной вены. Кроме того, отмечено 1,5-кратное повышение уровня АСТ при нормальном уровне АЛТ, 4-кратное повышение уровня щелочной фосфатазы (ЩФ) и 32-кратное – γ-глутаматтранспептидазы (γ-ГТ); уровень общего билирубина был повышен в 3 раза. При компьютерной и магнитно-резонансной томографии брюшной полости подтверждено наличие гепато- и спленомегалии, портальной гипертензии.
В феврале 2008 г. больной был госпитализирован в клинику нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева ММА им. И.М. Сеченова. При поступлении кожные покровы липкие с желтушным оттенком, на передней поверхности туловища и шеи мигрирующая ярко-розовая эритема с нечеткими контурами и неправильной формы. Кожа пальцев рук, ладоней и бедер синюшна. Отмечаются точечные ярко-красные пятна на коже голеней. Склеры иктеричны, отмечается хейлит. Ногти истончены с продольной исчерченностью и десквамацией эпидермиса вокруг ногтевой пластинки; отмечается отсутствие волосяного покрова на всех участках тела и значительное облысение волосистой части головы.
При обследовании подтверждено наличие гепато- и спленомегалии, асцита. Наряду с изменением печеночных тестов (повышение уровней аминотрансфераз, ЩФ, γ-ГТ, билирубина) обращали на себя внимание гипергликемия, гиперхолестеринемия, гиперкальциемия, снижение уровня альбумина и протромбинового индекса. При использовании панели неинвазивных сывороточных тестов фиброза печени FibroTest получены данные в пользу F4-стадии фиброза по системе METAVIR, что соответствовало сформированному ЦП.
Дифференциальный диагноз проводился между плазмоклеточными дискразиями (миеломная болезнь, POEMS-синдром, амилоидоз), неопластическим процессом (гепатоцеллюлярная карцинома, солидные опухоли с паранеопластическим синдромом), однако данных в пользу указанных диагностических концепций получено не было. В то же время наличие ЦП не вызывало сомнения.
Выраженная полиморфная клиническая картина, характеризующаяся системным поражением кожи и ее производных, печени, эндокринной системы, мышц, костей, позволяла обсуждать хроническую интоксикацию. При изучении анамнеза удалось выяснить, что 8 лет назад по рекомендации оториноларинголога в связи с сухостью слизистой оболочки носа больному был назначен масляный раствор ретинола по 1–2 капли интраназально. Больной самостоятельно в течение короткого времени увеличил дозу препарата и в течение 7 лет ежедневно применял по 2 флакона (20 мл) 3,44 %-ного масляного раствора ретинола интраназально (1 мл = 100000 МЕ). Очевидно, что большая часть препарата из носовой полости попадала в носоглотку и заглатывалась, в результате чего суточная норма потребления витамина А была превышена более чем в 500 раз.
Выявленные анамнестические данные позволили обсуждать хроническую интоксикацию витамином А как причину имевшейся клинической картины заболевания. Указанное предположение нашло свое подтверждение при определении общего и особенно связанного ретинола в сыворотке крови (последний превышал норму в 21 раз).
Таким образом, был верифицирован диагноз тяжелой хронической интоксикации витамином А с поражением печени (ЦП с синдромами портальной гипертензии и печеночно-клеточной недостаточности), кожи (эритематозная экзантема, алопеция, хейлит), ногтей, костей, мышц, эндокринной системы (гипергликемия).
Витамин А был отменен. В течение нескольких месяцев исчезла эритематозная сыпь, появились пушковые волосы на кожном покрове, восстановились волосяной покров головы и ногтевые пластинки, исчезли боли в спине и хейлит, прошла жажда. В настоящее время прогностически значимым у больного является поражение печени, соответствующее циррозу. При 2-летнем динамическом наблюдении за пациентом сохраняются умеренно выраженные признаки печеночно-клеточной недостаточности и портальной гипертензии.
Представленное клиническое наблюдение демонстрирует реальную возможность развития редкого варианта лекарственного ЦП, обусловленного хронической интоксикацией витамином А. Отмена витамина А позволяет надеяться на изменение прогноза у данного больного.
Информация об авторах:
Александрова Екатерина Александровна – аспирант кафедры терапии
и профболезней МПФММА им. И.М. Сеченова.
E-mail: knvpb@mma.ru;
Гайдашева Екатерина Валерьевна – аспирант кафедры терапии
и профболезней МПФ ММА им. И.М. Сеченова.
E-mail: knvpb@mma.ru;
Бурневич Эдуард Збигневич – кандидат медицинских наук, ассистент кафедры
терапии и профболезней МПФ ММА им. И.М. Сеченова.
E-mail: eduard.z.burnevich@mtu-net.ru



