Крипторхизм – постоянное отсутствие одного или обоих яичек в мошонке, является одной из наиболее распространенных аномалий полового развития [1, 2]. По данным ВОЗ, ежегодно в разных странах мира к врачам обращаются сотни тысяч мужчин с нарушениями репродуктивной функции. При этом у каждого второго пациента причиной бесплодия является заболевание, перенесенное в детстве: грыжа, водянка оболочек яичка, крипторхизм, варикоцеле и т. д. [3]. Вариантами синдрома “пустой мошонки” являются [4] крипторхизм или ретенция, ретрактильное яичко, эктопия и агенезия яичка (см. рисунок).
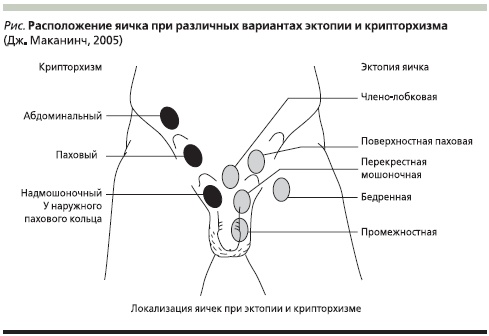
Случаи крипторхизма в общей популяции составляют 0,1–5,0 % [4]. У доношенных новорожденных крипторхизм находят в 3,4–4,2 % случаев, у недоношенных – в 30,0–35,0, у взрослых мужчин – в 0,7–0,8 % [4–6]. Существуют разногласия по вопросу о частоте крипторхизма и оптимальном возрасте его лечения. Так, сроки спонтанного опущения яичек, по данным многих авторов, намного превышают принятые за норму временные рамки для этого процесса. По мнению Hiort O. и соавт. (2005), спонтанное опущение яичек имеет место только у 7 % мальчиков в возрасте до года [6] в отличие от прежних представлений, согласно которым оно происходило в 70 % случаев.
Крипторхизм сопровождается рядом негативных последствий, главными из которых считают гипотрофию яичек, повышенный риск малигнизации ткани яичка и снижение фертильности [7]. Риск опухолевой трансформации у мужчин с крипторхизмом в 4–10 раз выше, чем в общей популяции [8]. Некоторые авторы приводят еще более неутешительные цифры. Так, по данным Маканинча Дж., крипторхизм повышает риск злокачественных опухолей яичка в 35–48 раз [4]. Отмечено также, что при одностороннем крипторхизме в 20 % случаев опухоли развиваются и в контралатеральном яичке, а если оба яичка находятся интраабдоминально, риск возрастает до 30 % [9].
Общеизвестно, что крипторхизм является доказанным фактором риска развития бесплодия. У больных с односторонним крипторхизмом фертильность сохраняется в 80–90 % случаев [10]. При двустороннем крипторхизме, по мнению одних авторов, бесплодием страдают 89 % больных [1], а по мнению других, только 38–65 % таких пациентов имеют сниженную фертильность [10]. Наибольшей потенциальной опасности подвержены пациенты с двусторонним крипторхизмом в форме интраабдоминальной ретенции, неправильным строением наружных половых органов, а также аномалиями кариотипа [11].
Этиология крипторхизма
Этиология крипторхизма, несмотря на многочисленные и длительные исследования, до конца не изучена и является скорее всего многофакторной [6]. Существует “гормональная” теория возникновения крипторхизма, которая объясняет его развитие сбоем в функционировании гипоталамо-гипофизарно-гонадной системы [12– 14]. Однако “гормональная” теория не может объяснить возникновение одностороннего крипторхизма, ведь у значительной части таких больных гормональные нарушения не выявляются [1]. Теория механических препятствий на пути миграции яичка, таких как фиброзные перегородки и облитерации в паховом канале, недоразвитие направляющей связки и др., объясняет возникновение эктопии яичка [13]. Определенная роль в продвижении яичек отводится паховой связке, бедренно-половому нерву и состоянию мышечного аппарата паховой области [15]. Снижение внутрибрюшного давления, наблюдаемое при различных синдромах, а также открытый вагинальный отросток, часто выявляемый во время операции низведения, повышают вероятность развития крипторхизма [16]. Наследственность [17], осложненная беременность [12], факторы окружающей среды, в т. ч. избыток эстрогенов [18], также, по данным разных авторов, влияют на возникновение крипторхизма. Роль аутоиммунных процессов в развитии крипторхизма тщательно изучается. При одностороннем крипторхизме обнаруживаются изменения в контралатеральном яичке, что многими авторами расценивается как подтверждение данной теории [19]. В настоящее время все больше исследователей склоняются в пользу системности данного заболевания [14]. Двусторонний брюшной крипторхизм нередко сочетается с дисгенезией яичек [20]. Поэтому у части пациентов, несмотря на раннее низведение, яички все же остаются неполноценными [21].
Таким образом, механизм опущения яичек еще окончательно не ясен, остается много нерешенных вопросов относительно дегенеративных изменений в неопущенных яичках, до конца не выяснены возможности восстановления патологических процессов в зародышевом эпителии после лечения, не ясны сроки регенерации сперматогенного эпителия.
Патогенез осложнений крипторхизма
Патогенетический механизм развития осложнений крипторхизма тоже окончательно не установлен. Предполагается, что в их основе лежит нарушение процесса сперматогенеза, а именно его ключевого этапа – трансформации гоноцитов (фетальных стволовых клеток) в сперматогонии взрослого типа (Aт-сперматогонии, темные сперматогонии) [21].
Факторы, действующие на яичко, расположенное в необычных условиях, приводят к развитию в нем атрофических процессов, нарушению сперматогенеза и могут вызвать его злокачественное перерождение. В большинстве случаев неопущенное яичко уменьшено в размерах и дряблое. Размеры контралатерального яичка при одностороннем крипторхизме у детей в возрасте до 11–12 лет не отличаются от нормы, а к 13–14 годам выявляется их отставание [5]. Неопущенное яичко отстает в развитии прежде всего в результате нарушения его терморегуляции. Дистрофические изменения в контралатеральном яичке обусловлены, по-видимому, нарушением гематотестикулярного барьера [22].
У некоторых детей уже в начале пубертатного периода обнаруживается снижение секреции тестостерона гонадами и их реакции на хорионический гонадотропин. С началом полового созревания дистрофические изменения сперматогенного эпителия в неопущенных яичках резко усиливаются и становятся в большинстве случаев необратимыми, что впоследствии ведет к бесплодию [11, 23].
Существует прямая зависимость тяжести морфологических проявлений крипторхизма от степени ретенции и давности заболевания. Морфологические изменения определяются начиная с 6-месячного возраста, достигают наибольшей выраженности к 2 годам, а к 4 годам в яичках уже отмечаются обширные отложения коллагена, к 6 годам изменения еще более заметны, а к 9–10 годам приобретают необратимый характер [4].
Большинство пациентов с двусторонними абдоминальными яичками бесплодны, в то время как больные с односторонним абдоминально расположенным или односторонним отсутствием яичка потенциально способны к оплодотворению.
Среди возможных причин малигнизации неопущенного яичка обсуждаются следующие:
- Влияние высокой температуры.
- Роль гипоплазии и атрофии, постепенно прогрессирующих в неопущенном яичке.
- Гонадная дисгенезия.
- Гормональный дисбаланс.
- Аномалии числа, формы хромосом герминальных клеток и др. [25].
Нарушение этапа трансформации гоноцитов в Aт-сперматогонии ведет как к недоразвитию пула сперматогенных клеток, так и к персистированию и дегенерации гоноцитов, которые становятся источником carcinoma in citu и в последующем – рака яичка.
Таким образом, крипторхизм, являясь одной из наиболее распространенных аномалий полового развития, может вызвать ряд тяжелых осложнений (нарушение экскреторной и инкреторной функций яичек, малигнизацию ретенированного яичка и др.).
Отсутствие единого мнения об этиопатогенезе крипторхизма еще раз доказывает актуальность и нерешенность этой проблемы во всем мире.
Диагностика крипторхизма и его осложнений
Диагностика крипторхизма включает в первую очередь тщательный сбор анамнеза и физикальное обследование пациента. Иногда выявляемый ложный крипторхизм считается нормальным состоянием, однако риск восхождения яичка может приблизиться к 50 % [26]. Лабораторные исследования при одностороннем неопущении яичка не требуются. Двусторонние непальпируемые яички и крипторхизм с сочетанными аномалиями строения гениталий требуют консультации эндокринолога и/или генетика, определения уровня половых гормонов, исследования кариотипа для исключения гермафродитизма, а также проведения теста с хорионическим человеческим гонадотропином (ХГЧ) [27].
Большая роль в диагностике крипторхизма отводится своевременному выполнению ультразвукового (УЗИ) и допплерографического исследований органов мошонки, с помощью которых оценивают локализацию, размеры и кровоток в яичке [24, 27, 28]. Как правило, объем дистопированных яичек меньше, но эхоструктура их однородна [28]. При цветном допплеровском картировании оценивают равномерное распределение потока крови в паренхиме яичек. К сожалению, до настоящего времени качественная оценка скоростных показателей в D-режиме у детей раннего возраста не разработана.
Таким образом, УЗИ является основным методом инструментальной диагностики и дает 100 %-ный результат при паховой форме крипторхизма [29]. С целью диагностики внутрибрюшной задержки яичка при неэффективности УЗИ применяют компьютерную томографию (КТ), ядерно-магнитный резонанс (ЯМР), селективную флебографию и лапароскопию (см. таблицу) [27, 30, 31].
Таблица.Последовательность и возможности диагностики задержки опущения яичка [27].
Диагностика таких осложнений крипторхизма, как гипотрофия яичек, бесплодие и рак, тоже вызывает определенные затруднения. Для диагностики гипотрофии в арсенале уролога имеются: орхидометры, тестиметры, орхиотонометры, УЗИ с допплером. УЗИ в отличие от орхидометрии и орхиотонометрии позволяет с высокой точностью определить размеры, объем, консистенцию яичек, выявить возможные неоднородные включения в их паренхиме. УЗИ с допплером может дать оценку кровотока в яичке. Здесь тоже нет единого мнения при сравнении полученных данных. Так, Зубарев А.Р. и соавт. (1999) предлагают сравнивать полученные результаты с нормативными показателями кровотока и допплерограммой контралатерального яичка [32]. Юсуфов А.А. и соавт. (2005) утверждают, что гемодинамические нарушения в гонадах носят двусторонний характер в силу содружественной вазомоторной реакции, и предлагают проводить оценку кровотока по интегральному гемодинамическому индексу. Пыков М.И. и соавт. (1998) наиболее информативным допплерометрическим параметром называют индекс резистентности (IR) – отношение разности пиковой систолической и конечной диастолической скоростей к пиковой систолической скорости кровотока. При крипторхизме пиковая систолическая скорость кровотока во внутрияичковых артериях не превышает 9–10 см/с (в норме – от 8 до 26, в среднем – 12 см/с), а диастолическая составляющая резко снижена [33].
Сейчас практически все авторы сходятся на том, что тестикулярный объем имеет прямую связь со сперматогенезом. Так, по данным Schoorl и соавт. (1983), если принимать аплазию за 0 мл, то средний тестикулярный объем у мужчин с азооспермией составляет 12,5 см3, при олигоспермии – 15 см3, при гипо- или нормоспермии – 17 см3. Поэтому выявление гипотрофии яичка при крипторхизме является важным еще и для прогнозирования нарушений фертильности у мужчины.
В диагностике бесплодия некоторые авторы опираются на изменения гормонального фона. Так, для заключения о фертильности субъекта некоторые авторы предлагают определение уровней фолликулостимулирующего и лютеинизирующего гормонов [34]. Однако судить о фертильности только по уровню половых гормонов, особенно когда речь идет об одностороннем крипторхизме, не совсем корректно. Имеются данные об использовании для диагностики бесплодия определения уровня ингибина В, который коррелирует с показателями спермограммы [35]. Другие авторы с целью определения фертильного потенциала проводят анализ биоптата. При этом у лиц с азооспермией после низведения яичка определяется отсутствие Ат-сперматогоний в биоптате [36]. Однако не все авторы согласны с тем, что гистологическое исследование сперматогенеза всегда коррелирует с фертильностью. Cywes и соавт. (1981) доказали, что иногда явные нарушения в семенной жидкости могут сочетаться с почти нормальным клеточным составом биоптатов яичка.
С наибольшей достоверностью судить о фертильности можно по показателям спермограммы. Так, например, в полученных Dickerman и соавт. (1979) спермограммах у больных крипторхизмом объем семенной жидкости варьировался от 1 до 3 мл, подвижность сперматозоидов былa менее 30 % во всех случаях, процент олиго- и азооспермии был высоким (87,5 %). По другим данным [37], у этой категории больных азооспермия была выявлена в 15 % случаев, а олигоспермия – в 30 %. Таким образом, вопросы, связанные с нарушением репродуктивной функции мужчин с односторонним крипторхизмом, дискутабельны и требуют дальнейших исследований. Видимо, поэтому никем не оспаривается утверждение, что отцовство само по себе является наилучшим показателем фертильности.
В диагностике рака яичка особое внимание уделяется определению специфических опухолевых маркеров: α-фетопротеина, β-субъединицы ХГЧ, лактатдегидрогеназы. Ценность лактатдегидрогеназы как маркера при раке яичка невысока, но повышение ее уровня более 2000 ЕД/л – признак опухоли [38]. Однако Albers и соавт. (2005) подчеркивают, что нормальный уровень маркеров не должен рассматриваться как аргумент, исключающий диагноз рака яичка.
Многие авторы для диагностики рака яичка рекомендуют тестикулярную биопсию. Если определяется карцинома in situ (CIS), рекомендуют контралатеральную биопсию. В ходе исследования у 300 мужчин, перенесших орхиопексию, последующая биопсия яичка выявила CIS в 1,7 % случаев [39]. Однако Ozen и соавт. (1989) утверждают, что обнаружение атипических клеток в неопущенных яичках еще не означает наступления малигнизации. С целью выявления рака in situ Lenz и соавт. рекомендуют ультрасонографию мошонки для всех пациентов после полового созревания, перенесших орхиопексию в качестве рутинного метода диагностики CIS [40].
С помощью УЗИ при диагностике рака яичка в паренхиме можно обнаружить гипо-, изо- и гиперэхогенные образования – нередко с кистозными включениями и кальцинатами, которые могут быть интраи экстратестикулярными. Все больше данных, позволяющих рассматривать тестикулярный и нетестикулярный микролитиаз в качестве раннего маркера рака яичка [41], хотя некоторые исследователи связь между этими патологическими состояниями все еще оспаривают [42]. Распространенность тестикулярного микролитиаза при крипторхизме выше, чем в популяции. Так, в исследовании Nicolas F. и соавт. при катамнестическом обследовании 63 пациентов через 7,5–11,7 года после оперативного вмешательства по поводу крипторхизма интратестикулярные кальцинаты выявлены в 9,52 % случаев [43]. Все это свидетельствует о необходимости проявления онкологической настороженности у молодых людей с крипторхизмом в анамнезе и проведения им ежегодного УЗИ.
Методы лечения крипторхизма
Вопросы лечения крипторхизма являются до сих пор самыми дискутабельными. Наибольшие разногласия связаны с определением оптимальных сроков лечения.
На выбор срока проведения оперативного вмешательства влияют следующие обстоятельства:
- Возраст сохранения реального шанса спонтанного опущения яичка.
- Сроки возникновения необратимых морфологических изменений.
- Отдаленные результаты лечения в отношении фертильности и риска развития рака яичка в зависимости от возраста оперируемых,
- Социальные и психологические аспекты [1, 2].
В настоящее время почти все исследователи сходятся на том, что операцию низведения яичка нужно выполнить до начала пубертата [27, 44], а обоснование тактики ожидания и наблюдения встречается в литературе только в отношении приобретенных форм крипторхизма [45].
Однако все еще имеются сторонники выполнения операции в возрасте 6–9 лет. Их аргументы сводятся к следующему: существует возможность спонтанного опущения яичка; в допубертатном периоде структура яичка практически не развивается, поэтому возможность повреждения ее крайне мала; в старшем возрасте анатомические структуры более дифференцированны, что облегчает проведение операции; повышение гормональной активности в пубертате способствует росту и развитию яичка [46]. Самые поздние сроки лечения, указанные в современной литературе, – 4–5 лет.
Сегодня детские урологи пришли к необходимости раннего лечения крипторхизма в надежде, что данная парадигма приведет к улучшению фертильности и снижению роста злокачественных опухолей [47]. Сторонники операций в раннем возрасте аргументируют свою позицию тем, что после операции создаются условия для нормального развития яичка в более раннем возрасте, не успевают сформироваться значительные структурные нарушения гонады, что положительно влияет на функцию яичка [1, 2, 5, 44].
Многие авторы рекомендуют оперативное лечение в возрасте не старше 2–3 лет [12, 27, 48]. Большинство авторов, в основном зарубежных, указывают сроки c 6–12 месяцев как наиболее благоприятные для оперативного лечения крипторхизма, т. к. в неопущенных яичках патологические изменения возникают уже в 6-месячном возрасте [23, 49, 50].
В соответствии с обстоятельствами, влияющими на выбор срока для оперативного лечения больных крипторхизмом, приведем важные результаты некоторых исследований. По данным большинства авторов, спонтанное опущение яичек происходит самое позднее в 3-месячном возрасте, и едва ли его следует ожидать после 4 месяцев от рождения [5, 23, 50]. Так, Wenzler и соавт. (2004), проведя обзор историй болезни 1235 пациентов с крипторхизмом, показали, что самопроизвольное опущение яичка наблюдалось только в 6,9 % случаев и все эти дети находились в возрасте не старше 6 месяцев [51].
Kollin и соавт. (2007) сравнивали результаты двух групп мальчиков с крипторхизмом, прооперированых в возрасте 9 месяцев и 3лет, и выявили, что раннее проведение операции уменьшает выраженность гипотрофии яичка в отдаленном периоде [49].
Несмотря на многочисленные исследования, фертильность при крипторхизме – все еще “зыбкая” тема. Примерно в 20 % случаев одностороннего крипторхизма даже своевременная орхипексия не избавляет от бесплодия в будущем. При двустороннем крипторхизме частота бесплодия в несколько раз выше, несмотря на лечение [4]. С уверенностью можно говорить лишь о том, что только неоперированные мужчины с билатеральными интраабдоминальными яичками становятся стерильными. В остальных случаях крипторхизма мужчины находятся на неопределенном уровне фертильности. В исследовании Lee и соавт. (2001) у мужчин, страдающих бесплодием и перенесших операцию по поводу одностороннего крипторхизма, взаимосвязи между размерами яичка при орхипексии, возрастом проведения операции и фертильностью выявлено не было [52]. Однако с учетом того, что ранняя орхипексия оказывает положительный эффект на рост яичка после операции и существуют предположения, что тестикулярный объем примерно пропорционален сперматогенезу, это позволяет надеяться, что раннее хирургическое вмешательство может улучшить будущий сперматогенез.
В одном из исследований [53] с целью изучения фертильности при крипторхизме был произведен анализ биопсийного материала у больных, оперированных по поводу одностороннего крипторхизма. Причем биопсия была произведена с двух сторон и у мужчин с односторонним крипторхизмом. При сравнении показателей фертильности оперированного и мошоночного яичка не было выявлено существенных различий лишь у лиц, оперированных до года. Во всех остальных случаях были выявлены статистически значимые различия независимо от срока проведения орхипексии. Результаты этого исследования, как и некоторых других [54, 55], показывают, что фертильность снижается с увеличением возраста оперативного лечения. Таким образом, лишь орхипексия на первом году жизни способствует сохранению имеющегося фертильного потенциала.
В последние годы исследовалась роль Ат-сперматогоний в прогнозировании дальнейших перспектив фертильности мужчин, прооперированных по поводу крипторхизма в детстве. В результате было выявлено, что у пациентов с наличием трансформации в Ат-сперматогонию показатели спермограммы непосредственно зависят от сроков операции, т. е. чем раньше произведена операция, тем выше показатели спермы. В свою очередь такой зависимости не наблюдается в отсутствие Ат-сперматогонии во время операции [21, 24]. Все это подтверждает теорию о том, что при крипторхизме кроме врожденного тестикулярного поражения, более выраженного при двусторонней и абдоминальной формах, имеет место вторичное повреждение яичек в связи с пребыванием их в неблагоприятной среде. Поэтому выбор оптимального возраста должен определяться сроками появления вторичных повреждений.
До сих пор не ясно, является ли ранняя коррекция крипторхизма профилактическим мероприятием возникновения рака яичка. Большинство авторов считают, что орхипексия не предохраняет яичко от малигнизации, а только облегчает наблюдение за яичком [1], что тоже имеет большое значение, т. к. поздняя постановка диагноза может привести к распространению болезни, что в свою очередь усиливает токсичность и длительность последующей терапии. Недавние исследования показали, что препубертатная орхипексия снижает риск развития рака яичка [56]. Так, в исследовании, проведенном в Великобритании, было выявлено, что мужчины с одним неопущенным яичком в анамнезе не имеют повышенного риска развития рака яичка, если коррекция была осуществлена до 10-летнего возраста [57]. По другим данным [50], возрастающий риск рака яичка отмечается, если орхипексия была отложена до 11–13-летнего возраста или вообще не проводилась.
В противовес этим данным можно привести результаты крупного исследования, проведенного в Дании [55], в котором были обследованы 1335 мужчин, оперированных в детстве по поводу крипторхизма в разные сроки. В результате выявлено, что риск неоплазии составил 5 % у пациентов с внутрибрюшным расположением яичка, неправильным строением наружных половых органов и изменением кариотипа по сравнению с 0 % у пациентов без этих характеристик. То есть, по данным этих авторов, сроки проведения операции не влияют на возможность развития рака яичка у больных крипторхизмом.
Говоря о сроках оперативного лечения крипторхизма, следует обратить внимание на то, что в современных руководствах чаще рекомендуется проводить операцию на втором году жизни ребенка, несмотря на то что, по последним данным, процессы, приводящие к развитию нормальных по качеству и количеству половых клеток, нарушаются в первые полгода жизни новорожденного.
На основании вышеизложенного можно сделать вывод, что нет разницы между показаниями к хирургическому вмешательству до и после первого года рождения, поэтому раннее вмешательство должно, наверное, подразумевать операцию во второй половине первого года жизни младенца [59].
Итак, споры вокруг выбора оптимальных сроков оперативного лечения продолжаются уже более 100 лет. Вероятно, это связано с неудовлетворенностью врачей результатами лечения крипторхизма. И если длительное время считалось, что операция в раннем возрасте необязательна, а технически еще и сложна, то сегодня наметилась отчетливая тенденция к снижению возраста коррекции крипторхизма, однако споры все еще остались. Результаты последних исследований показывают, что некоторые дети с крипторхизмом изначально имеют высокий риск бесплодия и ранней операцией таким детям не помочь сохранить фертильность. Однако есть дети, имеющие хороший фертильный потенциал, для которых сроки проведения операции являются, возможно, решающими.
Эффективность и роль гормональной терапии также являются широко обсуждаемой темой. Практически все авторы сходятся на том, что гормонотерапию следует начинать в допубертатном периоде, однако конкретные сроки приводят разные: старше 5 лет [60], не ранее 4 лет [61], до 2-летнего возраста [62] и даже от 6 до 12 месяцев [1, 2]. В качестве консервативного метода лечения используется внутримышечное введение ХГЧ в возрастных дозировках или рилизинг-фактора лютеотропного гормона в виде назального спрея [1,2]. Имеются сообщения о местном применении ХГЧ (трехдневный курс инъекций по 500–750 МЕ в паховый канал) [63]. Некоторые авторы рекомендуют комбинировать гонадолиберин и ХГЧ с целью повышения эффективности гормональной терапии [64]. К методам местной гормональной терапии также относится ежедневная аппликация 1 %-ной мази тестостерона.
Некоторые авторы рекомендуют предоперационную или послеоперационную гормонотерапию с целью предоперационной подготовки, а затем улучшения функции низведенного яичка [12, 34].Эффективность гормонотерапии, по сообщениям эндокринологов, достаточно высока – от 60 до 90 %, однако в их сообщениях нет сведений о числе случаев с ретракцией яичка, возможно, этим и обусловлена такая радужная картина. Многие авторы указывают, что истинная эффективность гормонотерапии не более 20–40 %, по другим данным – не более 10–20 % [1, 4, 60]. В некоторых исследованиях было также установлено, что после успешного лечения гонадорелином опущенные яички в 30 % случаев возвращаются в исходное аномальное положение [12].
Хирургический метод лечения является принципиальным методом воздействия при лечении крипторхизма. Хирургическое лечение крипторхизма преследует следующие цели: сохранение фертильности; предупреждение осложнений; сохранение инкреторной функции яичка; достижение косметического эффекта и профилактика психосексуальных нарушений.
Для постпубертатных больных крипторхизмом в связи с относительным риском развития рака яичек вместе с рисками, связанными с анестезией, рекомендовано следующее: при одностороннем неопущении и нормальном контралатеральном яичке пациенту моложе 32 лет проводить орхиэктомию, а за пациентом старше 32 лет с односторонним неопущением яичка тщательно наблюдать и обследовать (орхипексию или орхэктомию проводят при трудностях наблюдения) [65].
Существует множество методов фиксации яичка. В большинстве случаев предпочтение отдается методике Петривальского, которая позволяет улучшить васкуляризацию яичка за счет сосудов мясистой оболочки мошонки и имеет более низкий уровень рецидивов по сравнению с другими методами. Многие авторы как в нашей стране, так и в Европе считают этот метод наиболее оптимальным. Главные трудности возникают, когда яичко задерживается на большом расстоянии от дна мошонки. При короткой тестикулярной артерии, когда невозможно опустить яичко в мошонку, применяется операция, разработанная Фоулером и Стефенсом [66]. Другими методами являются: стадийное перемещение яичка и микрохирургическая аутотрансплантация, при которой накладывают анастомозы между яичковой и нижней надчревной артерией, а также одноименными венами [28]. Кроме того, с помощью лапароскопии можно низвести яичко в один или два этапа, выявить и удалить рудиментарное яичко или установить диагноз агенезии [67].
Заключение
Таким образом, в ходе проведенного анализа имеющейся на сегодняшний день литературы было установлено, что: 1) крипторхизм приводит к серьезным отдаленным осложнениям: бесплодию и раку яичка; 2) в свою очередь лечение крипторхизма, особенно хирургическое, способствует уменьшению вероятности развития таких осложнений, как гипотрофия яичка, бесплодие, рак яичка.
Тем не менее, несмотря на длительность изучения проблем крипторхизма, на сегодняшний день до конца не стандартизированы конкретные сроки проведения хирургического лечения при разных формах неопущения яичка, не выработаны четкие показания к орхиэктомии. Это скорее всего связано с недостаточностью числа работ, в т. ч. и отечественных, посвященных ретроспективному анализу данных больных, перенесших операцию по поводу крипторхизма. Наличие таких работ помогло бы выработать тактику ведения больных крипторхизмом и уменьшить число осложнений при данной патологии.
Информация об авторах:
Гамидов Сафаил Исраил оглы – доктор медицинских наук, профессор кафедры урологии ГОУ ВПО РГМУ,
профессор кафедра акушерства, гинекологии, перинатологии и репродуктологии с курсом клинической
андрологии ГОУ ВПО ММА им. И.М.Сеченова Росздрава.
Тел.8 (495) 777-30-28, e-mail: docand@rambler.ru;
Овчинников Руслан Игоревич – кандидат медицинских наук, старший лаборант кафедры урологии ГОУ ВПО РГМУ.
Тел. 8 (495) 995-30-40, e-mail: riododc@rambler.ru;
Мясников Дмитрий Анатольевич – аспирант кафедры урологии ГОУ ВПО РГМУ.
E-mail: moe2009@yandex.ru;
Павловичев Алексей Александрович – аспирант кафедры урологии ГОУ ВПО РГМУ.
E-mail: alexxei4@rambler.ru;
Тажетдинов Олег Халитович – аспирант кафедры урологии ГОУ ВПО РГМУ.
E-mail: gelotazh2007@rambler.ru;
Тхагапсоева Регина Амирбековна – аспирант кафедры урологии ГОУ ВПО РГМУ.
E-mail: reginamed2@mail.ru



