Актуальность
Во всех странах наблюдается рост абсолютного числа пожилых людей. Согласно прогнозам Всемирной организации здравоохранения, к 2030 г. число людей в возрасте 60 лет и старше в мире возрастет до 1,4 млрд человек, что составит одну шестую населения мира [1]. В связи с этим актуальными в медицинской науке становятся проблемы патологических состояний и заболеваний, ассоциированных с пожилым возрастом. Под явлением старения понимаются все морфологические, биохимические, функциональные и психические изменения, возникающие в процессе жизни организма. Это постепенно развивающиеся и необратимые изменения структур и функций живого организма. Изучение феномена старения, а также его медицинских, социальных и экономических последствий носит междисциплинарный характер и приобретает все большее значение в свете современных преобразований в демографической структуре общества.
Важным барьерным органом между внешней и внутренней средой является кожа. Кроме того, она выполняет и другие функции: способствует поддержанию гомеостаза, удержанию влаги, обеспечивает терморегуляцию и обмен веществ. Однако с течением времени кожа подвергается возрастным изменениям, становится «хрупкой», следовательно, в меньшей степени способна поддерживать защитную функцию от внешних бактериальных, химических и физических агрессоров [2]. В настоящее время все чаще можно слышать о концепции синдрома «хрупкой» кожи: ослабление барьерной функции кожи, ксероз, повышенная проницаемость эпидермиса и вероятность развития заболеваний кожи [3]. Причины такой «хрупкости» кожи у пожилых пациентов можно разделить на четыре категории: физиологические (возрастные), патологические (в связи с болезнью), косвенные (влияние факторов окружающей среды) и ятрогенные (связанные с лечением). Эти факторы часто пересекаются, создавая сложный «фон» для формирования симптомов «хрупкой» кожи, поскольку возраст, образ жизни (например, курение, употребление алкоголя и пребывание на солнце), хронические болезни кожи, медицинские процедуры (например, прием таргетных противоопухолевых препаратов) и соматические заболевания (сахарный диабет, метаболические нарушения и др.) могут способствовать развитию синдрома «хрупкости» кожи. Данное состояние не всегда обязательно связано непосредственно с патологией как таковой. У части пациентов, обращающихся к дерматологам с симптомами «хрупкой» кожи, имеются дерматологические заболевания (экзема, псориаз, атопический дерматит и др.), при которых «хрупкость» кожи является одним из проявлений заболевания наряду с патогномоничными симптомами. Частота встречаемости симптомов «хрупкой» кожи у возрастных пациентов в глобальном масштабе составляет более 50% независимо от фототипа кожи, при этом ксероз кожи отмечается у всех людей старшей возрастной категории (возраст старше 60 лет) [4–6].
У пациентов старшей возрастной группы физиологический ксероз кожи обусловлен структурными и качественными изменениями в эпидермисе и дерме, «хрупкость» – снижением активности иммунной системы в эпидермисе [7]. С течением времени все слои кожи постепенно истончаются, что связано со снижением скорости обновления кератиноцитов. Общая потеря толщины кожи и подкожного жирового слоя, повышенная ломкость капилляров приводят к уменьшению амортизационной функции, развитию сосудистых (экхимозов) и трофических нарушений [8]. Снижение скорости обновления эпидермиса также замедляет репаративные процессы и скорость заживления после любой травматизации [9].
Кроме того, поскольку витамин D вырабатывается в коже, уменьшение ее толщины приводит к снижению способности его продукции у пожилых людей, что способствует повышенному риску развития остеопороза и переломов костей [10, 11].
В отличие от других слоев кожи толщина рогового слоя с течением времени не изменяется. Однако с возрастом размер корнеоцитов имеет тенденцию к увеличению из-за снижения скорости пролиферации, также уменьшается адгезия между корнеоцитами. Кроме того, уменьшается количество липидов и уровень гидратации рогового слоя, что способствует развитию ксероза и в ряде случаев на этом фоне зуда [12, 13] У пациентов в возрасте от 50 до 80 лет отмечается нарушение синтеза и секреции липидов, происходит нарушение процессинга. Эти изменения приводят к нарушениям эпидермального барьера, ксерозу, зуду, снижению репаративной способности [14].
В эпидермисе по мере старения кожи кератиноциты изменяют форму, уменьшаются в размере и количестве. Наблюдается снижение сцепления между дермой и эпидермисом, уменьшение степени пролиферации и обновления эпидермиса, что приводит к снижению барьерной функции кожи и ее уязвимости перед внешними факторами [15]. Кроме того, наблюдается уменьшение плотности меланоцитов на 20% каждые 10 лет, что приводит к нарушению фотозащитной системы кожи и неравномерной пигментации [16, 17]. Подобные изменение в распределении меланоцитов влияют на процессы заживления ран, делают раневые дефекты у пожилых людей более восприимчивыми к повреждению ультрафиолетовым (УФ) светом [18].
Изменения также происходят в дерме: уменьшается васкуляризация ткани, снижается число и активность фибробластов. В прямой корреляции с возрастом плотность кожи уменьшается, т.к. фибробласты вырабатывают меньше коллагена, эластиновые волокна; коллагеновые волокна становятся более дезорганизованными [13]. Данные изменения делают кожу более уязвимой к травматизациям на фоне растяжения или любой травмы.
Важную роль в формировании синдрома «хрупкой» кожи, ксероза играют внешние факторы (экспозом факторы), такие как воздействие УФ-излучения, образ жизни (например, курение, употребление алкоголя), загрязнение окружающей среды, а также хронические заболевания и гормональные изменения влияют на функциональное и структурное состояния кожи.
На долю солнечного света приходится до 80% внешних воздействий на кожу, при этом УФА-лучи выступают в качестве триггера в образовании активных форм кислорода, способствуя окислительному повреждению белков, липидов и ДНК в эпидермисе и дерме, в то время как УФВ-лучи вызывают прямое фотохимическое действие на ДНК клеток эпидермиса. Мутации, вызванные воздействием УФ-лучей, могут в конечном итоге приводить к развитию онкологических заболеваний кожи [19, 20].
Курение также ускоряет процессы старения кожи. Отмечается прямая корреляция между числом лет курения/выкуренных пачек сигарет и степенью старения кожи. У курильщиков снижена эластичность кожи и концентрация коллагена по причине подавления синтеза коллагена [21]. Подобно УФ-излучению курение также увеличивает выработку свободных радикалов и активных форм кислорода в коже, способствуя дальнейшей деградации коллагена и ослабляя структуру кожного барьера. Кроме того, курение влияет на баланс иммунной системы в коже, усиливая воспалительные и уменьшая восстановительные процессы, что замедляет заживление ран, увеличивает риск присоединения инфекций [22].
Вместе с внутренними структурными нарушениями кожи с возрастом изменения в иммунной системе также влияют на барьерную функцию, делая кожу уязвимой для внешних факторов. Иммунологическое старение, связанное со снижением функциональной активности иммунной системы, влияет на механизмы развития воспалительных реакций в коже, включая снижение числа и активности антигенпрезентирующих клеток Лангерганса [23, 24]. Такое снижение иммунного ответа приводит к нарушению защитной функции кожи, вместе со структурными изменениями способствует замедленному заживлению ран и повышенной чувствительности кожи, приводит к формированию зуда [9, 25]. Возникающие в результате подобных изменений патологические изменения еще больше нарушают барьерную функцию кожи, способствуя формированию синдрома «хрупкой» кожи и зуда [26–28].
В то же время пациенты старшей возрастной группы чаще принимают различные лекарственные препараты по поводу соматических патологий и онкологических заболеваний. При этом данные факторы, которые напрямую могут влиять на состояние кожного барьера и формирование ксероза и синдрома «хрупкой» кожи, часто недооцениваются дерматологами [29, 30]. Ряд препаратов способствует снижению содержания липидов в роговом слое, уменьшению гидратации кожи и атрофии потовых желез, что приводит к формированию ксероза и зуда. Сочетание ксероза и пренебрежение правилами правильного ухода за кожей, таких как отсутствие использования смягчающих средств, неправильное применение мыла/моющих средств или принятие горячих ванн, могут еще больше усугублять ксероз и вызывать зуд [5, 9, 15].
Следует отметить, что такие симптомы, как ксероз и зуд, отрицательно влияют на качество жизни (КЖ) пациентов, их повседневное функционирование. В связи с вышеизложенным становится очевидным необходимость использования специализированной дерматокосметики лицами старшего возраста в качестве постоянного ухода, при этом необходимо проведение исследований по изучению эффективности таких средств для пациентов данной категории.
Методы
Данное исследование являлось открытым несравнительным. Период наблюдения составил 2 недели. Под наблюдением находились 40 пациентов в возрасте от 60 до 74 лет (медиана – 67,3±2,6 года) с ксерозом кожи и зудом на его фоне. Критерии включения: возраст 60 и более лет, пациенты с зудом кожи на фоне ксероза, подписание информированного согласия. Критерии исключения: зуд, спровоцированный кожным заболеванием, проводимая терапия препаратами системного действия: кортикостероидами и антибактериальными препаратами; необходимость лечения каким-либо другим препаратом для наружного применения (глюкокортикостероиды, антибактериальные препараты, антисептики), пациенты, имеющие непереносимость хотя бы одного из компонентов, входящих в состав препарата.
Среди сопутствующей патологии (само заболевание или его лечение), способствующей формированию ксероза, преобладали кардиоваскулярные заболевания (гипертоническая болезнь) – у 23 пациентов (57,5%), патологии желудочно-кишечного тракта диагностировались – у 17 пациентов (42,5%), сахарный диабет – у 14 пациентов (35%), ожирение – у 8 пациентов (20%), заболевания щитовидной железы – у 8 пациентов (20%) (табл. 1).
В течение 2 недель все пациенты наносили на кожу крем Неотанин Комфорт Плюс 1–2 раза в сутки, а также в течение дня по мере необходимости. Активные компоненты Неотанина Комфорт Плюс: натуральные масла (подсолнечника, сои и карите) восстанавливают защитные функции кожи, питают кожу, делают более гладкой и эластичной; полидоканол купирует зуд; мочевина (компонент натурального увлажняющего фактора кожи) удерживает влагу в коже, предохраняет ее от пересыхания, поддерживает баланс микробиома кожи; экстракты (алоэ вера, ромашки и календулы) устраняют покраснение, раздражение, тонизируют и успокаивают кожу; витамин Е оказывает антиоксидантное действие. Полидоканол как противозудное и местноанестезирующее средство входит в Европейское руководство по хроническому зуду (2012), Рекомендации Ассоциации научных медицинских обществ в Германии (AWMF) по диагностике и лечению атопического дерматита (2016), Рекомендации Европейского дерматологического форума (EDF) по лечению атопической экземы/атопического дерматита (2018) [31–33]. За счет входящих в состав Неотанина Комфорт Плюс увлажняющих компонентов и активного противозудного компонента препарат позволяет решать две основные проблемы: устраняет зуд и повышает увлажненность кожи.
Оценку эффективности применения крема Неотанин Комфорт Плюс проводили на основании объективных данных: корнеометрии, трансэпидермальной потери воды – ТЭПВ (спина, голени), рН кожи, а также динамики индекса зуда (ВАШ – визуально-аналоговая шкала боли), динамики оценки зуда по 5D-шкале Elman, динамике анкеты оценки КЖ через 2 недели по сравнению с показателями до терапии. Базы данных пациентов формировались с помощью электронных таблиц Excel MS Office Excel, 2010. Статистическая обработка полученных данных проводилась с использованием статистической программы Statistica 10.
Результаты
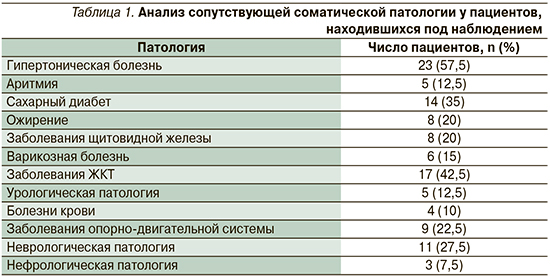
Увлажненность кожи измеряли методом корнеометрии по содержанию воды в роговом слое эпидермиса. Данная методика основана на измерении электрической емкости кожи, по которой можно косвенно судить о содержании в ней воды. За основной параметр корнеометрии принимается диэлектрическая емкость самой воды, равная 81. До терапии показатель корнеометрии в среднем составил для локализации спины 51,2±3,7 ЕД, после применения крема Неотанин Комфорт плюс показатель увеличился на 16,6% и составил 61,4±2,9 ЕД (р<0,05, рис. 1). Показатель при измерении в локализации голени до терапии соответствовал еще более низкому уровню – 46,3±2,1 ЕД, через 2 недели показатель увеличился на 12,3% и составил – 52,8±1,8 ЕД (р<0,05, рис. 1).
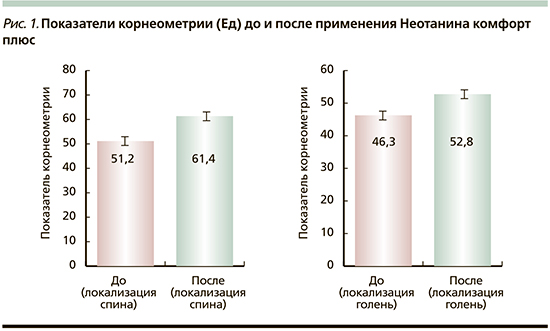
Показатель ТЭПВ также значимо улучшился после применения крема Неотанин комфорт плюс (рис. 2). ТЭПВ до применения крема Неотанин Комфорт плюс в локализации спина составил 17,9±0,5 и 15,4 ± 0,3 г/м2/ч через 2 недели (снижение на 13,8% при р<0,001), в локализации голень -16,8±0,3 и 15,1±0,4 г/м2/ч через 2 недели (снижение на 10,1% при р<0,001, рис. 2). Также отмечалась тенденция к положительной динамике полученных данных рН-метрии, а именно понижение рН кожи: локализация спины – с 6,11±0,15 до 5,99±0,29, локализация голени – с 6,42±0,26 до 6,08±0,14 ЕД.
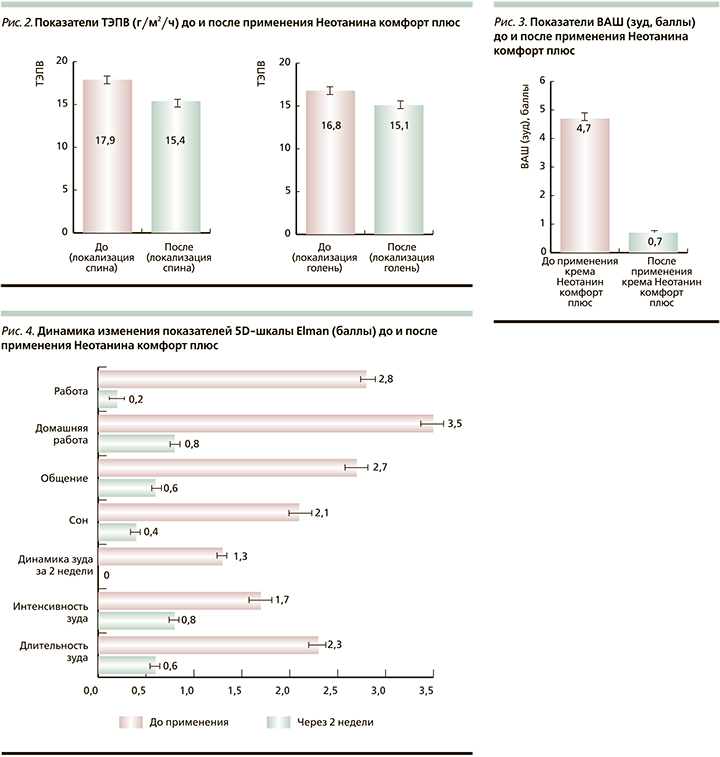
Положительная динамика показателей увлажненности и ТЭПВ сопровождалась купированием зуда у пациентов, при этом следует отметить, что снижение или полный контроль зуда отмечались с первых суток применения крема. В ряде случаев при возникновении зуда в течение дня пациенты использовали крем Неотанин Комфорт плюс по мере необходимости. Показатель ВАШ (зуд) снизился на 85,1% – с 4,7±0,6 до 0,7±0,4 балла (р<0,02, рис. 3).
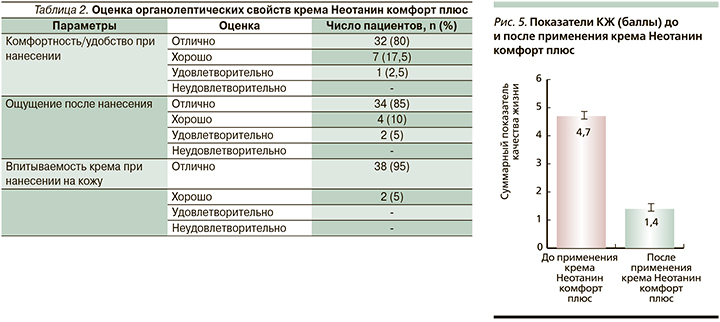
5D-шкала Elman [37] включает следующие показатели: длительность зуда в течение дня (максимально 5 баллов), интенсивность зуда (максимально 5 баллов), динамика зуда в течение 2 недель (0 баллов – зуда нет), влияние на КЖ (сон, домашняя работа, работа: максимально 5 баллов для каждого показателя, показатель общение/досуг – максимально 6 баллов). Также по шкале оценивалось число локализаций зуда (16 частей тела). В результате применения крема Неотанин Комфорт плюс отмечалась положительная динамика по всем показателям 5D-шкалы Elman (рис. 4). При этом число локализаций зуда с исходного среднего показателя 5,7±1,4 снизилось до 0,6±0,2 (р<0,01). В работе проводилась оценка влияния применения крема Неотанин Комфорт Плюс на КЖ пациентов с учетом следующих параметров: частота возникновения зуда, влияние на повседневную деятельность, неуверенность, сон и настроение по 5-балльной системе, где 0 – совсем не повлиял, 1 – немного повлиял, 2 – достаточно сильно повлиял, 3 – сильно повлиял, 4 – очень сильно повлиял. До применения крема суммарный индекс КЖ составил 12,1±2,3 балла, через 2 недели – 2,7±1,4 балла (снижение на 77,6%) (рис. 5). Таким образом, купирование таких симптомов, как зуд и ксероз, приводит к улучшению их повседневной активности, ночного сна, что значимо в повышении КЖ пациентов данной категории.
Все пациенты отметили отличные или хорошие органолептические свойства крема и комфортность его применения (табл. 2). Так, 97,5% пациентов оценили комфортность/удобство при нанесении как отличное или хорошее, 95% пациентов отметили отличное/ хорошее ощущение после нанесения крема, 95% – отличную впитываемость крема.
Обсуждение
Уход за кожей играет ключевую роль в поддержании барьерных функций кожи, профилактике развития ксероза и зуда у пожилых людей. Восстановление барьерной функции кожи приводит к купированию зуда, что положительно сказывается на повседневной активности пациентов, качестве их сна и приводит к повышению КЖ. Применение смягчающих, увлажняющих и защитных кремов рекомендуется в качестве средств для купирования зуда и ксероза кожи, а также превентивной меры для снижения степени выраженности ксероза в этой возрастной группе [34].
В этом плане актуальны вопросы формирования среди населения пожилого возраста культуры использования дерматокосметологических средств (бережное очищение, увлажнение) для профилактики и коррекции как ксероза, так и синдрома «хрупкой» кожи.
При этом крем Неотанин Комфорт Плюс может быть рекомендован пациентам с кожным зудом на фоне ксероза. Эффективность данного дерматокосметического средства доказана в исследовании по данным как объективных методов (корнеометрия, ТЭПВ), так и клинических шкал (ВАШ зуд, 5D-шкала Elman, показатели КЖ).
Выводы
Важным выводом данного исследования можно считать выраженное положительное влияние на КЖ пожилых пациентов, которое прежде всего базируется на улучшении ночного сна, повышении активности и сказывается на общении, их повседневном функционировании.



