Введение
Давно признано, что скорость старения кожи определяется внутренними и внешними факторами, но только недавние достижения в геронтологии кожи помогли проанализировать молекулярные и клеточные процессы, лежащие в основе ее старения [1–3]. Некоторые из процессов старения запускаются или усиливаются присутствием поврежденных молекул и органелл внутри клеток, и их обмен частично контролируется аутофагией. Помимо протеостаза и поддержания органелл другие факторы, которые считаются признаком старения, такие как чувствительность к питательным веществам и нестабильность генома, находятся под контролем или вызывают активацию аутофагии, что делает ее основным противодействием старению.
Аутофагия – это процесс клеточного самопереваривания путем доставки цитоплазматического материала в лизосому для расщепления. Механистически можно выделить три пути аутофагии: макроаутофагию, микроаутофагию и аутофагию, опосредованных шаперонами.
Макроаутофагия контролируется белками, связанными с аутофагией (ATG), и зависит от секвестрации материала внутри двухмембранных пузырьков (аутофагосом) в цитоплазме. Аутофагосомы сливаются с лизосомами, образуя аутофаголизосомы, в которых груз расщепляется лизосомальными ферментами. Продукты распада высвобождаются из лизосом и впоследствии используются для анаболических процессов или производства энергии.
Микроаутофагия характеризуется инвагинацией лизосомальной мембраны у дрожжей. Опосредованная шапероном аутофагия зависит от цитозольного шаперона hsc70 для нацеливания субстрата на лизосому. Белки, которые содержат мотив консенсусного пентапептида, связываются с hsc70, разворачиваются и перемещаются в просвет лизосом лизосом-ассоциированным мембранным белком типа 2A (LAMP2A) [4].
Старение кожи на уровне тканей
Кожа представляет собой сложный орган, состоящий из слоя подкожной жировой ткани, мезенхимальной дермы и самого наружного эпителиального слоя – эпидермиса (рис. 1). Кроме того, имеются кожные придатки, т.е. волосы, сальные железы, потовые железы и ногти, которые образуются в результате дифференцировки эпителиальных клеток в сотрудничестве с мезенхимальными клетками. Эти кожные придатки закреплены в основном в дерме [5].
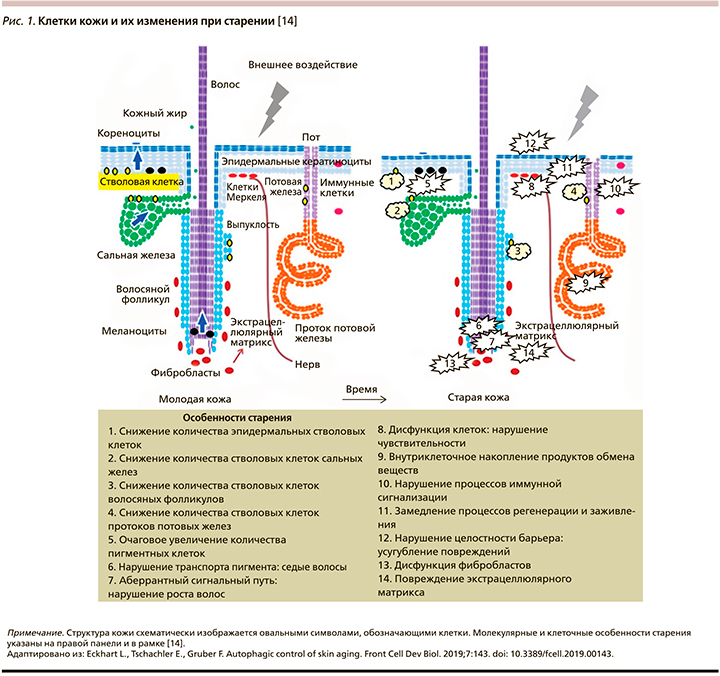
Подкожная жировая ткань функционирует как изоляция от колебаний температуры и как хранилище энергии и состоит в основном из долек адипоцитов, окруженных решеткой из коллагеновых перегородок и кровеносных сосудов. Она обеспечивает связь кожи с подлежащими мышцами и фасциями. Дерма состоит в основном из внеклеточного матрикса (ВКМ) с коллагеном, эластином и гликозаминогликанами в качестве основных компонентов. Все они продуцируются фибробластами – наиболее распространенным типом клеток в дерме. Дермальный ВКМ обеспечивает коже как сильное механическое сопротивление, так и эластичность [6]. В дерму встроены сети кровеносных и лимфатических сосудов, которые снабжают кожу кислородом и питательными веществами, регулируют температуру тела и служат магистралями для переноса иммунных клеток. Обширная сеть кожных нервных окончаний достигает эпидермиса и передает сенсорные ощущения, такие как температура, прикосновение, боль и зуд, в центральную нервную систему [7]. В дополнение к сложности этой ткани она содержит множество резидентных иммунных клеток, включая тучные клетки, тканевые макрофаги и профессиональные антигенпрезентирующие клетки.
Прикрепленный к дерме специализированными белками базальной мембраны эпидермис образует наружный слой кожи. Это многослойный эпителий, состоящий в основном (95% всех клеток эпидермиса) из кератиноцитов, которые подвергаются терминальной дифференцировке и образуют роговой слой, служащий предельным барьером от окружающей среды. Помимо кератиноцитов в эпидермисе присутствуют регулярно диспергированные клетки Лангерганса – наиболее отдаленные антигенпрезентирующие клетки иммунной системы, и меланоциты, которые продуцируют УФ-защитный меланин и передают его соседним кератиноцитам, тем самым определяя также цвет кожи и волос [8].
В отличие от внутренних органов признаки старения кожи сразу распознаются даже не имеющими медицинского образования наблюдателями. Наиболее очевидными являются мимические морщины, которые служат следствием активности основных мышц во время мимики, ослабления тканей в результате потери эластиновых и коллагеновых волокон. Ослабление тканей проявляется потерей овала лица и опущением верхних век. Нарушение пигментации кожи, подверженной воздействию солнечных лучей, также является признаком ее старения [9].
При анализе старения кожи необходимо учитывать, что помимо внутреннего старения, которое протекает во всех органах и определяется генетически, старение кожи также сильно модифицируется внешними факторами, такими как хроническое пребывание на солнце и образ жизни, в частности курение [9].
Внутреннее старение характеризуется прежде всего прогрессирующей потерей кожной ткани, т.е. истончением всех слоев кожи. Подкожный жировой слой уменьшается с возрастом, как и компоненты дермального ВКМ. Функционально потеря жировой ткани приводит к повышенной чувствительности как к высокой, так и к низкой температуре, тогда как потеря дермального ВКМ делает кожу более хрупкой и подверженной ранениям. В эпидермисе снижается оборот кератиноцитов, что приводит к его истончению и снижению способности быстро восстанавливать кожный барьер после его нарушения. Что касается придатков кожи, то волосы становятся тоньше, а терминальные волосяные фолликулы на скальпе постепенно миниатюризируются. Естественный цвет волос теряется из-за снижения переноса пигмента от фолликулярных меланоцитов к кератиноцитам волос и воздушных включений в стержень волоса [10].
Выработка кожного сала с возрастом уменьшается, особенно у женщин после менопаузы. Точно также с возрастом уменьшается и секреция пота. Кроме того, распространенной проблемой пожилых людей является хронический зуд. По-видимому, происходит возрастное преобразование ощущения прикосновения в ощущение зуда из-за потери или дефектов клеток Меркеля [11].
В отличие от естественного или хронологического старения фотостарение касается только участков тела, которые хронически подвергаются воздействию солнечного света или искусственных источников ультрафиолетового (УФ) излучения [12]. Разницу между естественным и фотостарением легче всего наблюдать у конкретного человека при сравнении участков кожи, подвергшихся воздействию УФ-излучения, таких как внешняя часть предплечья, с участками, не подвергавшимися воздействию, такими как внутренняя поверхность плеча. В то время как естественное старение характеризуется потерей ВКМ, фотостареющая кожа содержит массу эластиновых и коллагеновых волокон, однако они расположены не так, как в защищенной от УФ коже, а фрагментированы и дезорганизованы из-за действия УФ-индуцированных протеаз. Фактически появление фотостарения кожи сравнивают с рубцовой тканью. Кроме того, фотостареющая кожа имеет очень отчетливые нарушения пигментации, называемые пигментными пятнами, а на гистологическом уровне инфильтратами иммунных клеток, включая тучные, что приводит к субклиническому хроническому воспалению. На молекулярном уровне мутации с УФ-сигнатурой могут быть обнаружены в основном в кератиноцитах и меланоцитах задолго до того, как они станут клинически значимыми, вызывая актинический кератоз, базальноклеточную карциному или меланому [13].
Старение кожи на клеточном уровне: стволовые, короткоживущие эпителиальные и долгоживущие дифференцированные клетки
Старение – сложное явление, которое включает множество изменений на системном уровне, а также критические изменения на уровне изолированных системных компонентов, таких как ДНК, клетки и ткани. Здесь мы выдвигаем гипотезу, согласно которой факторы старения по-разному опосредуют свое воздействие на различные типы клеток в коже и, возможно, других тканях. Мы предлагаем выделить три категории клеток, которые по-разному изменяются при старении (рис. 2). Мы предполагаем, что старение кожи обусловлено изменениями в отдельных типах клеток кожи, которые мы классифицируем в соответствии с продолжительностью жизни (обратно коррелирует с обновлением) и дифференцировкой (выполнение специфической функции в контексте ткани). Основные роли аутофагии и связанных со старением изменений суммированы для каждой категории клеток [14].

Во-первых, стволовые клетки имеют длительный срок жизни и относительно низкую метаболическую активность. Внутри эпидермиса стволовые клетки сами по себе не вносят прямого вклада в эпидермальный барьер, но они дают начало дифференцирующимся дочерним клеткам, выполняющим эту функцию. Снижение числа и активности стволовых клеток является одновременно движущей силой и маркером старения кожи. Следует отметить, что эпителиальные структуры с высоким клеточным оборотом, такие как эпидермальные кератиноциты, сильно зависят от стволовых клеток во время гомеостаза, тогда как другие участки кожи нуждаются в стволовых клетках преимущественно или только во время заживления ран [14].
Во-вторых, есть типы клеток, которые дифференцируются и быстро обновляются, когда выполняют свою функцию. Метаболическая активность этих клеток весьма высока. Примером этой категории служат эпителиальные клетки межфолликулярного эпидермиса, сальных желез, волосяных фолликулов и протока потовой железы. Поддержание функции этих дифференцирующихся клеток требует их непрерывного образования из стволовых клеток.
В-третьих, дифференцированные клетки кожи с различной историей развития выполняют специфические функции в течение длительных периодов времени или даже в течение всей жизни организма. Как правило, эти клетки обладают значительной метаболической активностью в течение длительного времени. Примером этой категории клеток являются нейроны, меланоциты, клетки Меркеля, секреторные клетки потовых желез и фибробласты [14].
Старение кожи на клеточном уровне: дифференциальная роль аутофагии в трех категориях клеток
Кожа дает несколько примеров, иллюстрирующих два основных взаимодействия между аутофагией и старением: 1) аутофагия снижает скорость старения, 2) активность аутофагии снижается во время старения. Аутофагия подавляет старение клеточно-автономным образом, поддерживая внутриклеточный гомеостаз, и неавтономным образом, способствуя различным функциям клеток, которые защищают другие клетки. Например, аутофагия поддерживает дифференцировку эпителиальных клеток, что позволяет им защищать другие клетки от внешних воздействий [15].
Поскольку аутофагия обеспечивает удаление и рециркуляцию внутриклеточного материала только до определенной степени, потенциальные токсичные клеточные компоненты и дисфункциональные лизосомы имеют тенденцию накапливаться в течение жизни клеток. Некоторые из скомпрометированных клеток погибают, тогда как другие остаются живыми, но теряют способность осуществлять внутриклеточные процессы, включая аутофагию, с полной эффективностью. Потеря и дисфункция клеток проявляются в преждевременном старении, обострении акне и розацеа.
В гомеостазе и реакции клеток кожи на стресс аутофагия играет различные роли, которые мы обсудили выше. Совсем недавно было описано значение аутофагии для иммунных клеток кожи [16].
Согласно приведенной выше классификации клеток кожи, аутофагия имеет различную чувствительность к процессам, связанным со старением, и играет разные роли в процессах, ускоряющих старение кожи (рис. 2).
1) Долгоживущие и в основном покоящиеся стволовые клетки нуждаются в аутофагии для поддержания внутриклеточного гомеостаза и постоянной способности поставлять функциональные дочерние клетки. Врожденное снижение или экзогенное подавление аутофагии приводит к потере стволовых клеток в результате конкуренции, дифференцировки или гибели клеток [17].
2) В короткоживущих дифференцирующихся клетках аутофагия также способствует поддержанию внутриклеточного гомеостаза, однако ее активность должна поддерживаться лишь в течение короткого времени, пока эти клетки функционируют. В таких клетках внешние и внутренние факторы имеют мало времени для нарушения аутофагии, следовательно, ее снижение, связанное со старением, менее значимо. Тем не менее дефекты аутофагии могут наследоваться от долгоживущих клеток-предшественниц (стволовых клеток) и потенциально нарушать такие процессы, как защита от микробов, высвобождение цитокинов и, что наиболее важно, защита от стрессовых факторов окружающей среды (3). В долгоживущих дифференцированных клетках аутофагия способствует поддержанию выживания и функционирования. Ее снижение приводит к накоплению поврежденных или даже токсичных компонентов и/или энергетическому кризису. Нарушения внутриклеточного гомеостаза препятствуют нормальному протеканию клеточных функций, в конечном итоге приводят к гибели клеток (рис. 3) [14].
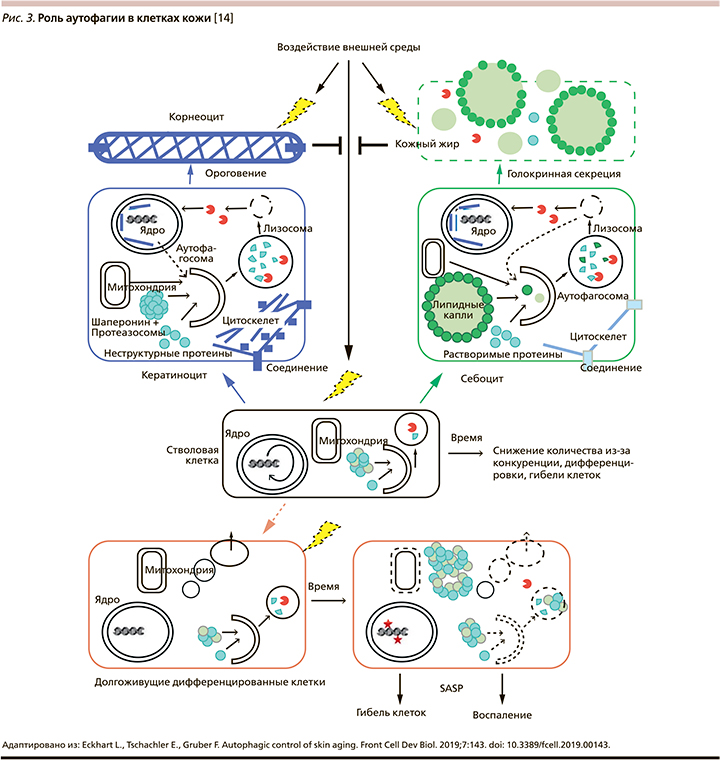
На рис. 3 схематически показан вклад аутофагии в ороговение, голокриновую секрецию, гомеостаз стволовых клеток и долгоживущих дифференцированных клеток (на примере секреторной клетки потовых желез). Зависящие от времени изменения, такие как снижение аутофагии, затрагивают главным образом стволовые и долгоживущие дифференцированные клетки. Короткоживущие кератиноциты и себоциты непрерывно генерируются из стволовых клеток. Аутофагия способствует образованию корнеоцитов и кожного сала, которые защищают живые клетки кожи от стрессовых факторов окружающей среды. Преобразование стволовых клеток в (короткоживущие) дифференцирующиеся кератиноциты и себоциты происходит на протяжении всей жизни, в то время как превращение стволовых клеток в долгоживущие дифференцированные секреторные клетки во взрослой жизни происходит редко [14]. Важно отметить, что процесс старения в настоящее время до конца не изучен и несколько новых концепций факторов старения еще не исследованы на предмет их потенциального взаимодействия с аутофагией. Например, конкуренция стволовых клеток за прикрепление к базальной мембране в зависимости от протеолитического снижения COL17A стала новым важным процессом, способствующим старению эпителия кожи. Еще одним новым механизмом, влияющим на старение, является иммунный надзор за стареющими клетками [18]. Потенциальная роль аутофагии в протеолизе и процессинге антигенов во время вышеупомянутого процесса будет интересной темой будущих исследований.
Аутофагия в различных типах клеток кожи
Неэпителиальные клетки кожи – это в основном долгоживущие и дифференцированные, т.е. клетки категории 3 в отношении аутофагии и старения кожи, как определено в предыдущих разделах данной статьи. Среди неэпителиальных клеток кожи также встречаются стволовые клетки (категория 1), но основной причиной старения считаются изменения в долгоживущих дифференцированных клетках. Эпителиальные клетки кожи включают лишь количественно незначительную часть долгоживущих дифференцированных клеток (категория 3), таких как клетки Меркеля и секреторные клетки потовых желез, тогда как основная часть эпителиальных клеток относится к короткоживущим дифференцирующимся клеткам (категория 2), таким как кератиноциты межфолликулярного эпидермиса, кератиноциты волосяных фолликулов, себоциты и клетки потовых протоков. Пополнение дифференцирующихся эпителиальных клеток сильно зависит от эпителиальных стволовых клеток (категория 1) (рис. 2).
Аутофагия в эпителиальных клетках кожи
Кератиноциты являются основным типом клеток эпидермиса, где они составляют более 95% от общей клеточной популяции и автономно образуют многослойный эпителий. Стволовые клетки кератиноцитов находятся в базальном слое эпидермиса и в особых местах придатков эпидермиса, таких как выпуклости волосяных фолликулов и протоки потовых желез (рис. 1). Пролиферирующие кератиноциты, т.н. транзиторные амплифицирующие клетки, нуждаются в прикреплении к базальной мембране, следовательно, также ограничены базальным слоем. При отделении от базальной мембраны кератиноциты активируют генетически контролируемую программу терминальной дифференцировки, которая приводит к усилению цитоскелета по мере продвижения клеток к поверхности эпидермиса, а в конечном итоге – к ороговению [8]. Из-за быстрого оборота кератиноцитов старение эпидермиса проявляется главным образом в изменении числа и функции стволовых клеток. Кроме того, изменения в структуре эпидермиса и реакции на стресс снижают функцию эпидермиса в качестве защиты от провоцирующих старение факторов стресса [19].
Существует множество внешних факторов старения, включая УФ-облучение, воздействие токсинов из окружающей среды и нарушение барьера низкой влажностью моющими средствами и микроорганизмами.
Внутренними факторами старения являются истощение стволовых клеток, окислительный стресс из-за митохондриальной дисфункции и другие факторы. Аутофагия кератиноцитов подавляется у носителей мутации AP1S3, что приводит к накоплению p62/секвестосомы-1 (Sqstm1) и воспалению [20].
Аутофагия активна как в пролиферирующих, так и в дифференцирующихся кератиноцитах эпидермиса человека и мыши. Запрограммированная деградация ядра и митохондрий во время ороговения напоминает аутофагию. И действительно, существуют соответствующие доказательства роли механизма аутофагии в деградации органелл в зернистом слое эпидермиса. Специфическая для кератиноцитов делеция Atg5 и Atg7 у мышей приводила к утолщению рогового слоя, но не блокировала удаление ядра в ороговевающих кератиноцитах [21].
Аутофагия в неэпителиальных клетках кожи
Помимо количественно преобладающих эпителиальных клеток в коже находится набор других клеток, отличающихся развитием и функциональностью, включая меланоциты, фибробласты, клетки Лангерганса, клетки Шванна и нейроны. Эти клетки имеют общий низкий оборот и длительный срок жизни, что предрасполагает их к негативным эффектам снижения аутофагии в ходе старения (рис. 2).
Меланоциты являются наиболее изученными неэпителиальными клетками кожи в отношении роли аутофагии. Аутофагия в фибробластах, нервных, эндотелиальных и иммунных клетках изучалась главным образом в других органах, кроме кожи, а также in vitro.
Аутофагия в меланоцитах
Меланоциты кожи вырабатывают меланин и доставляют его к соседним кератиноцитам, которые находятся либо в волосяных фолликулах, определяя цвет волос, либо в межфолликулярном эпидермисе, определяя цвет кожи. Старение связано с изменением цвета волос, бледностью и появлением возрастных пятен (старческое лентиго), что указывает на изменение функции меланоцитов с возрастом [22]. Наиболее важным следствием дисфункции меланоцитов при старении является поседение волос. Фолликулярные меланоциты, которые снабжают волосы пигментом, реагируют на сигналы цикла роста волос, а их возрастное истощение и изменение формы вместе с усилением окислительно-восстановительного стресса причастны к возрастной дисфункции волос [23].
Заболеваемость раком, происходящая из меланоцитов, обычно коррелирует с увеличением возраста, однако злокачественная меланома относительно часто встречается и у молодых людей. Невусы, широко известные как родинки, демонстрируют возрастные изменения формы и внешнего вида. Непролиферирующие меланоциты в невусах имеют признаки клеточного старения, тем не менее треть меланом происходит из невусов. Текущие модели предполагают, что активность сигнального пути mTOR, связанная с контролем аутофагии, играет роль в механизме, с помощью которого преодолевается старческая остановка роста. Как показывают недавние исследования меланоцитов, аутофагия может влиять на возрастные изменения в меланогенезе, на перенос меланосом, гибель и контроль окислительно-восстановительного стресса меланоцитов, скорость их пролиферации и старения, и на воспалительную сигнализацию [24].
Аутофагия в дермальных фибробластах
Фибробласты дермы человека являются долгоживущими клетками и поэтому склонны к накоплению внутренних и внешних повреждений. Дермальные фибробласты не представляют единообразной популяции, поскольку они могут принимать как минимум два фенотипа – папиллярный и ретикулярный. Фенотипическая пластичность фибробластов, вероятно, зависит от микроокружения, в котором ВКМ претерпевает возрастные изменения. При старении кожи баланс между этими двумя типами фибробластов смещается в сторону фенотипа ретикулярной линии [25].
Изменения активности аутофагии в фибробластах связаны со старением. Недавние результаты, обсуждаемые ниже, позволяют предположить, что аутофагия и ее возрастная дисфункция могут влиять на микроокружение при хронологическом и УФ-индуцированном старении, а также при фенотипах преждевременного старения [26].
Патогенетическое обоснование применения экспериментального препарата, регулирующего аутофагию, в протоколах эстетических программ
Резюмирая вышеперечисленное, можно сделать вывод: дисрегуляция аутофагии приводит к нарушению гомеостаза, как следствие – к процессу старения, что в коже проявляется истончением, появлением морщин, птозом, дисхромиями, куперозом и т.д. Аутофагия в коже регулирует функцию ключевых структур:
- выступает механизмом регуляции терминальной дифференцировки кератиноцитов и гомеостаза эпидермиса в целом;
- участвует в поддержании гомеостаза дермы в условиях повреждения и стресса через восстановление клеточных механизмов жизнедеятельности;
- регулирует метаболизм ВКМ через модуляцию активности матриксных металлопротеиназ;
- играет ключевую роль в меланогенезе;
- удаляет «клеточный мусор» и является способом детоксикации кожи.
Нормализация уровней аутофагии способствует поддержанию гомеостаза организма в целом и кожи в частности, увеличению продолжительности и улучшению качества жизни.
Использование веществ, регулирующих аутофагию, является перспективным методом anti-age медицины. Недавно появился абсолютно новый уникальный экспериментальный препарат, который является регулятором аутофагии – важнейшего механизма выживания клетки, позволяющего удалять свободные радикалы, токсины, продукты воспаления, дефектные белки и поврежденные органеллы.
Клинический случай
Пациентка Б. 32 лет обратилась в отделение дерматовенерологии и косметологии ФГБУ «Поликлиника № 1» УДП РФ с жалобами на единичные высыпания, купероз. Ранее наблюдалась у дерматологов в других медицинских учреждениях по поводу розацеа, получала лечение средствами лечебной косметики, топическую терапию (препараты адапалена, бензоил пероксида, азелаиновой кислоты), терапию комбинированными оральными контрацептивами (КОК) в течение 6 месяцев без выраженного эффекта со стороны кожи.
Объективно на момент осмотра кожный процесс на лице представлен единичными папулами до 5 мм в диаметре, закрытыми и открытыми комедонами, застойными послевоспалительными пятнами и расширенными сосудами в области крыльев носа и щек.
Пациентка была обследована: общий анализ крови, глюкоза крови, половые гормоны в пределах нормы. Также была консультирована смежными специалистами (гинеколог, эндокринолог) – патологии не выявлено. Сопутствующие хронические заболевания отрицает.
Пациентке были даны рекомендации по лечебно-охранительному режиму, назначены средства лечебной космецевтики. Также было принято решение о лечении новым экспериментальным инъекционным препаратом как первой процедуры с целью детоксикации клеток кожи и подготовки к другим инвазивным методикам.
Инъекционные процедуры проводились в канюльной технике с интервалом 4 недели, № 2.
- 1-я сессия: инъекционная процедура экспериментальным препаратом;
- 2-я сессия через 3 недели: инъекционная процедура экспериментальным препаратом.
Уже после первой процедуры препаратом отмечен выраженный клинический эффект в виде регресса практически всех папуллезных элементов на коже лица, некоторого побледнения отдельных поствоспалительных пятен и уменьшения признаков ангионевроза (рис. 4).
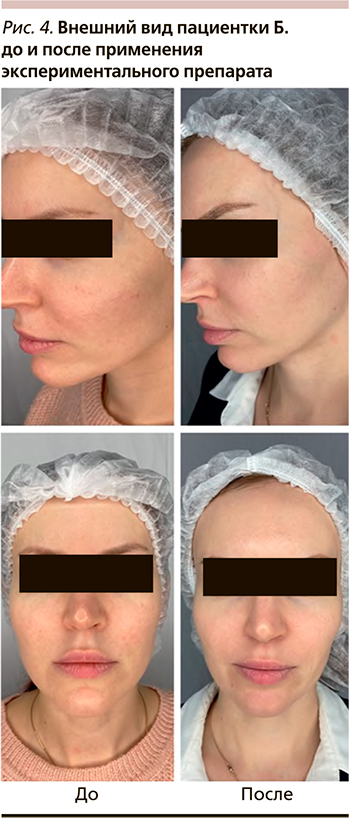
Таким образом, данный клинический случай иллюстрирует эффективность применения пациенткой нового экспериментального инъекционного препарата и является отличной процедурой выбора при первичном обращении к врачу-косметологу.
Детоксикация кожи является ключевым моментом в комплексном подходе к пациентам с розацеа и акне, что обусловлено патогенетически и клинически.
Заключение
Старение кожи представляет собой сложный процесс, который, согласно описанной выше концепции, зависит от изменений в трех категориях клеток с различной ролью аутофагии. Эпителиальные стволовые клетки нуждаются в аутофагии для поддержания гомеостаза в течение всей долгой жизни, тогда как короткоживущие дифференцирующиеся эпителиальные клетки используют аутофагию в основном для внутриклеточного ремоделирования. Долгоживущие дифференцированные клетки как эпителиального, так и неэпителиального происхождения нуждаются в аутофагии для подавления накопления вредных соединений. Мы предполагаем, что неэффективность клеточных процессов (внутренние факторы старения) и повреждающее воздействие окружающей среды (внешние факторы старения) ставят под угрозу механизм аутофагии, приводя к самоускоряющемуся снижению утилизации и рециркуляции клеточных отходов в долгоживущих клетках кожи и снижению защитных функций кожного эпителия. В совокупности зависимые и не зависимые от аутофагии процессы приводят к изменениям тканей, проявляющимся в старении кожи, признакам ангионевроза и появлению воспалительных элементов.
Современные протоколы терапии акне, розацеа и преждевременного старения должны быть основаны на последних научных патогенетических данных и включать инъекционные и аппаратные методы. Испытанный нами экспериментальный препарат определенно является процедурой выбора при подготовке к инвазивным методикам и в качестве инструмента активации аутофагии у пациентов косметологического профиля.


