Введение
Лечение туберкулеза — длительный процесс, сопровождающийся кумуляцией побочных эффектов лекарственного вещества, которые формируют нежелательные побочные реакции со стороны важнейших систем жизнеобеспечения, часто ограничивая лечение заболевания [1—3]. В ходе терапии любой формы туберкулеза регистрируются нежелательные явления: нарушение поведенческих реакций, изменения в ЭКГ и нарушения функционирования печени. Небольшие побочные эффекты встречаются часто, они управляемы и не лимитируют лечение туберкулеза. Однако некоторые неблагоприятные воздействия могут быть опасными для жизни, например нефротоксичность аминогликозидов, кардиотоксичность фторхинолонов, желудочно-кишечная токсичность этионамида или парааминосалициловой кислоты, токсичность циклосерина в отношении центральной нервной системы [4]. В связи с этим представляется актуальным оценка токсикологических свойств двух форм нового противотуберкулезного препарата из группы диарилхинолинов. Это лекарственное средство с рабочим названием «тиозонид» по химической структуре представляет собой {1R,2S+1S,2R}-1-(6-бром-2-хлорхинолил-3-ил)-4-(диметиламино)-2-(нафталин-1-ил)-1-фенилбутан-2-ол. Тиозонид обладает противотуберкулезной активностью, сравнимой в монотерапии на модели генерализованного туберкулеза у мышей с таковой у препарата 2-го ряда рифампицином. Продолжительность жизни животных при этом было выше 120 суток (максимальное время наблюдений), в контроле животные погибали в среднем на 25-й день. Показано также, что имеет место синергизм с противотуберкулезными препаратами 1-го ряда изониазидом, рифампицином и этамбутолом, приводящий к практически полному выздоровлению подопытных животных [5, 6].
Цель исследования: изучить субхроническую токсичность нового отечественного противотуберкулезного препарата из группы диарилхинолинов — тиозонида.
Методы
Субхроническую токсичность тиозонида изучали в течение 3 месяцев на беспородных собаках обоего пола массой от 13 до 18 кг на базе Института медико-биологических исследований и технологий (АНО ИМБИИТ). Животные в течение 3 месяцев получали препарат в дозе, эквивалентной ТДЧ (ТД, 100 мг в сутки, 1 капсула тиозонида), и в дозе, в 10 раз превышающей эквивалент терапевтической дозы для человека (ТДЧ) (ТДХ10, 1000 мг в сутки, 10 капсул тиозонида). Исследуемое вещество вводили внутрижелудочно ежедневно в виде водного раствора, контрольные животные получали воду [7]. Расчет дозы производили исходя из суточной ТДЧ в 400 мг. Межвидовой расчет доз для подопытных животных проводили по E.J. Freireich, предполагая суточную дозу для человека 400 мг [8].
Поскольку изучали 2 формы тиозинида (разные пары стереоизомеров), П1 и П2, было сформировано 5 групп по 3 животных в каждой: ТД-П1, ТД Х10-П1, ТД-П2, ТДХ10-П2 и контрольная группа. В эксперименте на собаках оценивали общий анализ крови, биохимические показатели (содержание белка, электролитов, активность печеночных ферментов) и состояние свертывающей системы крови (определяли уровень фибриногена, активированного частичного тромбопластинового времени и тромбинового времени). Все указанные гематологические и биохимические маркеры изучались в пробах крови, полученных до начала эксперимента, через месяц от начала и по окончании эксперимента, через 3 месяца от его начала. После окончания эксперимента животных умерщвляли с помощью передозировки наркоза, вскрытие производили сразу после их гибели по полной патологоанатомической схеме [7].
Полученные данные подвергались статистической обработке при помощи программы STATISTICA 6.0 for Windows. Для проверки достоверности различий качественных переменных использовали критерий х2. Для проверки различий количественных показателей использовали непараметрический критерий Манна—Уитни с поправкой Бонферрони, критерий Вилкоксона. Если достигнутый уровень значимости различий не превышал 0,05, их считали достоверными [9, 10].
Результаты исследований
В экспериментах на собаках отмечено, что через 3 месяца после начала введения препарата состояние животных в целом не изменилось по сравнению с контролем. Отклонений от норм в поведенческих реакциях и внешнем виде животных выявлено не было. На сроке 1 месяц наблюдались транзиторные расстройства пищеварения с отказом от приема пищи, но они носили кратковременный и не систематический характер, не зависели от дозы препарата. Животные в течение периода наблюдения были без признаков депрессий и агрессивных состояний, активно принимали корм, воду, выпадения шерсти обнаружено не было.
Клинический анализ крови показал, что на протяжении всего эксперимента содержание эритроцитов и гемоглобина в крови подопытных животных практически не изменялось и находилось в пределах видовой физиологической нормы (табл. 1).
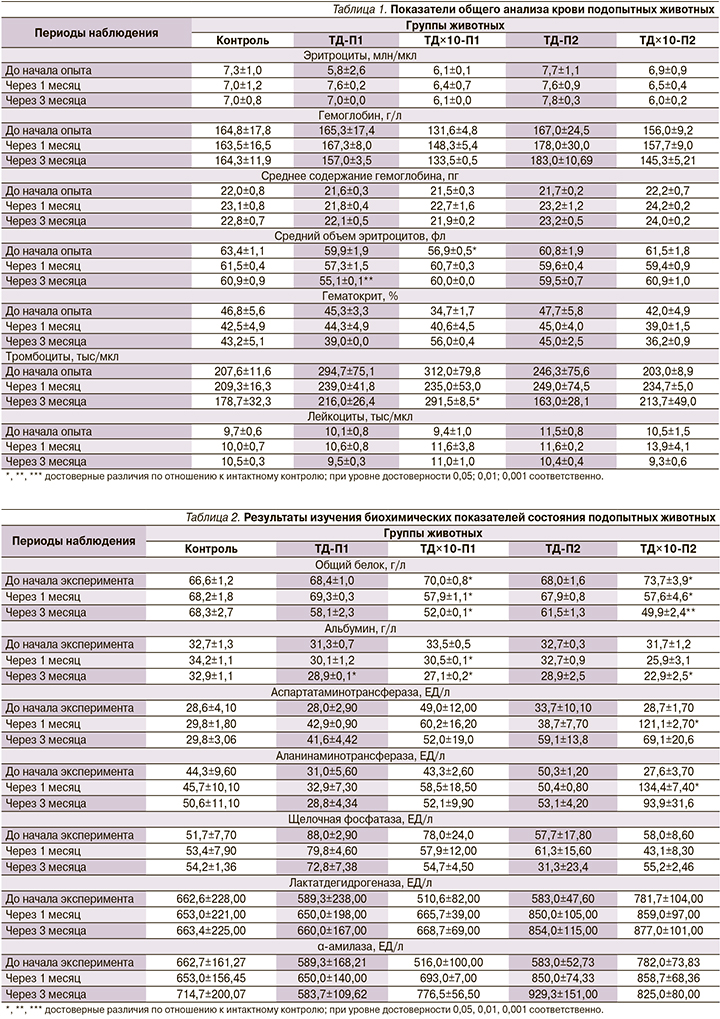
У всех собак, получавших тиозонид, происходило снижение содержания общего белка в сыворотке крови. В группах, получавших эквивалент ТДЧ, оно было незначительным, в группах, получавших препарат в дозах, превышающих ТДЧ в 10 раз, происходило снижение общего белка как по отношению к контрольным животным, так и внутри групп на протяжении всего исследования. Эти данные не коррелировали с содержанием альбумина в сыворотке крови (табл. 2).
По истечении 1 месяца после начала эксперимента наблюдалось достоверное увеличение активности аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) в группах животных, получавших препарат с 10-кратным увеличением ТДЧ (табл. 2). Активность АСТ возросла в 4 раза, АЛТ - в 4,9. К концу эксперимента активность этих трансфераз уменьшилась и стала равной: АСТ - 69,1 ЕД/л, АЛТ - 93,9 ЕД/л, что не отличалось от показателей контрольной группы животных. Активность остальных изученных трансфераз на протяжении эксперимента значимо не менялась.
После введения препарата на сроке 1 месяц наблюдалось уменьшение общего количества билирубина в сыворотке крови во всех группах собак (табл. 3).
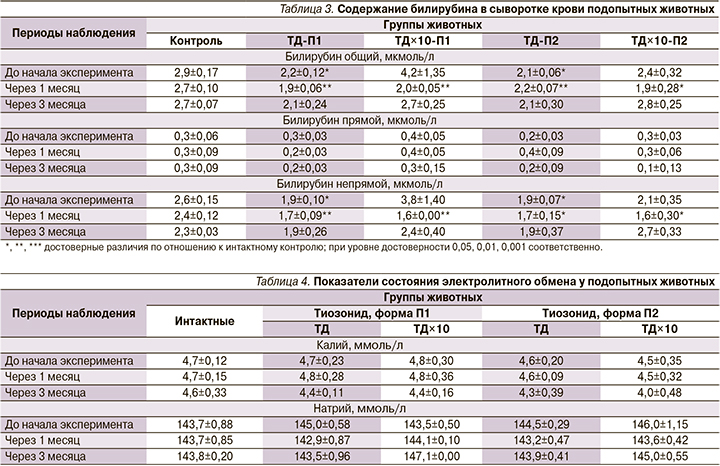
Количество общего билирубина у животных, получавших препарат в терапевтической дозе, до начала эксперимента оказалось ниже, чем в группе контроля, на 0,1 мкмоль/л и оставалось относительно постоянным до конца эксперимента. В группе, получавшей препарат с 10-кратно увеличенной дозой, через 1 месяц содержание билирубина снизилось в 1,3 раза. В дальнейшем наблюдалось повышение концентрации билирубина до значений, достоверно не отличавшихся от контроля. Снижение количества общего билирубина происходило за счет снижения непрямого билирубина в сыворотке крови собак. В динамике показателей водносолевого обмена заметных изменений не происходило (табл. 4).
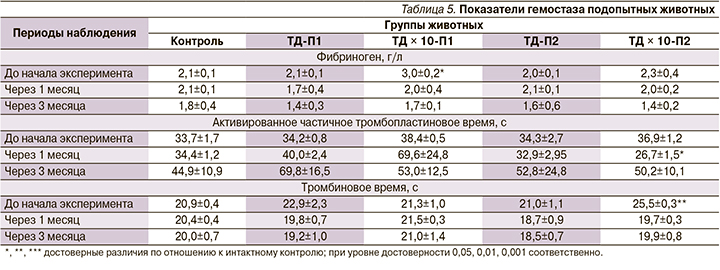
Показатели гемостаза изменялись однотипно как в опытных, так и в контрольной группах: тромбиновое время в целом не изменялось; количество фибриногена незначительно уменьшалось на протяжении исследования; активированное частичное тромбопластиновое время удлинилось к окончанию эксперимента, а в группе с десятикратной ТД значимо уменьшилось через 1 месяц введения препарата, к окончанию эксперимента удлинилось до значений, близких к группе контрольных животных (табл. 5).
При гистологическом исследовании животных, получавших ТДЧ, не было зарегистрировано выраженных изменений структуры внутренних органов. Однако в печени отмечались явления умеренной дистрофии гепатоцитов и увеличение содержания купферовских клеток. Развивались незначительные дистрофические изменения в эпителии извитых канальцев почки, умеренная гиперплазия фолликулов селезенки, а также слизистой оболочки желудка и кишечника. В слизистой оболочке желудочно-кишечного тракта отмечалось усиление лимфогистиоцитарной инфильтрации. Перечисленные изменения носили слабовыраженный характер.
При увеличении терапевтической дозы до 10 ТДЧ перечисленные выше изменения усиливались. В печени возникали не только зернистая, но и вакуольная дистрофия. Гиперплазия лимфоидных фолликулов в селезенке и в желудочно-кишечном тракте усиливалась, и увеличивалось содержание макрофагов в них. В слизистой оболочке тонкой и толстой кишки увеличивалось содержание бокаловидных клеток, продуцирующих слизь.
Обсуждение результатов
Проведенные исследования токсичности лекарственной формы препарата тиозонид свидетельствует о потенциально хорошей его переносимости и отсутствии выраженных поражений жизненно важных систем и органов в эксперименте. Собаки продемонстрировали обратимые отклонения от показателей контроля только в группах с дозой, десятикратно превышающей ТДЧ.
Заключение
Субхронический эксперимент по изучению токсичности противотуберкулезного препарата тиозонид показал транзиторные расстройства пищеварения с отказом от приема пищи, носящие кратковременный и не систематический характер, не зависящие от дозы препарата. У животных не зарегистрировано признаков изменения сердечной деятельности, нарушения ритма отсутствуют. У животных, получавших препарат в предполагаемой терапевтической дозе, значимых изменений в гематологических и биохимических показателях крови не зафиксировано. Гистологические изменения были незначительными.


