Введение
Воспалительные заболевания кишечника (ВЗК) — это хронические, рецидивирующие заболевания желудочно-кишечного тракта неясной этиологии, протекающие с периодами обострений и ремиссии. Основные представители ВЗК — язвенный колит (ЯК) и болезни Крона (БК).
Качество жизни по определению Всемирной организации здравоохранения (ВОЗ) — это восприятие людьми своего положения в жизни в зависимости от культурных особенностей и системы ценностей и в связи с их целями, ожиданиями, стандартами, заботами. Это комплексное понятие, включающее воздействие таких факторов, как физическое здоровье (жизненная активность, боль, сон и отдых), психологическое состояние (восприятие собственного тела и внешности, самооценка), независимость (подвижность, повседневная активность, работоспособность, зависимость от лекарственных препаратов), социальное отношение (личные отношения, сексуальная активность), влияние окружающей среды (финансовые ресурсы, физическая активность, возможность отдыха и развлечений) [1, 2].
Активность заболевания и качество жизни у пациентов с ВЗК
Поскольку ВЗК — это хронические заболевания, они определенно оказывают влияние на качество жизни пациентов, что в свою очередь коррелирует с активностью заболевания, с нашей точки зрения, повышая риск уровней тревоги, депрессии и стресса, а также снижения производительности труда. Поэтому улучшение качества жизни должно быть одним из направлений в лечении пациентов данной категории. В данной статье представлены факторы, влияющие на качество жизни: пол, возраст, социальный статус, уровень образования, клиническая форма ВЗК, степень тяжести течения заболевания.
Повышенная активность заболевания приводит пациентов к значимому снижению качества жизни и эмоциональному стрессу, что более распространено среди пациентов с БК по сравнению с таковыми с ЯК [3]. В другом исследовании, наоборот, не было найдено существенной разницы между клиническими формами ВЗК [4]. Кроме того, данная группа пациентов в стадии обострения с частыми рецидивами достоверно связана с депрессивными и тревожными расстройствами, снижением качества и производительности труда [5, 6], стрессом [7], наличием внекишечных проявлений [8, 9], риском недоедания в результате отказа от определенных продуктов питания во время обострения болезни [10-12]. Распространенность недоедания среди 107 пациентов с ВЗК, по данным поперечного исследования, выполненного J. Pulley et al. (2019), составила 16%. Предикторы недостаточности питания, по мнению авторов, связаны с болевым абдоминальным синдромом, активностью заболевания, повторными госпитализациями [11, 13]. Замечено, что пациенты с низким качеством жизни из-за недостаточности питания меньше потребляют клетчатку, кальций, фосфор, магний, что необходимо для минерализации костей и адекватной моторики желудочно-кишечного тракта (ЖКТ) [14].
Гендерные и возрастные особенности качества жизни у пациентов с ВЗК
В настоящее время данные о различиях в гендерном отношении противоречивы и зависят от социального положения, образа жизни, страны проживания [15]. Имеются данные, согласно которым женщины с более высоким уровнем депрессии и тревоги испытывали больше эмоциональных расстройств, связанных с заболеванием, а также имели более частые симптомы со стороны ЖКТ по сравнению с мужчинами, что приводило к низкому уровню качества жизни, связанного со здоровьем [16]. В исследовании S.C. Shah et al. (2018) обнаружили связь между возрастом развития ВЗК и половым составом заболевших. Было установлено, что женский пол имел низкий риск развития БК в детском возрасте (до 10-14 лет). Напротив, женщины в возрастном диапазоне 25-29 лет и в особенности старше 35 лет более подвержены БК по сравнению с мужчинами. При этом у мужчин старше 45 лет риск развития ЯК на 20% выше, чем у женщин [17]. Женский пол чаще подвержен психологическим расстройствам, стрессу, что прослеживается во многих исследованиях. Женщины, страдающие ВЗК, особенно БК в послеродовом периоде, подвергаются повышенному риску возникновения нового психиатрического диагноза [18]. Распространенность психических расстройств, таких как депрессия, биполярное расстройство, шизофрения, расстройства аутистического спектра, деменция, по-видимому, выше у пациентов с ВЗК по сравнению с населением в целом. В некоторых исследованиях предполагается возможная связь между расстройствами пищевого поведения, например нервной булимией, анорексией и ВЗК, однако доказательств недостаточно и требуется больше исследований для подтверждения причинноследственной связи [19]. В финском исследовании от 2013 г. авторами подмечено, что именно женщины с ВЗК чаще обращаются за медицинской помощью, а также чаще отсутствуют на рабочем месте, что указывает на высокий порог невротизации по сравнению с мужчинами [20].
Физическая активность и качество жизни у пациентов с ВЗК
На качество жизни также влияет физическая активность пациента. Многие больные отмечают ограничения и снижение регулярности физической активности в период обострения, при рецидивах, в результате чего большинство пациентов предпочитают упражнения с низкой нагрузкой, такие как ходьба [21, 22]. К тому же выявлена зависимость между астенией и физической активностью: пациенты с повышенной утомляемостью демонстрируют сниженную физическую форму и физическую активность по сравнению с пациентами без астении [23].
Качество сна у пациентов с ВЗК
Неудовлетворительное качество сна негативно влияет на повседневную активность пациентов с ВЗК. В немногочисленных проведенных исследованиях подтверждается данное положение. Нарушение качества сна коррелирует с активностью ВЗК: чем тяжелее обострение, тем сильнее пациенты испытывают расстройства сна [24]. Исследование 2020 г. показало, что у трети обследуемых пациентов с ВЗК отмечается нарушение сна, которое в свою очередь связано с низким качеством жизни, инвалидностью и внекишечными проявлениями. Кроме того, наличие депрессии в отличие от тревоги повышало частоту изменений качества сна [25, 27].
В другом исследовании авторы указывают на явное снижение качество сна при внекишечных проявлениях ВЗК, в частности при периферическом артрите. Наличие жалоб на боль в животе, в суставах, депрессивные нарушения, обнаружение повышения С-реактивного белка (СРБ), по мнению авторов, служат фактором, влияющим на качество сна [26], а также на снижение настроения и частые ночные дефекации при ВЗК [27].
Сексуальная активность у пациентов с ВЗК
ВЗК оказывают непосредственное влияние на половую жизнь и фертильность, при них возможно развитие сексуальной дисфункции (СД), что негативно влияет на качество жизни. Исследования на тему сексуального здоровья больных ВЗК немногочисленны. Действительно, у пациентов с ВЗК чаще наблюдается развитие СД по сравнению с общей популяцией [28]. Среди пациентов с ВЗК 54% женщин имеют СД, 43% мужчин — эректильную дисфункцию [28]. Предиктором развития СД и эректильной дисфункции были социальные и эмоциональные расстройства, тревога у женщин и депрессия у мужчин, но активность ВЗК не была связана с развитием СД [28]. Мужчины с ВЗК чаще прибегают к применению лекарственных препаратов по поводу эректильной дисфункции [29, 30]. В недавнем поперечном исследовании оценивалась СД у мужчин с ВЗК и у 94% из них наблюдалась эректильная дисфункция [31]. Среди женщин сексуальная активность — не менее важная составляющая качества жизни. Отмечено, что ВЗК у женщин сопряжены с трудностями в достижении оргазма и усиливают диспареунию, усиливающуюся с течением времени [34]. Следует отметить, что женский пол, возраст, утомляемость, активность заболевания и употребление стероидов связаны с увеличением неудовлетворенности своим телом, что также было вызвано снижением качества жизни [35]. В то же время прием иммуносупрессивной, генноинженерной биологической терапии не влияло на восприятие своего образа [36].
Хирургическое лечение у пациентов с ВЗК
В определенных случаях одним из способов лечения ВЗК является оперативное вмешательство с формированием стомы. Имеются противоречивые данные о качестве жизни пациентов со стомой и/или хирургическим вмешательством. Как и предполагалось, наличие стомы значимо снижает положительное восприятие своего тела, повышает сексуальную дисфункцию, уровень тревоги. По мнению многих авторов, наличие стомы служит важным фактором инвалидности [37]. В то же время в исследовании 2016 г. не было подтверждено негативное влияние стомы на качество жизни, а также ее связи с тревогой, депрессией, нарушениями сна, снижением сексуального интереса и удовлетворенности. Однако наличие стомы было ассоциировано со снижением удовлетворенности в социальной сфере у пациентов в периоды ремиссии и обострения [38]. В другом ретроспективном когортном исследовании, напротив, пациенты с ВЗК, перенесшие хирургическое вмешательство, имели более высокий уровень тревожности и депрессии, а формирование стомы представляло собой дополнительный фактор риска снижения качества жизни [39].
Ожирение у пациентов с ВЗК
Есть данные о снижении качества жизни пациентов с ожирением при ВЗК, усилении системного низкоинтенсивного воспаления при сопутствующих заболеваниях, связанных с метаболическим синдромом [40, 41]. Кроме того, ожирение увеличивает риск рецидива заболевания и связано с более высокими тревожностью, депрессией, астенией и болью, более частым обращением за медицинской помощью, а также с увеличением рисков неэффективности терапии в результате конкурентного влияния препаратов, направленных на терапию ВЗК [42].
Астенический синдром и ВЗК
Утомляемость является одним из факторов, который заметно снижает качество жизни и наблюдается практически у половины пациентов с ВЗК [43]. К сожалению, данному симптому, его диагностике и лечению не придают важного значения. Существующие исследования подтверждают связь между астенией и степенью тяжести заболевания в отличие от пациентов в ремиссии [44]. Существует предположение, согласно которому пациенты чаще предъявляли жалобы на астению при средней и тяжелой степенях заболевания [45]. В исследовании 2011 г. хроническая астения чаще, чем у здоровых людей контрольной группы, встречалась у пациентов с ЯК и БК. Клинические симптомы ВЗК, наличие желудочно-кишечных симптомов, низкие показатели гемоглобина и нарушенный режим сна являются важным предиктором хронической астении [46]. В обзорной статье Т. Grimstad et al. проанализировано 156 статей, в которых астения у лиц с ВЗК встречалась значительно чаще, чем среди населения в целом. Кроме того, утомляемость являлась основной жалобой пациентов в период обострений и коррелировала с уровнем депрессии [47].
Жалобы на астению беспокоят всех пациентов с ВЗК вне зависимости от возраста и пола, но некоторые исследования указывают на ее более частую встречаемость среди женщин. В первой работе S. Saraiva et al. показано, что обострение БК и женский пол достоверно связаны с высоким уровнем утомляемости. При этом не было обнаружено значимой корреляции между клинической формой ВЗК и лабораторными показателями, а именно гемоглобином, СРБ, уровнем ферритина.
Кроме того, пациенты, получавшие генно-инженерную биологическую терапию, имели высокий уровень утомляемости и госпитализации [48]. Вторая работа была направлена на изучение распространенности астении у лиц с ВЗК и выявление причинных факторов. Анализ показал, что высокие значения СРБ, сильная тревожность и саркопения были факторами, независимо связанными с выраженной астенией [49]. Количество обращений к врачу, отсутствие на работе и большое количество медицинских манипуляций также вызваны снижением качества жизни [50]. Кроме того, подтверждена роль активности заболевания при ВЗК. Пациенты чаще жалуются на утомляемость в период обострения в отличие от клинической и эндоскопической ремиссии [51]. Патогенетическое обоснование астении отводится активации иммунной системы, при которой наблюдается повышенная экспрессия маркеров активации Т-лимфоцитов, таких как CD26 и CD38, а также снижение функции естественных киллерных клеток [52].
Непосредственную роль в обосновании астении, развитии тревожности и депрессии отводится возможной связи между кишечником и центральной нервной системой (ось кишечник— мозг) [51]. Под влиянием психологических стрессоров происходит активация оси гипоталамус—гипофиз—надпочечники (ГГН). Кортикотропин—рилизинггормон, продуцируемый в гипоталамусе, контролируется циркулирующими провоспалительными цитокинами, особенно интерлейкином-6. Таким образом, увеличение количества провоспалительных цитокинов, наблюдаемое у пациентов с синдромом хронической астении, связано с активацией ГГН оси [52]. Другим немаловажным ключевым моментом является микробиота ЖКТ. Доказано, что психологический стресс изменяет микробиоту кишечника в сторону уменьшения количества бифидобактерий, лактобацилл и увеличения числа аэробных бактерий. Среди представителей анаэробных бактерий наибольшее значение уделяется виду Prevotella. Более того, показано, что чем выше количество аэробных энтерококков, тем тяжелее неврологические и когнитивные нарушения, включая нервозность, потерю памяти, забывчивость и спутанность сознания. Нарушение барьерной функции кишечника при синдроме хронической астении способствует бактериальной транслокации [52]. Практикующему врачу необходимо проводить дифференциальный диагноз при астеническом синдроме, т.к. существует множество причин, вызывающих утомляемость у пациентов с ВЗК (см. рисунок).
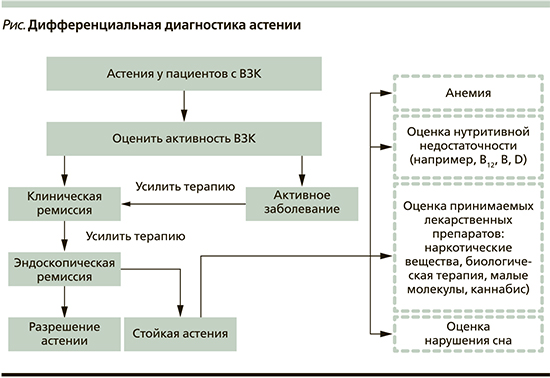
Подводя итоги, можно предположить, что, воздействуя на ось мозг-кишечник, микробиоту, барьерную функцию ЖКТ средствами коррекции микробиоты, цитопротекторами возможно снизить уровень провоспалительных цитокинов и потенциально повлиять на настроение пациента, повысить повседневную активность и тем самым увеличить качество жизни [51].
Упомянутые выше факторы риска способствуют увеличению уровня тревожности, депрессии и стресса [53]. Существует масса исследований, подтверждающих эту взаимосвязь. Тревога и депрессия считаются самыми распространенными психологическими расстройствами среди как лиц, не страдающих ВЗК, так и пациентов с ВЗК. Развитие тревоги и депрессии, по мнению многих авторов, связано с наличием хирургического анамнеза, осложнениями заболевания (включая внекишечные проявления), курением и женским полом [54]. Кроме того, у пациентов с ВЗК наблюдается высокий уровень страха и беспокойства, особенно это касается пациентов с ЯК и чаще наблюдается в группе с осложнениями и обострениями [55]. Предполагают, что тревожно-депрессивное расстройство вызвано обострением ВЗК. В исследовании 2011 г. авторы не обнаружили существенной разницы по уровню тревоги и депрессии, а также по частоте вероятного психического расстройства среди пациентов с БК и ЯК [56, 57]. Более того, многие исследования также показали, что при некачественном контроле, отсутствии лекарственной терапии тревога и депрессия провоцируют обострение ВЗК, увеличение числа госпитализаций и снижение приверженности лечению [58-60]. В целом большинство исследований указывают на значимое снижение качества жизни в результате повышения уровня тревоги и депрессии. Одна из работ включила систематический обзор 171 исследования, в которых участвовал 158 371 человек [61]. Распространенность тревожных расстройств у лиц с ВЗК составила 20,5%. Пациенты в период обострения болезни имели очень высокую распространенность тревоги: 75,6% по сравнению с ремиссией болезни. Общая распространенность депрессивных расстройств при ВЗК составила 15,2%. Распространенность депрессивных симптомов была выше при БК по сравнению с ЯК и выше при обострении по сравнению с ремиссией. Таким образом, данное исследование подчеркивает важное значение развития тревоги и депрессии, в частности, при БК, особенно в период обострения, что предполагает тщательное психологическое обследование пациентов [61]. Тревога, депрессия, астения и боль имеют важное клиническое значение для понимания причин ухудшения работоспособности и улучшения результатов работы при хронических заболеваниях [62].
Подходы к терапии
Регулярная физическая активность по праву является одним из методов воздействия на пациентов при различных хронических заболеваниях. Несомненно, ВЗК следует также рассматривать с этой точки зрения. Существуют немногочисленные исследования, подтверждающие положительное влияние физической активности на качество жизни. Показано, что физическая активность низкой и средней интенсивности может быть полезной лицам с ВЗК, повышая качество жизни, однако исследований, изучающих связь между физической активностью от умеренной до высокой и качеством жизни в этой популяции, нет [63]. Более того, активный досуг и упражнения, не вызывающие потоотделения, также были связаны с улучшением качества жизни пациентов с ВЗК [64].
Преимущества психотерапии, а именно когнитивно-поведенческой терапии, психодинамической терапии, терапии принятия и приверженности, программ управления стрессом, осознанности, гипноза в улучшении качества жизни, подтверждаются в обзорном исследовании, но необходимо проведение дальнейших качественных исследований, прежде чем психологическая терапия может быть внедрена в повседневную практику лечения ВЗК [65]. Опубликованы результаты рандомизированного контролируемого исследования, в котором использовалась терапия принятия и приверженности (Acceptance and commitment therapy - ACT). Данное психологическое вмешательство включает процедуры принятия и осознанности наряду со стратегиями принятия обязательств и изменением поведения для снижения стресса. ACT была вызвана снижением воспринимаемого стресса и депрессии, но не тревогой по сравнению с контрольными лицами. Кроме того, в ходе изучения оценивался уровень кортизола в волосах выяснилось, что концентрация кортизола коррелировала с тревогой на исходном уровне, но существенно не изменилась в группе ACT за период исследования по сравнению с контрольной группой [66].
Положительного действия, эффективности и безопасности каннабиса в достижении ремиссии больными БК и ЯК достигнуто не было, причем были широко распространены побочные эффекты в группе получающих данный препарат [67].
Недостаточное понимание патогенеза заболевания, неопределенность в отношении медикаментозной терапии, соотношения риска и пользы назначения лекарственных препаратов, недостаточное количество проведенных экспериментальных исследований и имеющиеся данные на сегодняшний день не позволяют сформулировать рекомендации по назначению терапии для данной группы больных. Хотя большинство факторов риска потенциально поддается изменению и тем самым, возможно, повышению качества жизни, но на данный момент нет подтверждающих экспериментальных работ по их доказанной эффективности.
В настоящее время дискутируется вопрос о назначении антидепрессантов с целью уменьшения тревоги и депрессии. Некоторые исследования предполагают лечение сопутствующих психологических расстройств при ВЗК с целью контроля активности заболевания. Известно, что антидепрессанты обычно используются для лечения симптомов тревоги и депрессии. Недавние исследования подразумевают взаимосвязь между активностью ВЗК и эмоциональным состоянием человека, что, возможно, повышает вероятность ухудшения качества жизни данной группы пациентов. Естественно, остается много нерешенных вопросов, что требует дальнейшего изучения (отсутствие рандомизированных исследований, небольшая выборка участников, использование различных видов препаратов), поэтому доказательства для назначения антидепрессантов неопределенные. Клинических рекомендаций и руководств по назначению антидепрессантов пациентам с ВЗК нет. Имеется очень ограниченное количество исследований, но отмечается благотворное влияние антидепрессантов на течение ВЗК некоторыми авторами [68]. В обзоре от 2006 г. проанализировано 12 нерандомизированных исследований. Антидепрессанты, о которых сообщалось в этих публикациях, включали пароксетин, бупропион, амитриптилин, фенелзин и миртазапин. В 10 статьях высказано предположение, согласно которому пароксетин, бупропион и фенелзин эффективны в лечении как психологических, так и соматических симптомов у пациентов, страдающих ВЗК. Амитриптилин признан неэффективным для лечения соматических симптомов ВЗК. Миртазапин не был рекомендован пациентам с ВЗК. В общем и целом отмечен положительный эффект лечения антидепрессантами, но отсутствие достоверных данных об их эффективности при ВЗК не позволяет рекомендовать эти препараты всем пациентам этой категории [69, 70]. Эффективность антидепрессантов также подтверждена в обзоре от 2019 г., в котором показано улучшение симптомов тревоги и депрессии по сравнению с группой плацебо, кроме того, произошло улучшение не только качества жизни, но и активности ВЗК. Однако побочных эффектов в группе, получавших антидепрессанты, зарегистрировано больше, чем в группе плацебо [71-73]. В частности, отмечены такие побочные эффекты, как тошнота, головная боль, головокружение, сонливость, сексуальные нарушения, бессонница, астения, снижение настроения и/или беспокойство, сухость во рту, мышечные спазмы и приливы. В параллельном рандомизированном двойном слепом плацебоконтролируемом исследовании больных БК использовался флуоксетин. Как оказалось, флуоксетин не оказал влияния на активность заболевания, физическое, психологическое, социальное или экологическое качество жизни, а также на тревожные или депрессивные симптомы по сравнению с плацебо, но оказал умеренное позитивное влияние на иммунную систему [73]. Доказана роль противовоспалительного эффекта антидепрессантов, что подтверждается несколькими исследованиями на крысах, например, в работах in vivo амитриптилин снижал экспрессию TLR4 (TOLL подобного рецептора 4) и pNF-B (ядерного фактора каппа В), уровня фактора некроза опухоли-а и активности миелопероксидазы [74], приводит к улучшению эндоскопической картины: уменьшению воспалительных и язвенных повреждений толстой кишки как у здоровых, так и у депрессивных крыс [75]. Противовоспалительные и провоспалительные эффекты подтверждены также у бупропиона и миртазапина, причем снижение уровня циркулирующего фактора некроза опухоли-а наблюдается при применении бупропиона, а при применении миртазапина отмечено повышение этого фактора, что гипотетически может влиять на течение ВЗК [76]. Исследователями изучалась роль бупропиона при БК. Выяснилось его положительное влияние на течение обострений БК, уменьшение абдоминалгии, частоты стула вне зависимости от статуса курения [77], уменьшение утомляемости среди пациентов и положительное влияние на качество сна [78].
Заключение
Проблема ВЗК крайне актуальна для современной практической гастроэнтерологии. Следует отметить тесную взаимосвязь между клинической активностью ЯК и БК, их внекишечной манифестацией, осложненным течением с психоэмоциональными нарушениями, а также с депривацией сна и снижением качества жизни. В настоящее время еще много недостаточно изученного в отношении не только терапии пациентов с ВЗК, но их психосоциальной поддержки и коррекции изменений со стороны сексуальной сферы, сна и качества жизни.



