Введение
Остеоартроз (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы околосуставных мышц [1]. Вторичные воспалительные процессы, прежде всего синовит, сопровождают течение ОА, формируют клинику болезни и усиливают деструкцию суставных структур. Согласно современным представлениям, ОА является результатом взаимодействия возрастных, гормональных, генетических и средовых факторов. Патогенетические звенья ОА широко представлены в литературе [2–4].
В настоящее время в мире насчитывается более 250 млн больных ОА, при этом с возрастом частота заболевания увеличивается в геометрической прогрессии [2, 5]. Однако в реальности больных различными формами ОА гораздо больше, чем обращающихся за медицинской помощью в государственные лечебно-профилактические учреждения [6].
Социальная значимость данной болезни определяется ростом связанной с ним нетрудоспособноcти, а также снижением качества жизни (КЖ) людей [7, 8]. По снижению КЖ больных ОА далеко опережает желудочно-кишечные, респираторные и сердечно-сосудистые заболевания [9]. Вместе с ишемической болезнью сердца, алкоголизмом, депрессией и диабетом ОА входит в число факторов, наиболее часто обусловливающих продолжительное нарушение здоровья. При гонартрозе снижение КЖ отмечают до 80% пациентов, а инвалидизация составляет от 10 до 21% наблюдений [10]. ОА оказывает негативное психологическое и экономическое воздействие не только на людей, им страдающих, но и на их близких, а также на все общество в целом.
Проблема эффективного лечения ОА приобретает как медико-социальное, так и экономическое значение, т.к. заболевание в ряде случаев приводит к снижению работоспособности, а порой – и к инвалидности людей трудоспособного возраста. Утрата трудоспособности больными ОА пожилого возраста сравнима с таковой у страдающих сердечно-сосудистыми заболеваниями, и выше, чем при других заболеваниях у этого контингента пациентов [11].
Лечение ОА, в т.ч. гонартроза, до сих пор остается трудной задачей. Как правило, пациенты обращаются к врачу на поздних стадиях заболевания [10, 12, 13]. Борьба с воспалительным компонентом ОА – одно из ключевых звеньев терапии. На сегодняшний день терапия ОА до конца не разработана и, к сожалению, радикальным пособием остается эндопротезирование сустава [14].
Искусство врача состоит в создании условий, когда усиливаются целебные свойства медикамента и нивелируются его побочные действия Так как пусковым механизмом, эпицентром и конечным инвалидизирующим субстратом при ОА является сустав, локальная терапия становится патогенетически обоснованной, клинически значимой и психологически привлекательной, потому что притягивает внимание больного к конкретному местному лечению [15].
Локальная инъекционная терапия глюкокортикостероидами (ГКС) широко используется при лечении ОА для достижения местных обезболивающего, противовоспалительного, антиэкссудативного и миорелаксирующего эффектов [16, 17]. Коленный сустав наиболее доступен в техническом отношении для инъекций ввиду своего анатомического строения, и поэтому он чаще всего служит объектом для локальной терапии [15, 16]. Наиболее эффективной локализацией для проведения периартикулярной инъекционной терапии считаются энтезы – места прикрепления к костям мышц, сухожилий и связок [18]. Основная задача лечения больных ОА – рациональная обезболивающая и противовоспалительная терапия, замедление прогрессирования болезни и сохранение КЖ пациентов.
Целью клинического исследования стала оценка клинической эффективности локальной терапии больных ОА.
Материал и методы
Исследование проводилось на базе НУЗ «Отделенческая клиническая больница на станции Киров» ОАО РЖД.
Критерии исключения из исследования:
- Вторичный артроз суставов, включая ревматоидный артрит, септический артрит, воспалительное заболевание сустава, подагру, псевдоподагру, болезнь Педжета, перелом сустава, акромегалию, фибромиалгию, болезнь Вильсона, охроноз, гемохроматоз, остеохондроматоз, наследственные заболевания суставов.
- Сопутствующая патология других органов и систем с функциональной недостаточностью.
- Беременность и лактация.
- Инфекционные заболевания.
- Организационные сложности контроля проводимой терапии.
- Пациенты, злоупотребляющие или имеющие зависимость от препаратов, кроме никотина.
Были обследованы 25 больных ОА в стадии обострения с клинико-лабораторными признаками синовита или периартрита. Среди пациентов преобладали женщины (22 человека) с двусторонним гонартрозом (21) II стадии (12), средний возраст больных составил 62,8±8,9 года. Первую группу (15 человек) составили пациенты, которым проводилась локальная терапия бетаметазоном (Проспаном) 1 мл с анестетиком (2%-ный лидокаин или 0,5%-ный новокаин), число инъекций – 1–2. Контрольную группу (10 человек) составили пациенты, которым локальная терапия не проводилась. Все пациенты в составе комплексной терапии получали нестероидные противовоспалительные средства (НПВС) (нимесулид 100 мг 2 раза в сутки), миорелаксанты (толперизон 150 мг/сут), физиолечение.
Перед началом терапии и в конце курса стационарного лечения проводился общеклинический осмотр пациентов обеих групп. Также в данные сроки определялась выраженность боли в суставах (по 100-миллиметровой визуальной аналоговой шкале – ВАШ), утомляемость и самочувствие по ВАШ; измерялся объем движения в суставах в угловых градусах. Также определялся индекс Лекена, оценивалась функциональная недостаточность по опроснику HAQ – Health Assessment Questionnaire [19].
Для оценки КЖ пациентов с ОА применяли общий опросник SF-36 – The Short Form-36 [9, 20] с вычислением 8 основных показателей: физическое функционирование (ФФ), ролевое физическое функционирование (РФФ), физическая боль (Б), общее здоровье (ОЗ), жизнеспособность (Ж), социальное функционирование (СФ), ролевое эмоциональное функционирование (РЭФ), психическое здоровье (ПЗ) по стандартной методике.
 Формула вычисления значений основных показателей:
Формула вычисления значений основных показателей:
Окончательное значение=[(реальное значение показателя) – (минимальное возможное значение показателя)]:(возможный диапазон значений)×100.
У пациентов обеих групп оценивались показатели общего и биохимического анализов крови, общий анализ мочи, электрокардиограмма. В процессе лечения анализировались побочные эффекты, а в конце терапии оценивалась эффективность проведенного лечения.
Исследуемые группы были сопоставимыми по основным антропометрическим и клиническим показателям (p>0,05) (табл. 1).
Статистическая обработка полученных данных проведена с использованием программы BIOSTAT. В группах вычисляли среднее арифметическое (М), среднеквадратическое отклонение (σ). При сравнении количественных показателей в двух группах пользовались t-критерием Стьюдента или критерием Манна–Уитни, при невыполнении требования нормальности распределения показателя. Для сравнения качественных показателей применялся χ2-критерий. Изучение динамики исследуемых показателей в процессе лечения проводили с помощью парного критерия Стьюдента и критерия Вилкоксона. Во всех случаях нулевую гипотезу отвергали при p<0,05.
Результаты исследования
Лечение больных ОА проведено в условиях терапевтического отделения после тщательного клинико-лабораторного обследования для уточнения диагноза и выявления противопоказаний. В процессе терапии проведено изучение клинических, лабораторных, инструментальных показателей болезни. Исследуемые параметры оценивали до лечения и в динамике в конце стационарного лечения.
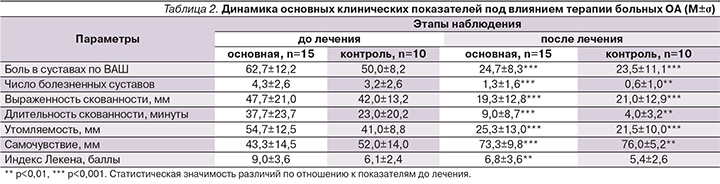
Влияние изучаемых препаратов на периферический суставной синдром приведено в табл. 2.
При оценке динамики показателей, характеризующих суставной синдром, на фоне лечения улучшение наблюдалось в обеих группах: достоверно уменьшились боль в суставах по ВАШ, выраженность утренней скованности, утомляемость по ВАШ. Также наблюдалось улучшение самочувствия по ВАШ, но в группе локальной терапии оно было более выраженным (p<0,001), как и для длительности утренней скованности (p<0,001), числа болезненных суставов (p<0,001). Достоверное уменьшение индекса Лекена наблюдалось только в основной группе.
Побочные эффекты были выявлены у 3 больных, получавших локальную терапию. У 2 пациентов наблюдалось повышение артериального давления в течение суток после внутрисуставной инъекции, у 1 – покраснение и ощущение жара кожи лица и груди. Однако эти побочные эффекты были выражены умеренно и проходили самостоятельно. В целом переносимость локальной терапии была удовлетворительной.
Кроме клинических показателей важным критерием эффективности терапии служат показатели КЖ пациентов. Нами изучена динамика показателей физического, психологического и социального функционирования больных ОА по опросникам SF-36 и HAQ на фоне локальной терапии больных ОА.
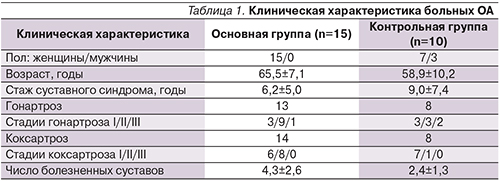
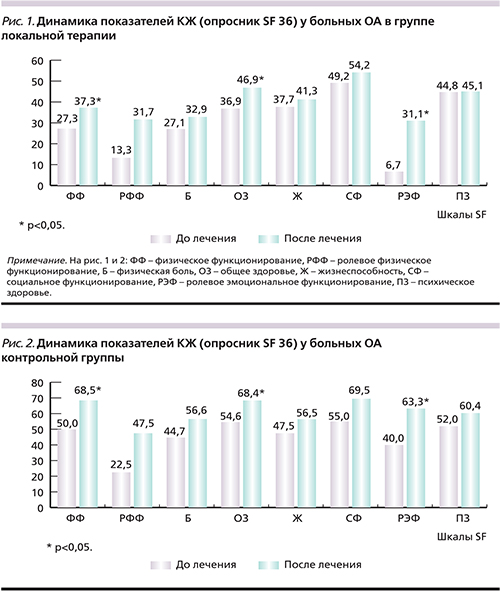
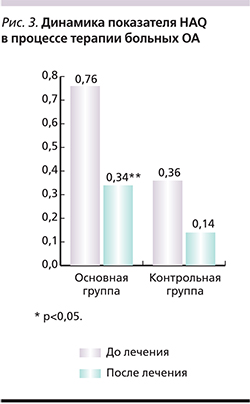
В обеих группах пациентов на фоне лечения достоверно улучшились показатели ФФ (p<0,05), ОЗ (p<0,05) и РЭФ (p<0,05) (рис. 1, 2). Однако в основной группе РЭФ увеличилось на 78%, в контрольной – на 37%. Функциональный показатель HAQ достоверно уменьшился только в группе пациентов, получавших локальную терапию (p<0,01; рис. 3).
Обсуждение
Локальная стероидная терапия оказывает симптом-модифицирующие эффекты: обезболивающий, противовоспалительный, улучшающий функции сустава. Но данные результаты при ОА недлительные – 2–3 недели, на что указывают многие авторы и с учетом возможных отрицательных воздействий стероидов на структуры сустава терапия ГКС показана на современный момент не чаще 2 раз в год [8, 16, 18]. Преимущественно женский пол, пожилой возраст, частая патология желудочно-кишечного тракта затрудняют общее лечение, особенно применение НПВС больными ОА. Многообразие форм и высокая частота сопутствующей соматической патологии при ОА также диктуют правильное сочетание локальной терапии со средствами общего воздействия [1].
В исследовании Н.А. Хитрова в первые дни после инъекции ГКС признаки клинического улучшения отмечены среди большинства больных: уменьшение болей, припухлости в суставе, улучшение общего самочувствия [15]. В нашем исследовании также наблюдалось уменьшение болей в суставах по ВАШ, выраженности утренней скованности, утомляемости и индекса Лекена, улучшение самочувствия по ВАШ.
В исследовании С.В. Брагиной, Р.П. Матвеева приведены результаты лечения 42 пациентов с ОА коленного сустава методом локальной инъекционной терапии, лечившихся амбулаторно у врача-ортопеда, на основе сравнительного анализа в зависимости от стадии заболевания. Было установлено, что наилучшие результаты достигнуты при I стадии ОА – 94,7 % пациентов, несколько хуже они при II стадии – 83,3 % и при III – 60,0% [7]. В нашем исследовании кроме улучшения клинических показателей при использовании локальной терапии улучшались функциональный статус и показатели физического функционирования, общего здоровья, ролевого эмоционального функционирования.
Заключение
Таким образом, при применении локальной терапии ГКС на фоне основного лечения достигнуты лучшие результаты положительной динамики клинических и функциональных показателей. К тому же данный вид лечения положительно влияет на КЖ больных ОА. Следовательно, локальная терапия может быть рекомендована в комплексном лечении пациентов с ОА при недостаточной эффективности консервативной терапии и наличии у них противопоказаний к применению основных симптом-модифицирующих препаратов.



