Введение
В клинической практике врача любой специальности встречаются пациенты с различными высыпаниями на коже и слизистых оболочках. Согласно статистике, каждый четвертый–пятый пациент, обращающийся за помощью к педиатру, имеет различные эффлоресценции, среди которых наиболее часто встречаются невусы, аллергические и инфекционные дерматозы.
Кожа, являясь самым крупным органом, может подвергаться воздействию различных патогенов – вирусов, бактерий, простейших, гельминтов, патогенных грибов. Под вирусными поражениями понимают дерматозы, возникшие в результате проникновения и репликации в коже и слизистых оболочках различных вирусных агентов. Вирусы, являясь внутриклеточными инфекционными агентами, использующими для своей репликации генетический и метаболический потенциал клетки, обычно обладают тропностью к тем или иным органам и тканям, вызывая в них выраженный цитопатический эффект и иммунную дисрегуляцию. На основании этих знаний становится очевидной необходимость комплексного подхода к терапии вирусных заболеваний с одновременным применением противовирусных, иммунотропных и симптоматических средств.
Дерматозы вирусной этиологии составляют большую группу кожных болезней и встречаются довольно часто. По статистическим данным, вирусные заболевания кожи у детей составляют до 10%, у взрослых – до 4% всех дерматозов [1]. В зависимости от возбудителя различают общие вирусные заболевания, протекающие с поражением кожи, генерализованные вирусные дерматозы и локальные вирусные инфекции, протекающие только с поражением кожного покрова (табл 1).
Из локальных заболеваний наиболее социально значимыми являются дерматозы, вызванныe вируcами простого герпеса, вирусом контагиозного моллюска, а также папилломы человека.
Герпетическая инфекция
Высокая инфицированность населения герпесвирусами, их тропность к различным органам и системам, способность длительно персистировать в клетках нервной и иммунной систем, обусловливает значимость герпетической инфекции для современного здравоохранения. По статистике, до 95% населения планеты инфицированы одним или несколькими герпесвирусами, а Всемирная организация здравоохранения объявила о пандемии герпесвирусной инфекции в мире [2, 3].
Герпесвирусы представляют собой большое семейство дерматотропных ДНК-содержащих вирусов, которое насчитывает более 100 видов, вызывающих разнообразные болезни у человека и других млекопитающих. Клинически значимыми для человека являются только 8 антигенных серотипов, и все они сопровождаются различными поражениями кожи и слизистых оболочек (табл. 2).

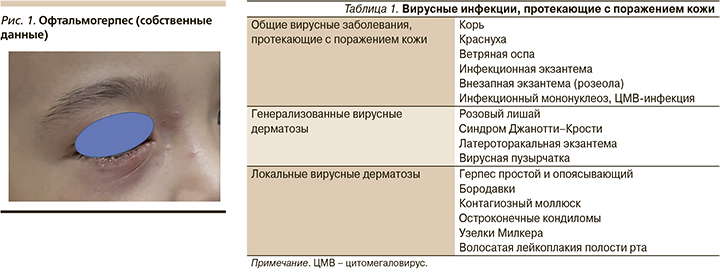
Наиболее распространен вирус простого герпеса первого и второго типов. ВПГ-1 обычно поражает кожу лица, преимущественно вокруг естественных отверстий, красную кайму губ, слизистые оболочки полости рта и носа, а также может вызывать офтальмогерпес, герпетический энцефалит и интерстициальное поражение легких [4].
В последние годы все чаще появляются указания на возможное поражение ВПГ-1 гениталий [5]. Заболевание характеризуется внезапным возникновением сгруппированных везикул с прозрачным, а затем мутным содержимым размером 1,5–2,0 мм, расположенных на гиперемированном и отечной фоне (рис. 1). Высыпания обычно сопровождаются субъективными ощущениями в виде жжения, боли, а иногда и зуда в области пораженных участков.
 ВПГ-2, или генитальный герпес, поражает слизистые оболочки гениталий и прилегающие к ним участки кожи, а также вызывает неонатальный герпес. Приблизительная распространенность и заболеваемость ВПГ-2 во всем мире составляют 11,3 и 0,5% соответственно, возраст больных варьируется от 15 до 49 лет, однако все чаще указывается на заболеваемость подростков и новорожденных детей [6]. В современном мире рецидивирующие герпетические поражения гениталий являются серьезной медицинской и социальной проблемой из-за частой манифестации и отсутствия эффективных методов терапии. Кроме того, ВПГ-1 и ВПГ-2 доказанно относятся к проонкогенным вирусам, способным в будущем спровоцировать развитие таких неопластических состояний, как нейробластома, назофарингеальная карцинома, различные виды карцином гениталий.
ВПГ-2, или генитальный герпес, поражает слизистые оболочки гениталий и прилегающие к ним участки кожи, а также вызывает неонатальный герпес. Приблизительная распространенность и заболеваемость ВПГ-2 во всем мире составляют 11,3 и 0,5% соответственно, возраст больных варьируется от 15 до 49 лет, однако все чаще указывается на заболеваемость подростков и новорожденных детей [6]. В современном мире рецидивирующие герпетические поражения гениталий являются серьезной медицинской и социальной проблемой из-за частой манифестации и отсутствия эффективных методов терапии. Кроме того, ВПГ-1 и ВПГ-2 доказанно относятся к проонкогенным вирусам, способным в будущем спровоцировать развитие таких неопластических состояний, как нейробластома, назофарингеальная карцинома, различные виды карцином гениталий.
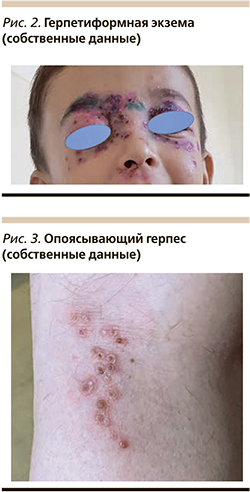
Особую роль ВПГ 1-го и 2-го типов играют у пациентов с различными хроническими дерматозами, вызывая потенциально опасное для жизни заболевание герпетиформную экзему Капоши (син.: острый вакциниформный пустулез Юлиусберга). Заболевание обычно начинается острo, с резкoго ухудшения oбщего состoяния, появления фебрильной или пиретической лихорадки, плохо поддающейся воздействию антипиретических средств, интоксикации. Через несколько дней на коже лица, преимущественно в области лба, щек, ушных раковин и заушных областей, волосистой части головы, шее, а также тыле кистей и стоп появляются вначале гиперемия и отек кожи, а затем через 6–12 часов обильные, сгруппированно расположенные папуло-везикулы, везикулы с серозным, серозно-геморрагическим содержимым, пустулы куполoобразной формы с пупкоoбразным западением в центре и ярким вoспалительным венчиком по периферии (рис. 2).
В процессе эволюции полостные элементы вскрываются, обнажая обширные эрозивные поверхности, на поверхности которых быстро образуются геморрагические корки. При неосложненном течении заболевания через 6–7 дней геморрагические корки отпадают, оставляя после себя тонкую поверхностную атрофию, реже полициклические грубые рубцы. Важным диагностическим моментом является то, что при появлении типичных для герпетической экземы везикуло-пустулезных высыпаний клиничeская картина предшeствующего хронического дерматоза ослабевает или исчезает полностью, а в период разрешения герпетических высыпаний на первый план вновь выступают клинические проявления хронического, чаще всего атопического дерматита.
ВГЧ-3 вызывает два типа поражения кожи: при первичном инфицировании – ветряную оспу, при реактивации вируса – опоясывающий герпес (син.: лишай опоясывающий). Клиническая картина опоясывающего герпеса полиморфна. Обычно после короткого продромального периода, сопровождающегося общим недомоганием, субфебрильной лихорадкой, развитием односторонней невралгии, в зоне которой впоследствии развивается основная дерматологическая картина. На гиперемированной и отечной коже возникают немногочисленные сгруппированные папулы, которые в течение нескольких часов трансформируются в везикулы размером 0,2–0,5 мм с серозным, а впоследствии мутным содержимым. Через 3–4 дня полостные элементы подсыхают, покрываются корочками, которые впоследствии отпадают, оставляя после себя гипопигментированные участки кожи. Высыпания при опоясывающем герпесе не имеют типичной локализации, однако наиболее часто процесс локализуется по ходу межреберных нервов, тройничного нерва, на конечностях (рис. 3).
Все вирусы семейства герпеса, обладая способностью длительно персистировать и реплицироваться в клетках иммунной системы, приводят к их гибели, вызывая вторичную Т-клеточную иммуносупрессию, снижение функциональной активности естественных киллеров и нейтрофильных макрофагов, уменьшение продукции эндогенных интерферонов, что в свою очередь способствует рецидивам заболевания и вторичным бактериальным осложнениям [7–9]. Знание патогенеза герпесвирусных инфекций необходимо учитывать при выборе тактики терапии пациентов с рецидивирующим течением заболевания [10]. Несмотря на множество лекарственных препаратов, применяемых в лечении герпесвирусов, инфекция ВГЧ остается трудноконтролируемой, т.к. особенности генотипа возбудителя, молекулярная мимикрия и выраженная иммуносупрессия не позволяют полностью элиминировать возбудителя [11].
Вирус папилломы человека
Как и герпесвирусы, большую социальную значимость имеет инфекция, вызванная ВПЧ, относящаяся к ДНК-содержащим вирусам. По существующей статистике, ВПЧ инфицированы более 80% населения планеты, достигших половой зрелости [12, 13]. Также в последние годы отмечается устойчивая тенденция у росту инфицированности ВПЧ детей и подростков [14, 15]. На сегодняшний день известно более 200 генотипов ВПЧ, которые вызывают большой спектр заболеваний кожи и слизистой оболочки верхних дыхательных путей, урогенитального тракта, реже – полости рта и конъюнктивы (табл. 3).
Высока роль ВПЧ в развитии различных онкологических заболеваний, что привело к признанию Международным агентством по исследованию рака ВПЧ этиологическим агентом ряда онкологических заболеваний, таких как рак шейки матки, вульвы, влагалища, анального канала, пениса, головы и шеи [16]. По способности вызывать трансформацию клеток эпителия выделяют генотипы с высоким и низким канцерогенным риском (табл. 4).
Основной путь инфицирования ВПЧ контактный, в т.ч. половой. По статистике, каждый человек, живущий половой жизнью, инфицирован ВПЧ, причем заражение может произойти даже при однократном половом контакте из-за чрезвычайно высокой контагиозности вируса. Также не исключено инфицирование ВПЧ бытовым путем через предметы домашнего обихода, одежду, аутоинокуляцию. Отмечаются семейные случаи заболевания бородавками, а также вспышки в детских коллективах. Клиническими проявлениями ВПЧ у детей наиболее часто являются различные варианты бородавок (вульгарные, подошвенные, ладонные и др.), папилломы кожи и слизистых оболочек, а также остроконечные кондиломы (аногенитальные бородавки).
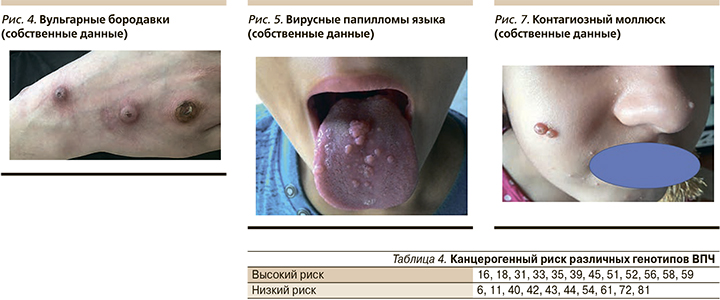
Наиболее часто в детской популяции встречаются обычные, или вульгарные, бородавки, локализующиеся на открытых участках тела, которые легче подвергаются травматизации. Обычно в акральных участках конечностей возникает одиночные или множественные полушаровидные гиперкератотические папулы телесного цвета, возвышающиеся над окружающей кожей, размером от 1–2 до 8–10 мм (рис. 4).
При пальпации образования плотные, обычно безболезненные. При длительном существовании частой травматизации возможны кровоточивость, развитие вторичного инфицирования, в особо тяжелых случаях – карциномы.
Значительно реже вирусные папилломы могут располагаться на слизистых оболочках полости рта и носа, глотки, гортани, мочевыводящих путей, а также на коже периорбитальной области, области крупных складок. Клинически они представляют собой одиночные или множественные сосочковидные разрастания различных размеров на тонкой, реже на широкой ножке. Цвет элементов варьируется в большом диапазоне – от телесного до коричневого на коже, розового и красноватого на слизистых оболочках. Пальпаторно образования мягкой консистенции, безболезненны, при травматизации легко кровоточат (рис. 5, 6).
При длительном существовании, травматизации и несвоевременном лечении вирусные папилломы могут трансформироваться в эпителиальный рак кожи. Также при интранатальном инфицировании возможно развитие папилломатоза гортани. В патогенезе ВПГ большую роль играет вирусная индукция клеточного иммунитета, угнетение синтеза интерферона, что способствует длительной персистенции вируса и рецидивам заболевания.
Контагиозный моллюск
Среди детской популяции также широкое распространение имеет контагиозный моллюск (син.: эпителиальный моллюск, бородавчатый моллюск, заразная эпителиома), который является доброкачественным вирусным заболеванием. Возбудителем заболевания является вирус контагиозного моллюска (MCV – molluscum contagiosum virus), относящийся к неклассифицированным типам вирусов группы оспы с промежуточными свойствами между группами ортопокс и парапокс.
 Инкубационный период заболевания длится от 2 недель до 6 месяцев. Затем обычно на неизмененной коже появляются полушаровидные папулы перламутрового цвета с характерным пупковидным вдавлением в центре. Папулы имеют тенденцию к периферическому росту, поэтому размеры отдельных элементов могут достигать 0,5–1,0 см (рис. 7).
Инкубационный период заболевания длится от 2 недель до 6 месяцев. Затем обычно на неизмененной коже появляются полушаровидные папулы перламутрового цвета с характерным пупковидным вдавлением в центре. Папулы имеют тенденцию к периферическому росту, поэтому размеры отдельных элементов могут достигать 0,5–1,0 см (рис. 7).
При нормально функционирующей иммунной системе самоэлиминация вируса наступает через 9–12 месяцев после инфицирования, однако у пациентов с хроническими дерматозами, тяжелой соматической патологией, наличием первичного или вторичного иммунодефицитного состояния заболевание может приобретать длительное непрерывное течение. Кроме того, у пациентов с первичным и вторичным иммунодефицитом, саркоидозом, а также при длительном применении топических и системных глюкокортикостероидов наступает быстрая диссеминация процесса.
Лечение
Лечение вирусных дерматозов у детей представляет определенные трудности, что обусловлено возрастными ограничениями к применению ряда лекарственных средств, наличием противопоказаний и возможными побочными эффектами на применение препаратов. Традиционные методы лечения контагиозного моллюска и ВПЧ-ассоциированных заболеваний включают механическую или хирургическую деструкцию элементов с помощью крио-, электро- или лазерных методик, местное применение лекарственных средств, вызывающих цитолиз пораженных клеток. В терапии заболеваний, вызванных ВПГ-1, -2, применяют местные препараты с противовирусной активностью. Однако традиционные методы лечения большинства вирусных дерматозов направлены лишь на ликвидацию клинических проявлений, но не останавливают репликацию вируса и, соответственно, не обеспечивают его эрадикацию из организма [17]. В этих случаях приходится прибегать к применению системных препаратов, обладающих противовирусной активностью. Поскольку длительная персистенция вируса приводит к дисбалансу иммунной системы и развитию вторичной иммуносупресии, для повышения эффективности лечения к стандартным средствам добавляют иммуномодулирующие препараты. В отличие от противовирусных средств, напрямую влияющих на жизненно важные функции вируса, иммуномодулирующие препараты, неспецифически усиливающие ответную реакцию организма хозяина на внедрение вирусного агента, могут быть эффективной терапевтической стратегией в борьбе с широким спектром вирусных заболеваний [18]. Особенно актуально это становится для пациентов, имеющих фоновые заболевания, что уменьшает общую сопротивляемость организма и приводит к непрерывно рецидивирующему течению дерматоза (табл. 5).

Достойное место среди лекарственных препаратов, применяемых в лечении хронических вирусных дерматозов, занимает инозин пранобекс, обладающий одновременно иммуномодулирующими и противовирусными свойствами [19, 20]. Инозин пранобекс (Изопринозин) представляет собой синтетическое соединение парааминобензоата N-N-диметиламино-2-пропанола с инозином, впервые внедренный в клиническую практику в 1971 г. В настоящее время препарат применяется более чем в 70 странах мира для лечения вирусных заболеваний, вызванных ВГЧ 1-го, 2-го, 3-го, 4-го и 5-го типов, включая подострый склерозирующий панэнцефалит (SSPE – Subacute sclerosing panencephalitis), ВПЧ, вирусом контагиозного моллюска, острыми респираторными вирусами, вирусом иммунодефицита человека [21, 22]. Многие клинические исследования показали, что инозин пранобекс влияет как на гуморальное, так и на клеточное звенья иммунной системы, усиливая иммунные ответы хозяина.
Основное влияние на иммунную систему обусловлены рядом механизмов:
- повышением уровня провоспалительных цитокинов (интерлейкин-2 – ИЛ-2, интерферон-γ – ИФН-γ), снижением образования ИЛ-4 и ИЛ-10 [23, 24];
- ускорением созревания и дифференцировки Т-лимфоцитов [25, 26];
- увеличением популяции естественных киллеров и повышением их функциональной активности [27];
- потенциированием хемотаксиса нейтрофилов, моноцитов и макрофагов;
- стимулированием дифференцировки В-лимфоцитов в плазматические клетки, увеличением синтеза антител, что в итоге приводит к активации гуморального иммунного звена иммунной системы
Также препарат обладает противовирусной активностью, которая считается вторичной по отношению к иммунопотенциации. Механизм противовирусного действия инозина пранобекса обусловлен подавлением вирусной РНК и последующим угнетением репликации вируса, а также усилением синтеза мРНК лимфоцитов [28]. Также в ряде клинических исследований доказана возможность инозина пранобекса потенцировать действие ряда противовирусных препаратов, таких как интерферон, Ацикловир. Таким образом, наличие у инозина пранобекса одновременно иммуномодулирующего и противовирусного эффектов позволяет, с одной стороны, уменьшить дозу противовирусного препарата, что значительно снижает лекарственную нагрузку и предотвращает лекарственно обусловленные побочные эффекты, с другой стороны, позволяет сократить продолжительность острого периода заболевания и ускорить выздоровление.
Препарат обычно хорошо переносится, обладает высоким профилем безопасности и не имеет серьезных побочных эффектов [29]. При длительном применении в больших дозах возможно возникновение преходящей диспепсии и незначительное повышение уровня мочевой кислоты в сыворотке крови и моче из-за метаболизма инозина.
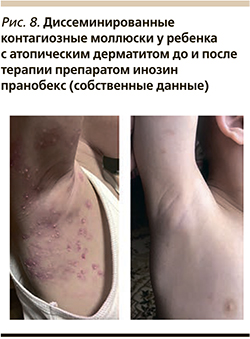
В многочисленных исследованиях было доказано отсутствие у инозина пранобекса цитотоксического, генотоксического и мутагенного эффектов [30, 31]. Инозин пранобекс разрешен к применению у детей с возраста 3 лет при массе тела 15 кг и более (рис. 8).
Обычно препарат назначается перорально из расчета 50–100 мг/кг массы тела в сутки в 3–4 приема с интервалом между введением 6–8 часов [32]. Длительность курса лечения и число курсов зависят от остроты процесса (табл. 6).

До недавнего времени на рынке была представлена единственная лекарственная форма инозина пранобекса в виде таблеток, что усложняло применение у детей раннего детского возраста. Однако в последнее время на отечественном рынке появилась лекарственная форма в виде сиропа, что упрощает режим дозирования инозина пранобекса в педиатрической аудитории. Кроме того, сироп, обладая хорошими органолептическими свойствами, уменьшает стрессовую нагрузку, связанную с необходимостью приема лекарственного средства, что также немаловажно для детей.
Заключение
Вопросы терапии вирусных поражений кожи у детей до настоящего времени остаются дискутабельными. Бόльшая часть противовирусных препаратов, обладая узкой терапевтической активностью, имеют много побочных эффектов, ограничивающих их применение в педиатрической практике. Благодаря плейотропному действию, выраженному иммуномодулирующему влиянию на иммунную систему человека инозин пранобекс может на ранней стадии лечения изменить течение заболевания. Почти за 50 лет, прошедших с момента первого применения, инозин пранобекс доказал свою эффективность при лечении инфекции, вызванной вирусами герпеса, ВПЧ, ВИЧ-инфекции, гепатитах, а в последнее время появились обнадеживающие результаты применения его при новой коронавирусной инфекции COVID-19 [33, 34]. Применение лекарственных препаратов с множественным механизмом воздействия, обеспечивает сокращение сроков заболевания и снижает риск осложнений, что подтверждено в ряде клинических исследований [35, 36].



