Актуальность проблемы
Псориаз – один из самых распространенных дерматозов на планете: по статистике, заболеваемость псориазом в мире варьируется от 0,6 до 4,8% [1]. Известно, что в развитии данного дерматоза важную роль играют нарушения функций иммунной, эндокринной, нервной систем, а также наследственность. Провоцирующими факторами могут быть психоэмоциональные факторы, инфекции, злоупотребление алкоголем, прием ряда лекарственных средств. Описано порядка 10 генов (PSORS), наличие которых предрасполагает к развитию заболевания [1].
На сегодняшний день активно изучается взаимосвязь системного воспаления при псориазе и коморбидных патологий. До начала 1980 гг. псориаз рассматривали исключительно как дерматоз, характеризующийся избыточной пролиферацией кератиноцитов. Позднее была доказана положительная роль иммуносупрессии в отношении динамики псориаза, и его стали рассматривать как системное иммуноопосредованное заболевание [2].
В дальнейшем была открыта ключевая роль Th17-лимфоцитов, интерлейкина-23 (ИЛ-23) – сигнального пути и ИЛ-17A в патогенезе псориаза и псориатического артрита, что привело к пониманию наличия системного воспалительного процесса, управляемого цитокинами [3]. Так, современная модель псориаза учитывает генетическую составляющую, которая при воздействии триггерных факторов реализуется типичными кожными проявлениями, при этом возможно наличие различных генотипических вариантов псориаза и ассоциация с коморбидной патологией. При псориазе отмечается активация генов, кодирующих рецептор интерлейкина-23 (ИЛ-23R), интерлейкина-12 (ИЛ-12R), кластер генов ИЛ-4–ИЛ-13, белок-313 (ZNF313), CDKAL1, PTPN22, TNFAIP3 и ERAP1 [4]. Многие из вышеперечисленных генов играют роль в контроле и модификации иммунного ответа, который является ключевым фактором в развитии не только псориаза, но и других иммуноопосредованных заболеваний. Например, кластеры генов ИЛ-12, -23 и ИЛ-4–ИЛ-13 связаны с дифференцировкой Т-хелперов клеточными иммунными реакциями и развитием таких аутоиммунных заболеваний, как псориатический артрит, болезнь Бехтерева–Штрюмпелля–Мари, болезнь Крона [4]. Ассоциированный с псориазом, ген TNFAIP3, участвующий в передаче сигнала через транскрипционный фактор NFkB, также служит фактором риска при ревматоидном артрите, системной красной волчанке и сахарном диабете 1 типа [5].
Среди коморбидностей псориаза наиболее часто встречаются метаболические нарушения (метаболический синдром – 30–40%, сахарный диабет 2 типа – 12%), псориатический артрит (27–35%), кардиоваскулярные заболевания (ишемическая болезнь сердца и артериальная гипертензия – 20–25%), патология гепатобилиарной системы (до 50%), язвенно-некротические поражения желудочно-кишечного тракта (воспалительные заболевания кишечника и болезнь Крона – 2–4%), а также функциональные и органические расстройства ЦНС (депрессивные состояния – 15–18%) [6, 7]. Связующим звеном при наличии псориаза и коморбидной патологии рассматривается модель системного воспаления и ангиопатии [8]. Таким образом, псориаз следует рассматривать не изолированно, а в комплексе с его наиболее часто выявляемыми коморбидными заболеваниями.
Под коморбидностью (лат. со – вместе, morbus – болезнь) подразумевают наличие дополнительных хронических заболеваний (транснозологическая коморбидность) или синдромов (транссиндромальная коморбидность), патогенетически взаимосвязанных между собой или совпадающих по времени у одного пациента вне зависимости от активности каждого из них [9]. В среднем в популяции число коморбидных заболеваний существенно повышается с возрастом: с 10% в возрасте до 19 лет до 80% у лиц 80 лет и старше [1].
Коморбидностью, с одной стороны, и фактором риска развития сопутствующей соматической патологии, с другой, является метаболический синдром, которым больные псориазом страдают в 6 раз чаще других лиц в популяции [10]. В широком смысле метаболическим синдромом обозначают различные сочетания факторов риска развития заболеваний сердечно-сосудистой системы, обязательно включающие следующие компоненты: инсулинорезистентность и/или сахарный диабет 2 типа, абдоминальное ожирение, артериальную гипертензию, а также дислипидемию (увеличение концентрации липопротеидов низкой плотности и триглицеридов при сниженном содержании липопротеидов высокой плотности, могут наблюдаться нарушения обмена мочевой кислоты [11]. Наиболее часто из составляющих метаболического синдрома при псориазе выявляют ожирение (38%) и гиперлипидемию (36%). Было отмечено, что имеется корреляция между степенью тяжести течения псориаза и частотой выявляемости метаболического синдрома: пациенты с псориазом тяжелого течения, как правило, гораздо чаще пациентов с легким и среднетяжелым течением заболевания имеют сопутствующий метаболический синдром [6]. Таким образом, выбор метода лечения, который зависит прежде всего от тяжести псориатического процесса и локализации поражения, должен учитывать значимые сопутствующие заболевания (коморбидности), которые напрямую могут на него влиять (противопоказания, риски нежелательных явлений и т.д.) [12, 13].
Современные клинические рекомендации по лечению псориаза среднетяжелого и тяжелого течения рассматривают возможность назначения системной базисной противовоспалительной терапии (метотрексат, ацитретин, циклоспорин), ингибиторов внутриклеточных сигналов (апремиласт, тофацитиниб), методов фототерапии (ПУВА, УФВ 311нм), генно-инженерных биологических препаратов (ГИБП) [16]. Недостатком системных традиционных методов лечения следует считать частое возникновение нежелательных явлений, в частности злокачественных опухолей, гепато- и нефротоксичность, угнетение гемопоэза, несовместимость многих препаратов с беременностью и грудным вскармливанием, наличие множественных противопоказаний к применению, что снижает приверженность больных лечению, и необходимость принимать решение об отмене препаратов и смене схемы лечения [14]. Стоит отметить, что даже при соблюдении пациентом всех назначений врача неудовлетворенность результатами лечения, т.е. недостижение уровня PASI-75, отмечают более чем у половины пациентов. Отдельно следует отметить, что терапия вышеперечисленными системными препаратами зачастую имеет относительные противопоказания к назначению пациентам из-за наличия сопутствующей соматической патологии [15].
Согласно действующим в Российской Федерации клиническим рекомендациям РОДВК [16], назначение ГИБП рассматривается в следующих клинических ситуациях:
- при среднетяжелом и тяжелом бляшечном псориазе;
- в случаях, если системные иммуносупрессоры или фототерапия оказываются недостаточно эффективными либо у пациента развивается непереносимость или имеются противопоказания к их применению.
В то же время становится очевидным, что в ряде клинических ситуаций ГИБП следует рассматривать в первой линии терапии, т.к. возможность управлять системным воспалением, обеспечивающаяся препаратами биологической терапии, позволяет не только контролировать системный воспалительный процесс, но и улучшать прогноз течения псориаза. Так на советах экспертов неоднократно обсуждались вопросы «портрета» пациента, которым показана терапия ГИБП как первая линия лечения.
Показания к назначению ГИБП при псориазе, согласно проекту междисциплинарных рекомендаций (2018) [15]:
- средняя и тяжелая степень тяжести псориаза (BSA >10 или PASI >10 и ДИКЖ >10) в отсутствие клинического эффекта системных БПВП и методов фототерапии в течение ≥3 месяцев либо при непереносимости/наличии противопоказаний к их применению;
- проблемная локализация резистентных к терапии псориатических высыпаний, наличие сопутствующего активного прогрессирующего псориатического артрита (ПсА);
- сопутствующий активный прогрессирующий ПсА;
- тяжелая степень псориатической ониходистрофии;
- развитие рецидива псориаза в течение 3 месяцев после отмены БПВП или фототерапии;
- предикторы ПсА, факторы риска ПсА у пациентов с псориазом.
На сегодняшний день в РФ зарегистрировано 4 класса ГИБП по показанию «бляшечный (вульгарный) псориаз»: ингибиторы фактора некроза опухоли-α (ФНО-α), ингибиторы ИЛ-17, ингибитор ИЛ-12/23, ингибитор ИЛ-23 [16].
С появлением новых классов ГИБП сформировалась концепция «лечения до достижения цели», в соответствии с которой отмечается важность достижения чистой/почти чистой кожи как цели терапии псориаза, т.к. исследования показали, что достижение чистой/почти чистой кожи (PASI-90, -100) коррелирует с более высокими показателями качества жизни, связанного со здоровьем [17, 18].
Концепция сводится к длительному назначению высокоэффективных и безопасных средств (методов) терапии, имеющих высокий уровень доказательности в медицине (A, B) [19]. Терапевтическая стратегия предполагает достижение ремиссии либо минимальной активности патологического процесса и ее максимальную пролонгацию. Препараты, используемые в реализации терапии до достижения цели, должны оказывать таргетное действие в организме, демонстрировать устойчивость терапии при длительном применении, определяемую следующими факторами: высокая клиническая эффективность в долгосрочной перспективе; приемлемая безопасность; низкая иммуногенность; высокая приверженность терапии [20].
В свете данной концепции представители нового класса блокаторов ИЛ-23 являются теми препаратами, с помощью которых становится возможным достижение полного и почти полного очищения кожи у подавляющего большинства пациентов [18, 21]. Представитель нового класса ГИБП – гуселькумаб – это моноклональное человеческое антитело типа IgG1λ, которое селективно связывается с белком ИЛ-23 с высокой специфичностью и аффинностью. ИЛ-23 – это регуляторный цитокин, который влияет на дифференцировку, миграцию и жизнеспособность субпопуляций Т-клеток (например, Тh17 и Тc17) и незрелых субпопуляций иммунных клеток, являющихся источником эффекторных цитокинов, включая ИЛ-17А, -17F и-22, способствующих развитию воспалительных заболеваний.
В исследованиях показано, что селективная блокада ИЛ-23 нормализует выработку этих цитокинов путем блокирования его взаимодействия с рецептором ИЛ-23 на поверхности клеток с последующим прерыванием опосредованных ИЛ-23 сигнальных, активирующих и цитокиновых каскадов [21, 22].
Основные результаты эффективности и безопасности применения гуселькумаба, по данным клинических исследований, представлены в таблице.

Актуальным остается вопрос эффективности ГИБП, в т.ч. и гуселькумаба, для пациентов с коморбидной патологией. Ниже представлены клинические случаи применения препарата гуселькумаб пациентами с псориазом и сопутствующей коморбидной патологией.
Клинический случай № 1
Пациент Л. 1990 года рождения болеет псориазом в течение 17 лет. Лечился амбулаторно топическими глюкокортикоидными средствами с хорошим эффектом. С 2008 г. процесс стал носить распространенный характер: получал метотрексат, фототерапию. Несмотря на системную терапию, после курса лечения рецидивы отмечались в сроки 4–6 недель. В 2015 г. диагностирован гепатит С.
В связи с противопоказаниями к назначению базисной системной противовоспалительной терапии был назначен секукинумаб. Достижение PASI-90 через 2 месяца терапии секукинумабом. Однако через 16 недель отмечен эффект ускользания. В ноябре 2019 г. – обострение кожного процесса. При осмотре: на коже волосистой части головы (затылочная область), туловища (грудь, спина, живот), верхних конечностей (разгибательные поверхности плеч, предплечий, локтевых суставов), нижних конечностей (передние и задние поверхности бедер, голеней, разгибательные поверхности коленных суставов) множественные инфильтрированные бляшки ярко-красного цвета, покрытые частично прилегающими серебристыми чешуйками, индекс PASI-34 балла (рис. 1). Сопутствующая соматическая патология: гепатит С, наркозависимость (в анамнезе). В анализе крови – СОЭ 29 мм в час, С-реактивный белок – 8 мг/л, АЛТ – 43 ЕД/л, АСТ – 52 ЕД/л, ГГТ – 39 ЕД/л. С учетом тяжести, торпидности течения заболевания, отсутствия эффективности от ранее проведенных методов системного лечения рекомендована терапия препаратом гуселькумаб 100 мг по схеме.
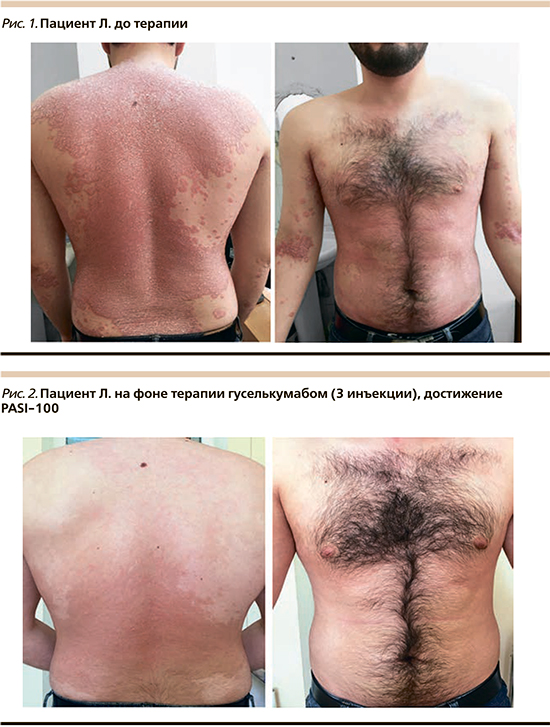
После 2 инъекций гуселькумаба отмечена положительная динамика: уменьшение папул, шелушения, инфильтрации, достижение PASI-75. После трех инъекций гуселькумаба отмечен полный регресс высыпаний, новых высыпаний нет, на месте разрешившихся элементов пятна вторичной гиперпигментации, отсутствие шелушения, достижение PASI-100 (рис. 2).
Клинический случай № 2
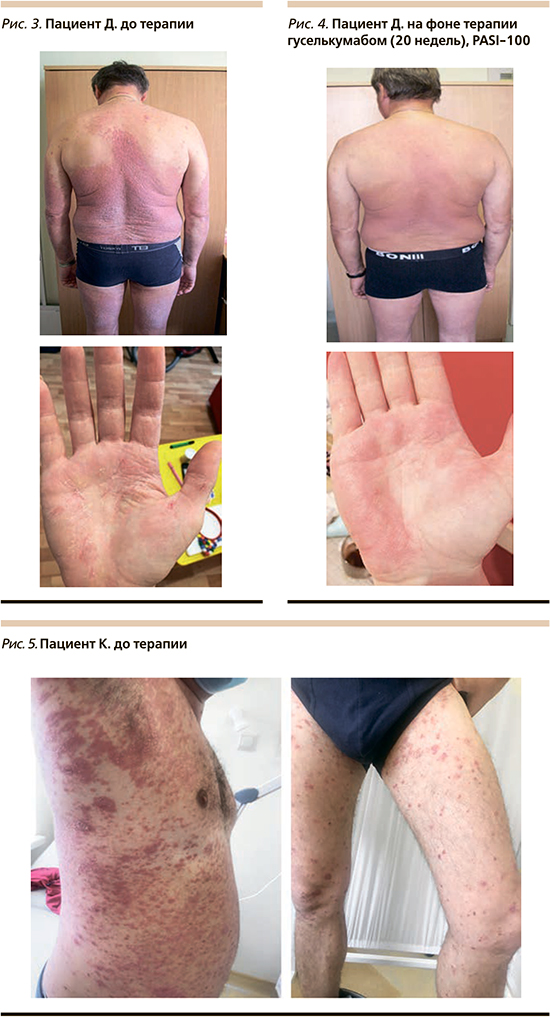
Пациент Д. 1968 года рождения болеет в течение более 20 лет. Лечился амбулаторно, периодически использовал глюкокортикоидные мази. Во время очередного обострения в 2018 г. в связи с тяжестью кожного процесса (PASI – 26 баллов) был назначен метотрексат 20 мг подкожно 1 раз в неделю в течение полугода. Отмечено незначительное улучшение через 3 месяца терапии: индекс PASI составил 19 баллов (менее PASI-50). Далее кожный патологический процесс протекал без улучшений, в связи с чем метотрексат был отменен, обострение через 3 месяца после отмены: индекс PASI 37 баллов. Пациент был госпитализирован в стационарное отделение ГБУЗ ККВД. При осмотре: на коже волосистой части головы, туловища (грудь, спина, живот), верхних конечностей (разгибательные поверхности плеч, предплечий), ладонях, нижних конечностей (передние и задние поверхности бедер, голеней) множественные, инфильтрированные по периферии папулы и бляшки ярко-красного цвета, покрытые частично прилегающими серебристыми чешуйками (рис. 3). Сопутствующая соматическая патология: гипертоническая болезнь, аритмия, атеросклероз, сахарный диабет 2 типа, ожирение 2-й степени, хронический гастрит, аутоиммунный тиреоидит. Лабораторные показатели – СОЭ 32 мм в час, С-реактивный белок 21 мг/л, АЛТ – 80 ЕД/л, АСТ – 110, ГГТ – 60 ЕД/л. Назначен гуселькумаб в дозе 100 мг в виде подкожной инъекции, вторая инъекция через 4 недели после первой с последующими введениями 1 раз каждые 8 недель. Уже к 12-й неделе терапии гуселькумабом отмечена положительная динамика: уменьшение инфильтрации папул и бляшек, шелушения, констатировано достижение PASI-75. После 4 месяцев лечения отмечен регресс высыпаний: достижение PASI-90 (рис. 4).
Клинический случай № 3
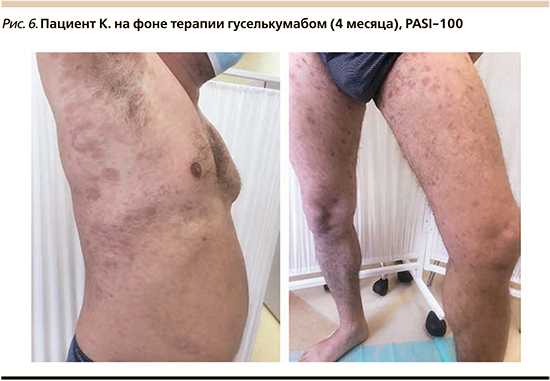
Пациент К. 1975 года рождения болеет псориазом в течение 10 лет, когда после перенесенного стресса появились высыпания на коже. Был выставлен диагноз «вульгарный псориаз, прогрессирующая стадия, индекс PASI 17 баллов». Лечился амбулаторно преимущественно с использованием глюкокортикостероидных мазей. С 2015 г. процесс носил распространенный характер (PASI более 10 баллов). Проводились курсы ацетритина, метотрексата с временным умеренным эффектом. В 2017 г. отмечаено постоянно рецидивирующее течение на фоне неэффективности системной базисной терапии: индекс PASI – 25–36 баллов. Пациент был госпитализирован в стационарное отделение ГБУЗ ККВД. При осмотре: на коже волосистой части головы, туловища, верхних и нижних конечностей множественные, инфильтрированные по периферии папулы и бляшки ярко-красного цвета (рис. 5). Сопутствующая соматическая патология: гипертоническая болезнь, аритмия, атеросклероз, сахарный диабет 2 типа, подагра. С учетом тяжести, торпидности течения заболевания, отсутствия эффективности от ранее проведенных методов системного лечения, наличия «проблемного псориаза рекомендована терапия препаратом гуселькумаб 100 мг по схеме. После необходимого стандартного обследования для исключения туберкулеза, гепатитов В и С проведена первая инъекция. После второй инъекции гуселькумаба отмечена положительная динамика: уменьшение папул, шелушения, инфильтрации, достижение PASI-50. После 6 месяцев лечения отмечен регресс высыпаний, новых высыпаний нет, на месте разрешившихся элементов пятна вторичной гиперпигментации, отсутствие шелушения, достижение PASI-100 (рис. 6). В клиническом и биохимическом анализах крови отклонений не выявлено.
Заключение
Тяжелые формы псориаза очень часто ассоциированы с коморбидной патологией. При этом коморбидная патология утяжеляет течение псориаза и снижает эффективность терапии, в частности, базисными противовоспалительными, а также биологическими препаратами. Многим пациентам с коморбидной патологией в качестве терапии тяжелого псориаза могут быть показаны препараты только биологической терапии из-за относительных противопоказаний к другим препаратам системной терапии.
Пациенты, страдающие псориазом и коморбидной патологией должны вестись дерматологами и смежными специалистами: эндокринологами, кардиологами, диетологами, врачами лечебной физкультуры для коррекции состояний, утяжеляющих течение псориаза и отрицательно сказывающихся на терапевтическом эффекте системных препаратов.
Препарат гуселькумаб активно внедряется в практику дерматовенерологов для лечения псориаза среднетяжелого и тяжелого течения. Представленные клинические случаи демонстрирует высокую эффективность препарата гуселькумаб для пациентов с коморбидной патологией. Клинические случаи демонстрируют высокую эффективность гуселькумаба в отношении достижения PASI-90 и -100 пациентами с тяжелым псориазом. Лечение переносилось хорошо, нежелательных явлений в течение терапии не выявлено.
Данные клинических исследований и практический опыт применения препарата определяют выбор гуселькумаба как препарата с лучшим на текущий период профилем эффективности, устойчивым профилем безопасности и возможности применения пациентами с сочетанной коморбидной патологией.
Вклад авторов. Круглова Л.С. – разработка концепции и дизайна, сбор, анализ и интерпретация данных, проверка критического интеллектуального содержания, окончательное согласование рукописи к публикации.
Чотко А.А., Руднева Н.С. – сбор, анализ и интерпретация данных, подготовка рукописи.
Все авторы внесли существенный вклад в подготовку работы, прочли и одобрили финальную версию статьи перед публикацией.



