Введение
В течение последних 50 лет отмечается значительное увеличение числа пациентов с глютен-зависимыми/ассоциированными заболеваниями (ГЗЗ), приобретающее характер эпидемиологически значимого явления [1–4]. Несмотря на это, ряд авторов сравнивают распространенность данной патологии с айсбергом, где число пациентов с диагностированными заболеваниями составляет верхушку, тогда как число нераспознанных случаев – основание айсберга [1].
Клинико-патогенетические варианты
Спектр патологических состояний, ассоциированных с употреблением в пищу глютена, согласно последним рекомендациям по целиакии и другим ГЗЗ Европейского общества по изучению целиакии, включает [4]:
- целиакию;
- герпетиформный дерматит;
- глютеновую атаксию;
- чувствительность к глютену, не связанную с целиакией (ЧГНЦ, Non-coeliac gluten sensitivity);
- аллергию к белку пшеницы (АБП).
Своевременное выявление ГЗЗ имеет важное прогностическое значение в связи не только с необходимостью придерживаться специализированной диеты, но и с отдаленными перспективами для здоровья.
Принимая во внимание неспецифическую клиническую картину ГЗЗ, диагностический поиск таких состояний, как ЧГНЦ и АБП, проводится с обязательным исключением целиакии [1, 4].
Определение ГЗЗ представленов табл. 1 [4–6].
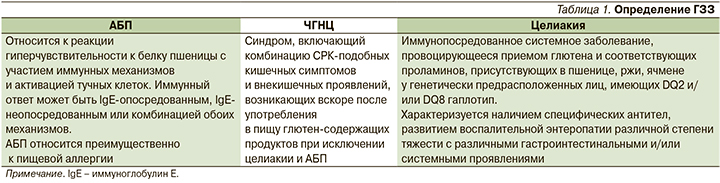
Глютен. Особенности состава
Глютен представляет собой комплекс взаимосвязанных белков запаса, содержащихся в семенах злаков, в основном проламинов и глютелинов, с высоким содержанием аминокислот пролина и глютамина (рис. 1). Подобная комбинация аминокислот делает белок нерастворимым в воде и затрудняет его переваривание в желудочно-кишечном тракте (ЖКТ) [3].
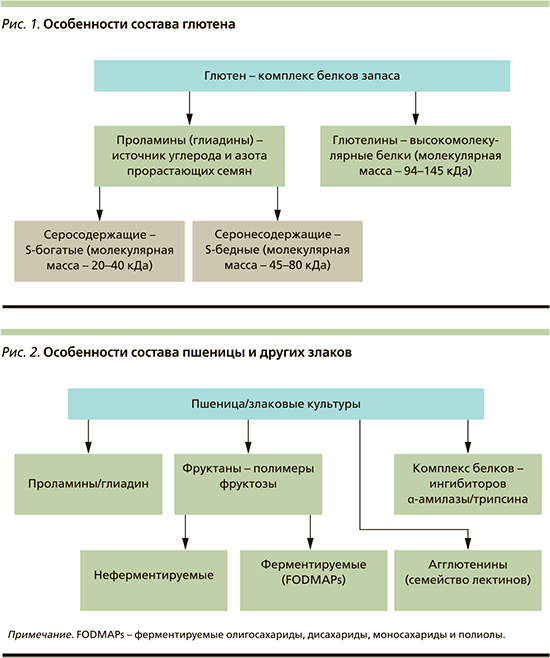
Причины высокой встречаемости ГЗЗ во многом обусловлены особенностями состава пшеницы и других злаковых (рис. 2).
Проламины нашли широкое применение в пищевой промышленности в качестве продукта, определяющего реологические характеристики теста [3, 4]. Они являются основными запасными белками пшеницы (глиадин), ячменя (гордеин), ржи (секалин), кукурузы (зеин), сорго (кафирин) и второстепенного белка в овсе (авенин) и рисе (орзеин) [3]. Количественное содержание проламинов зависит от вида злаков: у видов овса самая низкая вариабельность содержания проламинов (10–15% по массе), тогда как у пшеницы самое высокое содержание (40–50% по массе) [7].
Комплекс белков-ингибиторов относится к низкомолекулярным белкам, приводящим к активации Толл-подобных рецепторов (ТПР) 4-го типа, инициирующих Т-клеточные реакции иммунного ответа. Агглютенины – белки семейства лектинов, способствуют повышению кишечной проницаемости и активации иммунного ответа у предрасположенных людей.
Помимо белков в отдельных случаях патологические симптомы могут быть связаны с углеводным компонентом – фруктанами, представляющими собой полимеры фруктозы. Ферментируемые полимеры фруктозы с короткой цепью (фруктоолигосахариды) являются компонентом FODMAPs (fermentable oligo-, di-, monosaccharides and polyols – ферментируемые олиго-, ди-, моносахариды и полиолы). К зерновым культурам с наибольшим содержанием FODMAPs относятся пшеница и рожь [1, 8].
Факторы, влияющие на развитие ГЗЗ
Было показано, что существует ряд факторов, способствующих развитию ГЗЗ у детей. К ним относятся способ родовспоможения [9–11], инфекции, перенесенные в раннем детстве [12, 13], прием антибиотиков [14], характер вскармливания ребенка [15] и социоэкономический статус семьи [16, 17]. Однако последние крупные клинические исследования не подтвердили значения таких факторов, как способ родоразрешения и применение антибиотиков в развитии ГЗЗ [1, 18]. На основании имеющихся доказательств наибольшее значение придается предшествующим инфекциям, перенесенным в раннем детстве, независимо от локализации. Кроме того, получены данные (исследование на мышах) о роли кишечной микробиоты в инициации иммунопатологических реакций при ГЗЗ [19–23]. Одним из факторов, провоцирующих развитие ГЗЗ, может быть микробная трансглутаминаза (mTГ) – фермент, используемый в производстве продуктов питания, который обладает функциональными и антигенными свойствами тканевой трансглутаминазы (TГ2) [4, 24–26]. Было показано, что приблизительно от 6 до 9% внутриклеточной mTГ и глиадина транспортировались в эндоплазматический ретикулум энтероцитов с последующим обнаружением на базолатеральной мембране и в собственной пластинке слизистой оболочки, что предполагает возможность перекрестной презентации экзогенных антигенов [3, 27]. Имеющиеся данные подчеркивают необходимость новых направлений исследований, уточняющих значение микробиоты в патогенезе ГЗЗ, поскольку mTГ может не только передаваться с продуктами питания, но и высвобождаться бактериями кишечной микробиоты.
Общие вопросы
В настоящее время можно говорить о значительной эволюции клинических проявлений ГЗЗ в сторону преобладания легких и стертых форм заболевания (табл. 2), что затрудняет проведение дифференциальной диагностики только на основании клинических симптомов [1, 16, 18].

Для клинической картины ГЗЗ характерно отсутствие специфических клинических маркеров (табл. 3) [4].
Диагностические особенности ГЗЗ представлены в табл. 4 [4, 21, 28].
Подходы к терапии ГЗЗ
Основным направлением в лечении ЧГНЦ и АБП является элиминационная диета. Необходимо подчеркнуть, что строгая безглютеновая диета (БГД) показана только в случае целиакии. Это связано с тем, что обычно безглютеновая пища дефицитна по следующим компонентам:
- пищевым волокнам;
- тиамину;
- фолатам;
- витамину А;
- магнезии;
- кальцию;
- железу [4, 29].
В связи с этим строгое соблюдение БГД в отсутствие показаний связано с повышенными затратами и возможным риском как дефицита питательных веществ, так и чрезмерного увеличения массы тела у некоторых пациентов из-за гиперкалорийного содержания коммерческих продуктов без глютена [21].
При ЧГНЦ назначается диета с исключением пшеницы на 6 месяцев с последующей оценкой реакции организма на возвращение в питание пшеницы [30 –35]. Назначаются продукты с пониженным содержанием FODMAP (табл. 5) [12].
ЧГНЦ
Заболевание может встречаться в русскоязычных публикациях со следующим переводом – синдром непереносимости пшеницы (Wheat intolerance syndrome), нецелиакийная чувствительность к глютену.
ЧГНЦ была впервые описана в 1978 г. A. Ellis и B.D. Linaker [14] как клиническое наблюдение 43-летней женщины с гастроинтестинальными симптомами, которые исчезли после отмены продуктов, содержащих глютен, и возобновлялись при их повторном введении в отсутствие серологических и гистологических признаков целиакии.
Распространенность ЧГНЦ точно не изучена, составляет в среднем от 0,5 до 6,0% в различных странах (от 13% в Великобритании [5] до 7,3% в Австралии [20] и 0,6% в Соединенных Штатах [36]). Данные о частоте выявляемости ЧГНЦ в детской популяции практически отсутствуют, рандомизированные контролируемые исследования не проводились. Нарушение, по-видимому, чаще встречается у девочек и лиц молодого/среднего возраста [9, 44]. По данным центра, специализирующегося на помощи пациентам с целиакией и ГЗЗ, показано, что из 500 детей в возрасте от 0 до 18 лет, поступавших с 2013–2018 г., число пациентов с ЧГНЦ составило 26 (5,2%) (детей) [8]. Среди клинических проявлений у пациентов этой группы отмечались как желудочно-кишечные, так и внекишечные симптомы, связанные с приемом глютена: боли в животе (57,7%), вздутие живота (53,9%), сыпи (53,9%), диарея/жидкий стул (42,3%) и эмоциональные/поведенческие проблемы (42,3%) [8]. Обращало на себя внимание, что в отличие от пациентов с целиакией в этой группе наиболее часто выявлялся отягощенный личный (61,5%) и семейный анамнез (61,5%) по сопутствующим аллергическим/атопическим заболеваниям. Таким образом, можно заключить, что даже в специализированном центре ЧГНЦ выявляется относительно редко по сравнению с другими формами ГЗЗ.
Подозрение на данное состояние должно возникать при исключении целиакии и АБП у пациентов, находящихся на глютен-содержащем питании. Помимо глютена в качестве потенциальных виновников ЧГНЦ рассматриваются белки – ингибиторы трипсина и фруктаны [2, 12, 22, 37].
Патогенез заболевания изучен недостаточно. Ранее предполагалось, что при ЧГНЦ отсутствует активация ТПР и развитие симптомов опосредовано преимущественной активацией врожденного иммунитета. По результатам последних исследований показано, что ТПР4 могут участвовать в преобразовании эффектов глиадина через адаптерный белок фактора миелоидной дифференцировки 88 (MYD88) [17, 38–43]. Циркулирующие компоненты бактерий, такие как липополисахариды и флагеллин, связываются с ТПР4 на макрофагах и дендритных клетках с активацией MYD88-опосредованного пути с повышением выработки провоспалительных цитокинов, вызывающих системные проявления и внекишечные симптомы [7]. Предполагается, что изменения в микробиоме кишечника, вызванные потреблением глютена, также могут влиять на формирование ЧГНЦ [7]. В отличие от целиакии, при которой вырабатываются АТ к тканевым ферментам и структурам стенки тонкой кишки (аутоиммунная реакция), при ЧГНЦ АТ вырабатываются на экзогенно поступивший глиадин [7].
К характерным клиническим симптомам относят дискомфорт в животе, вздутие живота, повышенное газо-образование, диарею, усталость, головную боль, боль в суставах [6]. Среди внегастроинтестинальных симптомов наиболее часто встречаются головная боль, боли в мышцах, суставах, снижение массы тела, явления дерматита, анемии, повышенная утомляемость и поведенческие нарушения [6, 9].
В отличие от взрослых для детей характерна манифестация с гастроинтестинальных симптомов, тогда как системные проявления встречаются значительно реже. К наиболее часто выявляемым системным проявлениям относится повышенная утомляемость [15].
В клинической картине отмечается значительный перекрест симптомов между целиакией и ЧГНЦ. В то же время показано, что для ЧГНЦ в клинической картине не характерно развитие тяжелой мальабсорбции, отдаленных осложнений (например, дефицитных состояний), злокачественных новообразований, но значительно чаще, чем при целиакии, выявляются симптомы аллергии [9, 44]. Кроме того, реже выявляется аутоиммунная патология, хотя показаны высокая распространенность аутоиммунного тиреоидита и положительные тесты на АТ к ДНК. Предполагается связь между ЧГНЦ и нервно-психическими заболеваниями, такими как расстройства аутистического спектра и шизофрения [9, 29], ощущением общего плохого самочувствия [34].
В связи с тем что отсутствуют характерные биохимические, иммунологические и гистопатологические маркеры заболевания, диагноз ставится пациентам с персистирующими кишечными и внекишечными симптомами, находящимся на глютеновой диете, в отсутствие характерных серологических маркеров целиакии и пищевой аллергии (ПА). Диагностику часто затрудняет тот факт, что большинство пациентов при обращении к врачу находятся на БГД [4, 44].
Диагностика ЧГНЦ должна быть комплексной, базирующейся на наличии комбинации клинических, серологических и гистопатологических изменений: 1) определение АТ к глиадину (АТ вырабатываются к поступающему с пищей глютену), 2) определение АТ (IgA, IgG) к нативному глиадину, 3) выявление гаплотипов HLA-DQ2-HLA-DQ8, 4) биопсия (отсутствуют характерные повреждения слизистой оболочки кишечника).
По результатам наблюдения за небольшими по объему выборками показано, что у взрослых чаще выявлялись АТ (IgG, IgA) к глиадину: 56% IgG и 8% IgА по сравнению с 80% IgG и 75% IgА у пациентов с целиакией [45], с последующим снижением IgG антиглиадиновых АТ у большинства пациентов после отмены глютена.
В то же время при проведении сравнительных исследований выявлено, что АТ к глиадину выявляются достаточно часто в общей популяции. У половины пациентов с ЧГНЦ выявляется наличие HLA-DQ2/DQ8, что незначительно чаще, чем в целом в популяции (30–40%) [37, 43].
Показанием к проведению биопсии даже при отрицательных результатах серологического обследования могут быть: 1) хроническая диарея (без выделения крови), 2) диарея с симптомами мальабсорбции и потерей массы тела, 3) железодефицитная анемия в отсутствие других причин, 4) наличие симптомов белково-энергетической недостаточности [4]. У пациентов с ЧГНЦ по данным биопсии возможно выявление незначительных гистологических изменений, соответствующих по шкале оценки гистологической картине слизистой оболочки Marsh 0 или Marsh 1 [6, 37, 45]. Заболевания, имеющие сходную гистологическую картину с ЧГНЦ, представлены в табл. 6 [4].

Согласно рекомендациям по целиакии и другим ГЗЗ Европейского общества по изучению целиакии, предлагается следующий последовательный подход к диагностике ЧГНЦ [4].
Шаг 1. Провести полное клиническое и лабораторное обследование пациента для исключения целиакии и АБП на фоне обычного питания, содержащего глютен. Если у врача есть серьезные подозрения на целиакию, рекомендуется провести биопсию двенадцатиперстной кишки. В случае низкой вероятности целиакии по данным биопсии (Marsh 0–1) рекомендуются следующие шаги:
- определить исходные симптомы у пациента на глютенсодержащей диете;
- назначить БГД не менее чем на 6 недель;
- повторно оценить симптомы, ЧГНЦ исключается у субъектов, у которых не наблюдается уменьшения имевшихся симптомов.
Шаг 2 (для детей старше 5 лет).
У пациентов, отвечающих на применение БГД, и у тех, кто уже находился на БГД до обследования и желает установить диагноз, проводится провокационная проба с глютеном. В качестве провокации возможно применение обычного хлеба или других глютен-содержащих продуктов, желательно с минимальным содержанием ферментируемых олигосахаридов (FODMAP).
Помимо целиакии и АБП необходимо проводить дифференциальную диагностику с синдромом раздраженного кишечника (СРК) с диареей и СРК с запорами.
Рекомендации по диагностике ЧГНЦ суммированы ниже [4]:
- ЧГНЦ может быть диагностирована у пациента, находящегося на глютен-содержащем питании, при наличии кишечных и внекишечных симптомов, в отсутствиие маркеров целиакии и АБП (сильная рекомендация, умеренный уровень доказательности).
- Необходимо проведение серологической диагностики, гистологическое исследование биоптата слизистой оболочки тонкой кишки и HLA-DQ2-типирование у пациента, находящегося на глютен-содержащем питании, для исключения целиакии (сильная рекомендация, умеренный уровень доказательности).
- Диагноз ЧГНЦ может быть исключен у пациентов в отсутствие улучшения со стороны клинической картины после 6 недель БГД (сильная рекомендация, умеренный уровень доказательности).
- Для пациентов с ЧГНЦ возможно применение менее строгой БГД по сравнению с пациентами с целиакией (условная рекомендация, слабый уровень доказательности).
- У пациентов с отрицательной реакцией на провокацию глютеном необходимо проводить обследование для выявления другой причины появления СРК-подобных симптомов (условная рекомендация, слабый уровень доказательности).
Подходы к терапии включают прежде всего элиминационную диету (БГД). На сегодняшний день нет убедительных доказательств того, что пациентам с диагнозом ЧГНЦ следует избегать применения продуктов из ржи или ячменя.
В последующем при стойкой нормализации состояния может быть рассмотрен вопрос расширения диеты. Однако конкретные рекомендации по этому вопросу отсутствуют. Любое рассмотрение вопроса о расширении диеты требует полной уверенности в исключении целиакии. Клинический опыт показывает, что ряд пациентов с ЧГНЦ могут переносить определенное количество глютена без клинических последствий.
Отсутствуют точные данные, касающиеся возможности пациентов «перерасти» ЧГНЦ. По-прежнему недостаточно данных, чтобы определить, является ли это пожизненным состоянием (как, например, целиакия) или временным (например, ПА) [21].
АБП
Белок пшеницы является частой причиной развития ПА, IgЕ-опосредованной у предрасположенных субъектов. Вызывается, как правило, IgЕ-опосредованной реакцией на нерастворимую фракцию глиадина (ω-5 глиадин), являющегося основным аллергеном, вызывающим анафилактическую реакцию на глютен [30]. Чаще всего пациенты с АБП не реагируют на другие зерновые культуры, содержащие проламины (рожь, ячмень, овес).
По результатам недавно проведенного мета-анализа, оценивавшего распространенность АБП на основании опросников, показано, что выявляемость АБП в различных возрастных группах составляет в среднем 3,6% (95% доверительный интервал [ДИ]: 3,0–4,2), уступая по частоте встречаемости аллергии на белок коровьего молока – 6,0% (95% ДИ: 5,7–6,4) [32]. АБП обычно развивается в раннем детстве и значительно реже встречается у подростков и взрослых. Как правило, у детей с АБП выявляется аллергия и на другие пищевые продукты.
При развитии аллергической формы непереносимости белка пшеницы к наиболее сильным аллергенам относятся белки, относящиеся к сериновым протеазам (ингибитор α-амилазы/трипсина – Tri и 15-AAI мономер, Tri и 39-ингибитор серинпротеазы), агглютенины, пероксидаза, неспецифические белки переносчики липидов [1, 3]. Идентифицированы IgE-связывающие эпитопы проламина (глиадина) с наибольшим числом эпитопов (семь) у ω5-глиадина. Кроме того, IgE-связывающие эпитопы выявлены у α/β-глиадина, γ-глиадина и ω1-,2-глиадина. К основным аллергическим формам непереносимости белков пшеницы относятся: 1) классическая ПА, 2) ПА с кожным синдромом, энтеральным синдромом, респираторным синдромом, 3) анафилаксия, индуцированная физической нагрузкой, 4) астма пекаря [4].
Для АБП по сравнению с другими формами ГЗЗ характерно раннее появление симптомов, возникающих в течение от нескольких минут до 2 часов после употребления в пищу. Проявления АБП наряду с гастроинтестинальными симптомами, такими как рвота, боли в животе и диарея, включают симптомы, характерные для IgЕ-опосредованных аллергических реакций в целом: наличие кожных симптомов в виде эритемы, зуда, уртикарий и симптомов со стороны дыхательной системы: приступообразный кашель, бронхообструкция и ринорея [39]. Среди других клинических проявлений могут быть повышенная утомляемость, головные и боли в суставах, потеря массы тела [13]. Возможной манифестацией АБП может быть эозинофильный эзофагит. Анафилаксия, индуцированная физической нагрузкой, является редкой формой анафилаксии, развивающейся при приеме продуктов, содержащих белок пшеницы (непосредственно ω-глиадин), вскоре после физической нагрузки. Одновременный прием ацетилсалициловой кислоты провоцирует и утяжеляет заболевание за счет повышенного поступления антигена вследствие увеличения проницаемости кишечника.
Астма пекаря не характерна для детского возраста, поскольку сенсибилизация к белкам пшеницы в этом случае должно происходить через вдыхание антигенов. К клиническим проявлениям относят хронический кашель, астму, ринит. Клиническое улучшение наступает после прекращения взаимодействия с белком пшеницы. Тригерром, приводящим к развитию клинических симптомов, является повышенное поступление антигена ω-глиадина, тиредоксина hB и амилазы грибкового происхождения, которую добавляют в муку для улучшения качества выпечки [6].
В отличие от целиакии, которая является пожизненным заболеванием, к белку пшеницы с возрастом развивается толерантность [24]. Несмотря на то что у небольшого числа пациентов АБП может персистировать вплоть до подросткового возраста [23], долговременное поражение СО кишечника не характерно. На АБП должны быть обследованы пациенты, у которых симптомы появляются вскоре после приема продуктов, содержащих глютен.
Имеющиеся рекомендации по диагностике АБП включают следующие методы:
- Определение специфических IgE (sIgE). Аллерген-специфические IgE-АТ к белку пшеницы, как правило, появляются в первые два года жизни. В настоящее время используются различные тест-системы, из которых наиболее признаны UniCAP-Systems на базе анализаторов ImmunoCAP, обладающие высокой чувствительностью, специфичностью и воспроизводимостью результатов (Федеральные клинические рекомендации). Систематический обзор, исследовавший возможность определения специфических IgE для выявления АБП, продемонстрировал объединенную чувствительность 83% (95% ДИ: 69–92) и специфичность 43% (95% ДИ: 20–69) [40].
- Определение IgE-АТ к белкам глиадина. При оценке результатов необходимо учитывать, что повышенный уровень специфических IgE указывает на наличие сенсибилизации, но не обязательно приводит к клиническим симптомам аллергии.
- Кожные пробы. Обладают низкой чувствительностью, что связано с отсутствием в коммерческих аллергенах нерастворимой фракции глиадина. Другой проблемой является наличие ложноположительных результатов вследствие перекрестных реакций с пыльцой других трав у детей с аллергической патологией. Систематический обзор точности кожных тестов для выявления АБП продемонстрировал объединенную чувствительность 73% (95% ДИ: 56–85) и специфичность 73% (95% ДИ: 48–89) [40].
В ряде случаев перечисленные тесты могут не иметь диагностической значимости, например в случае эозинофильного эзофагита. В связи с этим в процессе диагностики необходимы тщательное изучение истории болезни, лабораторные исследования, направленные на проведение дифференциальной диагностики с другими ГЗЗ, в первую очередь исключение целиакии [39, 46, 47].
В связи с тем что кожные пробы и специфические IgE обладают относительно низкой чувствительностью и специфичностью, для подтверждения диагноза может потребоваться провокационная проба с глютеном. В идеале двойной слепой плацебо-контролируемый тест должен проводиться с соответствующими антигенами, приготовленными из экстрактов пшеницы, для наиболее точного подтверждения диагноза предполагаемой АБП. Однако сложность извлечение соответствующих антигенов и недоступность готовых аллергенов в практическом здравоохранении затрудняют ее выполнение.
В связи с особенностью патогенеза заболевания ограничительная диета у пациентов этой группы отличается меньшей «строгостью» (исключается только пшеница). Показано, что у детей с преобладанием гастроинтестинальных симптомов АБП толерантность к пшенице к подростковому возрасту формируется более чем в 75% случаев. Темпы формирования толерантности, по данным G.L. Czaja-Bulsa et al. (2014), были следующими: у 20% пациентов – к возрасту 4 лет, у 52% – к 8 годам, у 66% – к 12 и 76% – к 18 годам [10]. Время развития толерантности коррелировало с пиковым уровнем специфических титров IgE.
Перспективы разрешения АБП у детей значительно лучше, чем при других видах пищевой аллергии (на арахис, лесные орехи или кунжут), при которых толерантность формируется только у 10% детей, а непереносимость сохраняется на протяжении всей жизни.
Заключение
Таким образом, еще раз необходимо подчеркнуть, что непереносимость белка злаковых лежит в основе ряда различных по своему патогенезу глютен-ассоциированных заболеваний. Существование нецелиакийных форм непереносимости глютена осложняет диагностический процесс. Это в свою очередь обусловливает необходимость комплексного подхода к диагностике и выработке адекватной стратегии терапии.


