Введение
Заболевания, связанные с нарушением микробиоты влагалища, считаются серьезной проблемой здравоохранения во всем мире в связи с большой распространенностью, увеличением риска заражения инфекциями, передаваемыми половым путем (ИППП), высокой возможностью развития гестационных и послеродовых гнойно-воспалительных осложнений, возрастающей резистентностью к терапии, а также снижением качества жизни пациенток.
Одним из ярких примеров таких заболеваний является бактериальный вагиноз (БВ), характеризующийся нарушением микробного равновесия во влагалище. При БВ в вагинальном микробиоме определяются недостаток полезных пероксида водорода и молочной кислоты, продуцируемых Lactobacillus spp., повышение рН в щелочную сторону (>4,7) и выделения из влагалища с характерным неприятным запахом [1, 2].
G. Donders назвал БВ синдромом экологической катастрофы микробиоты влагалища [3]. Данный полимикробный синдром связан с высоким разнообразием микроорганизмов, при котором строгие анаэробные и факультативные бактерии, особенно Gardnerella vaginalis и Prevotella spp. (P. buccalis-like, P. bivia), а также A. vaginae, Mobiluncus spp. (M. mulieris, M. curtisii), Peptostreptococcus, Sneathia, L. amnionii, представители класса клостридий (бактерии, ассоциированные с бактериальным вагинозом, – ВVAB1, BVAB2, BVAB3), Eggerthella, Megasphaera (тип 1, 2), M. hominis и др. избыточно увеличивают свой рост – от 100 до 1000 раз, редуцируя лактобактерии вплоть до полного исчезновения последних [4].
Патогенная роль G. vaginalis в развитии БВ, впервые доказанная G. Gardner, в настоящее время подтверждена исследованиями, объясняющими ее вирулентность способностью образовывать биопленки, связываться с рецепторными участками вагинальных эпителиоцитов и образовывать специфические цитотоксические вещества.
Одна из современных моделей патогенеза БВ [5] представляет в качестве главного участника именно G. vaginalis, основываясь на важных фактах: фенотипическая гетерогенность микро-организма может приводить к появлению вирулентных и авирулентных штаммов; G. vaginalis способна активизировать инертных вагинальных анаэробов.
Появление культурально-независимых методов исследования позволило обнаружить микробное разнообразие G. vaginalis. С помощью молекулярных анализов генов, кодирующих белок, доказано, что сообщество G. vaginalis состоит из четырех различных видов хоть и имеющих большие различия между собой, но обладающих способностью совместно сосуществовать во влагалище при БВ. Различные генотипы G. vaginalis кодируют неодинаковую характеристику вирулентности микроорганизмов, основанную на продукции протеолитических ферментов (вагинолизин, сиалидаза и пролидаза), играющих важную роль в устранении воспаления и формирования биопленки [6]. Предполагается, что некоторые штаммы могут быть простыми комменсалами при вагинальном эубиозе, другие – часто сосуществуют во влагалище у женщин при БВ.
Но есть и противоположные мнения исследователей, считающих G. vaginalis только одним из многих микроорганизмов, способных приводить к развитию БВ [7].
В настоящее время микробиологи большое внимание уделяют одной из основных лактобактерий, L. iners, которая выявляется у женщин с БВ, в частности, с бессимптомным течением [8, 9]. Исследования последних лет продемонстрировали возможное участие этого микроорганизма в развитии БВ. L. iners, в отличие от L. crispatus и L. gasseri, является самыми слабыми продуцентами перекиси водорода и молочной кислоты, при этом производя менее полезную L-молочную кислоту, и тем самым хуже закисляет влагалище [10]. Это единственная лактобацилла, способная вырабатывать фактор вирулентности цитотоксин – инеролизин, уровень которого повышается при БВ. Данное свойство помогает L. iners быть частью биопленки, где доминирует G. vaginalis, усиливая адгезию гарднеррелл [11]. L. iners сосуществует с БВ-ассоциированными бактериями, однако имеются исследования о несовместимости одновременного присутствия L. crispatus, L. gasseri и L. iners [9].
В условиях БВ и повышения рН концентрация молочнокислых бактерий, составляющих основную массу влагалищной микробиоты здоровой женщины, резко снижается, они утрачивают свои функциональные свойства, в частности продукцию бактериоцина, перекиси водорода и молочной кислоты – самого главного антимикробного фактора. Причем из всех молочнокислых бактерий самыми активными продуцентами молочной кислоты с ее устойчивыми концентрациями являются L. crispatus [12]. Антибактериальный эффект молочной кислоты реализуется через подкисление цитозоли большинства бактерий, повышение проницаемости их мембран, что приводит к гибели этих клеток [12–14]. Вагинальная молочная кислота может существовать в двух изомерах: L и D. D-изомер молочной кислоты эффективнее защищает от уропатогенов [15]. Именно продукция молочной кислоты, а не выработка H2О2, ингибирует in vitro C. trachomatis, N. gonorrhoeae, E. coli и G. vaginalis [16, 17].
Вагинальный микробиом при БВ имеет среду с высокими уровнями провоспалительных медиаторов, связанную с повышенной восприимчивостью к ИППП и ВИЧ. Способствует инвазии патогенов нарушение целостности вагинального эпителия, которое поддерживается особыми растворимыми факторами, производимыми G. vaginalis [18].
Доказано, что пациентки с БВ имеют повышенные риски и восприимчивость урогенитального тракта к ИППП: к ВИЧ-инфекции, гонорее, хламидиозу, трихомониазу, генитальному герпесу, аногенитальным бородавкам [19, 20]. В настоящее время нет единого мнения, какие микроорганизмы при БВ могут передавать повышенные риски или механизмы, ведущие к заболеванию? Также неизвестно, какие маркеры важны для прогностической ценности, каковы точные молекулярные процессы возникновения при БВ повышенных рисков для ИППП?
До настоящего времени не решен вопрос о том, является ли БВ инфекцией, передаваемой половым путем. Чтобы решить эту проблему, необходимо обнаружить единственного этиологического возбудителя, как это происходит при бактериальных и вирусных ИППП. Это обстоятельство затрудняет отнесение БВ к венерическим заболеваниям. На современном этапе исследователями принимается во внимание только лишь факт о связи БВ с сексуальной активностью. Однако некоторые эпидемиологические данные наводят на мысль о возможности передачи БВ половым путем.
В обобщенном обзоре E. Wurapa et al. сообщается о лонгитюдных и когортных исследованиях различных групп женщин (практикующих секс с женщинами; коммерческих секс-работниц; женщин, посещающих клиники для лечения венерических заболеваний) с многочисленными формами сексуального рискованного поведения. Пациентки чаще страдают БВ, если они склонны к промискуитету, не замужем, имеют ранний дебют коитуса и высокую частоту вагинальных сношений, относят себя к коммерческим секс-работницам, практикуют регулярное спринцевание [21].
Исследователи не исключают возможность существования персистирующего передаваемого половым путем БВ с помощью фрагментов биопленок, состоящих из гарднерелл и других видов микроорганизмов [22, 23].
Предполагается, что разнообразия в микробиоте влагалища частично могут быть объяснены различиями в характере половых связей. Данные на уровне пар предполагают, что бактерии, ассоциированные с БВ, могут передаваться половым путем. Эпидемиологические исследования выявили положительную связь между беспорядочными половыми связями и распространенностью БВ. Исследования на млекопитающих в целом подтверждают связь между промискуитетом и разнообразной вагинальной микробиотой [24].
Если эта возможность когда-то будет доказана, станет понятным механизм инфицирования возбудителями ИППП наряду с БВ-ассоциированными микроорганизмами.
Скорее всего, БВ не является однородным заболеванием. Возможно, это группа гетерогенных заболеваний, и нам еще предстоит это выяснить.
Цель исследования: оценка частоты встречаемости ИППП у женщин репродуктивного возраста с бессимптомно протекающим БВ, проходящих медицинский профилактический осмотр (группа низкого риска по ИППП).
Методы
Ретроспективное поперечное исследование проводили в течение 6 лет: с 2010 по 2016 г. Под нашим наблюдением находились 115 женщин репродуктивного возраста, обратившихся на очередной профилактический медицинский осмотр в отделение профилактических осмотров ОГАУЗ «Иркутская областная клиническая больница № 8». Средний возраст пациенток составил 28,7±6,1 года, медиана – 28 лет, межквартильный диапазон – 19–46 лет.
Критерии включения:
Возраст – репродуктивный 19–46 лет.
Наличие бессимптомно протекающего БВ.
Отсутствие лейкоцитоза при микроскопии влагалищного отделяемого.
Отсутствие перорального приема антибиотиков в течение 2 месяцев.
Отсутствие вагинального применения любых лекарственных средств в течение 3 недель.
Информированное согласие на исследование.
Критерии исключения:
Выявление сифилиса, ВИЧ-инфекции.
Беременность.
Методы обследования включали:
- сбор анамнеза, в т.ч. жалоб,
- клиническое обследование (наружный осмотр аногенитальной области, бимануальное гинекологическое исследование, обследование с помощью зеркала Куско),
- оценку рН-метрии влагалищного экссудата,
- аминотест с 10%-ным раствором КОН,
- микроскопическое исследование клинического материала из уретры, заднее-боковых сводов влагалища, цервикального канала и прямой кишки при окраске по Граму,
- ПЦР-диагностику.
Микроскопию отделяемого урогенитального тракта, а также ПЦР-диагностику проводили в ООО «Иркутский городской центр молекулярной диагностики».
Методы амплификации нуклеиновых кислот
Для оценки микробиоты влагалища использовали молекулярно-биологическое исследование методом амплификации ДНК–ПЦР в реальном времени (Фемофлор, ДНК-технология (16, 12 тестов, R1-Р801-S3/6), обеспечившее количественную оценку БВ-ассоциированных микроорганизмов.
С целью идентификации возбудителей ИППП использовали:
- для выявления T. vaginalis – наборы «Трихомонас вагиналис» (ТРИХО-ГЕН), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P107-23/9);
- для выявления C. trachomatis – наборы «Хламидия трахоматис» (ХЛАМИ-ГЕН), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P101-23/9);
- для выявления N. gonorrhoeae – наборы «Нейссерия гонореи» (ГОНО-ГЕН), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P109-23/9);
- для выявления M. genitalium – наборы «Микоплазма гениталиум» (ПЛАЗМОГЕН-МГ), ДНК-технология (пробирки 0,2 96 тестов, артикул R1-P103-S3/9);
- для выявления HPV – наборы «Вирус папилломы человека» (ВПЧ-ГЕН-16/18), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P301-23/9);
- для выявления HSV – наборы «Герпес простой 1-го, 2-го типов» (ВПГ-ГЕН), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P201-23/9).
С целью идентификации условно-патогенных микроорганизмов использовали:
- для выявления U. parvum – наборы «Уреаплазма парвум» (ПЛАЗМОГЕН-УП), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P105-23/9),
- для выявления U. urealyticum – наборы «Уреаплазма уреалитикум», ДНК-технология (детекция по конечной точке FLASH, 100 тестов, артикул F1-P106-51/1),
- Набор для выделения РНК/ДНК из клинического материала, ИнтерЛабСервис (отделяемое УГТ, соскобы, моча «ДНК-сорб-АМ», ФГУН ЦНИИ эпидемиологии, 102-22).
Диагноз БВ устанавливали на основании наличия не менее чем трех из следующих четырех критериев Amsel:
- выделения из влагалища – сероватые, серовато-беловатые, однородные, с неприятным «рыбным» запахом;
- значение рН вагинального отделяемого >4,5;
- положительный результат аминотеста (появление «рыбного» запаха при смешивании на предметном стекле10%-ного раствора КОН и вагинального отделяемого в равных количествах);
- обнаружение при микроскопическом исследовании вагинального отделяемого «ключевых» клеток.
Анализ исходов исследования проведен между группами по следующим признакам: возраст, бактериальная масса, условно-патогенная микробиота (УПМ).
Общую группу пациенток (n=115) мы разделили на 6 групп по сочетанию БВ и определенного облигатного патогена:
1-я группа (n=10) – сочетание БВ и C. trachomatis (БВ/CT), 2-я группа (n=2) – сочетание БВ и T. vaginalis (БВ/TV), 3-я группа (n=15) – сочетание БВ и M. genitalium (БВ/MG), 4-я группа (n=13) – сочетание БВ и HPV (БВ/HPV), 5-я группа (n=62) – БВ, 6-я группа (n=13) – сочетание БВ и нескольких безусловных патогенов (CT, TV, MG, HPV, NG).
Также мы проанализировали шесть групп пациенток по количественному выявлению ключевых клеток (КК) при микроскопическом исследовании:
- КК в количестве 70–100% в поле зрения,
- КК в количестве 40–60% в поле зрения,
- КК в количестве от единичных до 30% в поле зрения,
- отсутствие КК в препарате.
Статистический анализ
Статистическая обработка результатов исследования проводилась с помощью пакетов прикладных программ Microsoft Ехсеl и SТАТISТIСА 6.1 (серийный номер AXXR010E749701FA). Для характеристики переменных были использованы методы вариационной статистики. Проверку на нормальность распределения количественных признаков проводили с помощью критериев согласия Колмогорова–Смирнова и Шапиро–Уилки. Так как выборки характеризовались преимущественно неправильным распределением, для оценки достоверности различий между признаками двух выборок (средними количествами условно-патогенной микробиоты) вычисляли непараметрический критерий Манна–Уитни.
В качестве средних величин при оценке количеств отдельных групп УПМ использовали медианы абсолютного количества микроорганизмов в геномных эквивалентах (ГЭ) и долю исследованного микроорганизма в общей бактериальной массе.
При решении классификационных задач, оценки качества классификации и выбора наиболее информативных признаков были использованы методы многомерного статистического анализа, в основном модули дискриминантного анализа. Различия сравниваемых показателей интерпретировали как достоверные при минимальном уровне значимости p≤0,05.
Результаты
В настоящем исследовании мы провели количественную оценку условно-патогенной БВ-ассоциированной микробиоты в зависимости от выявленных истинных патогенов урогенитального тракта на фоне отсутствия лейкоцитоза при микроскопии отделяемого влагалища и отсутствия жалоб у пациенток.
Указанные пациентки были разделены на 6 групп в зависимости от выявленных безусловных патогенов (табл. 1).
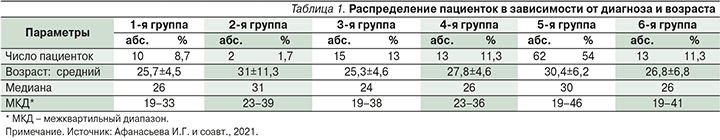
Частота выявления безусловных патогенов приведена на рис. 1.
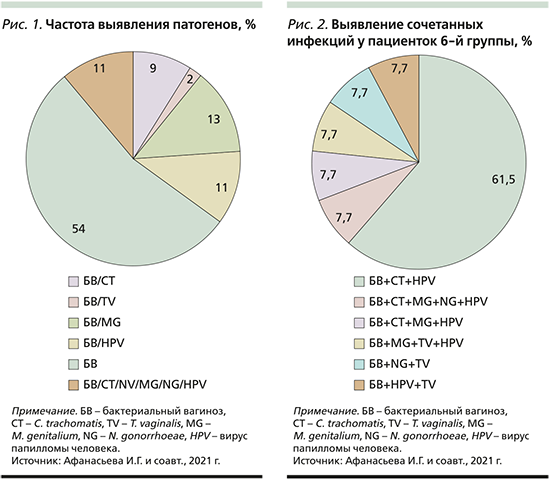
Сочетанные инфекции выявлены у 13 (11,3%) человек. Превалировала ассоциация БВ/CT/HPV (8 пациенток; 61,5%). У 1 (7,7%) отмечена комбинация из 4 патогенов на фоне БВ (CT+MG+NG+HPV), также по 7,7% случаев имели место сочетания БВ+CT+MG+HPV, БВ+MG+TV+HPV, БВ+NG+TV, БВ+HPV+TV (рис. 2).
Мы провели сравнительный анализ результатов оценки микробиоты в разных группах на основании микроскопического обследования и ПЦР-диагностики в реальном времени с помощью диагностической системы «Фемофлор-16» (табл. 2).
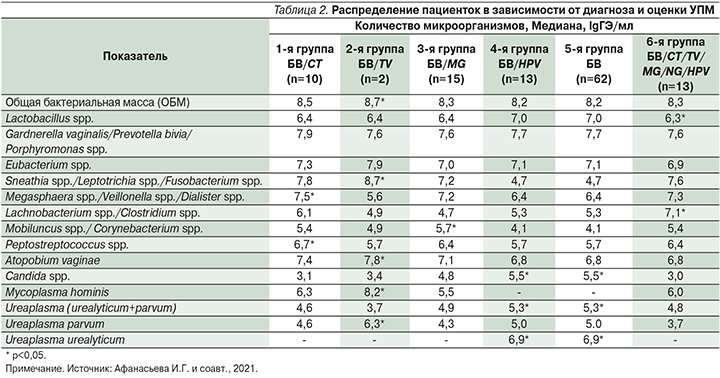
Во всех группах пациенток констатирован анаэробный дисбаланс, вызванный преимущественно анаэробными микроорганизмами. Обращает на себя внимание избыточное количество микроорганизмов во всех исследуемых группах (от 8,2 до 8,7). Увеличение общей бактериальной массы служит неблагоприятным фоном в связи с увеличением доли анаэробной микробиоты и снижением доли лактобацилл, характеризующих выраженный дисбаланс.
Уровни лактобактерий относительно общей бактериальной массы были снижены во всех группах, причем достоверно сильнее (6,3) в 6-й группе с сочетанными инфекциями вплоть до полного исчезновения последних. Во всех группах отмечено массивное количество G.vaginalis/P.bivia/Porphyromonas spp. (7,9 – 7,6) и A. vaginae (7,8 – 6,8). В 3–5-й группах регистрировались повышенные уровни грибов рода Candida spp., при этом микроскопически Candida не определялась. Уровни уреаплазм (Ureaplasma (urealyticum+parvum), U. рarvum, U. urealyticum) во всех исследуемых группах были >104 lgГЭ/мл.
Мы провели сравнительный анализ пациенток шести групп, отразивший наличие или отсутствие ключевых клеток (КК) при микроскопическом исследовании (табл. 3).
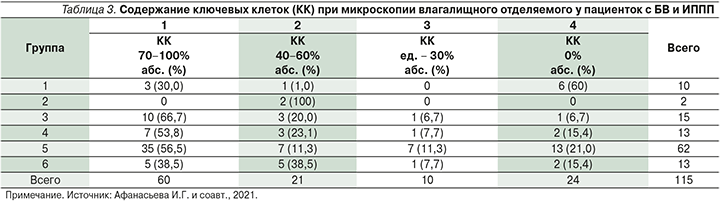
Анализ количества КК в поле зрения при микроскопии у пациенток шести групп показал, что у наибольшего числа женщин этот показатель был в пределах 70–100% клеток, что достаточно характерно для БВ. Вместе с тем были и такие пациентки, у которых КК при микроскопии не выявлялись, но диагноз БВ был поставлен на основании трех других критериев Амселя.
Мы поставили перед собой вопрос о возможности использовать количество КК для прогнозирования выявления у пациенток с бессимптомным БВ возбудителей ИППП. Для этого мы провели сравнительный анализ содержания КК в препаратах в группе пациенток с БВ и общей группе женщин с БВ, сочетанным с ИППП (рис. 3)
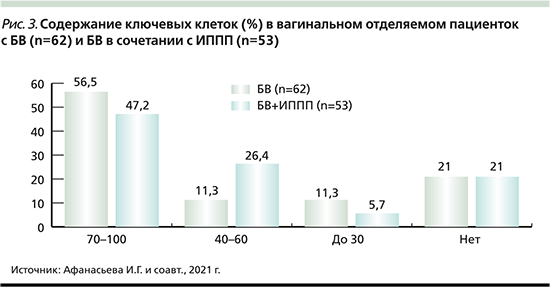
У одинакового числа (21,0%) пациенток обеих групп КК в препаратах выявлено не было. По средним количествам КК (от единичных до 30% и от 40 до 60%) никакой закономерности установить не удалось. У наибольшего числа пациенток обеих групп содержание КК в препарате было в пределах 70–100%. Совершенно очевидно, что количество КК не может быть ориентиром для прогнозирования выявления ИППП у пациенток с бессимптомным БВ.
Обсуждение
Почти у половины (46%) пациенток с бессимптомной формой БВ были обнаружены облигатные патогены. Уровень лактобацилл был значительно снижен вплоть до полного отсутствия в 6-й группе с сочетанными инфекциями. Во всех группах отмечалось избыточное количество общей бактериальной массы. Опираться на процентное содержание КК при микроскопии как на показатель прогнозируемости ИППП нельзя.
При обследовании на наличие облигатных патогенов пациенток с бессимптомным БВ возбудители ИППП обнаружены почти у половины (46,1%) пациенток. Это заставляет задуматься о том, что, не обследуя «здоровых» женщин с бессимптомным БВ на истинные патогены, мы можем пропускать ИППП и способствовать усилению эпидемиологической цепочки в передаче половым партнерам. При этом необходимо сделать важное замечание: все выявленные ИППП у пациенток также протекали бессимптомно. Такие пациентки не будут обращаться за медицинской помощью и не будут получать лечение.
Когортные исследования, проведенные среди женщин с высоким риском, показали связь между БВ и хламидийно-гонококковой инфекцией и указывают, что БВ служит фактором риска развития гонококковой или хламидийной инфекции у женщин [25]. Однако вариантов может быть много: и одновременная передача инфектов (в случае, если БВ является ИППП), и развитие БВ после факта заражения ИППП. Возможно, БВ, снижая местный иммунитет, «прокладывает дорогу» истинным патогенам, или это отдельные заболевания (ко-инфекция, микст-инфекция), сопутствующие друг другу? Выводы имеющихся исследований противоречивы и до сих пор рождают вопросы. В связи с этим необходимы надежные эксперименты.
Микробный пейзаж у всех пациенток соответствовал выраженному анаэробному дисбиозу с достоверно значительным снижением вплоть до полного исчезновения Lactobacillus spp. в 6-й группе с сочетанной инфекцией. При этом несколько чаще КК обнаруживались у женщин, не имевших возбудителей генитальных инфекций, но вместе с тем у 21,0% женщин с БВ КК в препаратах не определялись. Возможно, диагностическая ценность КК как биомаркера при верификации бессимптомного БВ невелика. Однако, по данным А. Swidsinski, присутствие КК предполагает существование полимикробной биопленки, которая состоит преимущественно из G. Vaginalis-биопленок [26]. Необходимы последующие уточняющие исследования.
Остается загадкой: почему на фоне бессимптомных ИППП не было обнаружено лейкоцитоза при микроскопии генитального отделяемого? Либо это дебют заболеваний и воспалительная реакция еще не успела развиться, либо, наоборот, их длительное и тяжелое течение? Или, как известно, нейтрофилы при БВ подавляются ферментами многочисленной анаэробной микробиоты?
Изучение микробиоты у пациенток с бессимптомными ИППП/БВ позволило выявить следующие особенности: достоверно часто определялись повышенные уровни G.vaginalis/P.bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrichia spp./Fusobacterium spp., Megasphaera spp./Veillonella spp./Dialister spp. и A. vaginae. Эти результаты соответствуют данным L. Masson et al. о повышенных уровнях этих микроорганизмов при БВ-ассоциированных заболеваниях [27].
Возможно, истинные патогены «извлекают выгоду» из дисбиотического вагинального микробиома, в котором они находятся. Вместе с тем комбинация микроорганизмов может существенно изменять их вирулентность и патогенность, особенно когда они живут в биопленке.
Выявленные облигатные возбудители ИППП у пациенток с бессимптомным БВ являются настораживающей «находкой». В рутинной практике гинеколога и дерматовенеролога, на медосмотрах легко пропустить подобных пациенток, назначив им лечение по поводу БВ.
При этом клиника БВ регрессирует, а через какое-то время рецидивирует, потому что назначенная терапия не имела этиологического фокуса.
G.G. Donders предупреждает: «…нужно быть очень осторожным, чтобы не пропустить такие инфекции (имеются в виду ИППП), т.к. лечение БВ не ослабит эти симптомы, а может, по сути, даже ухудшить их» [3]. Обследовать таких пациенток на ИППП не входит в стандарт ОМС и тяжелым финансовым бременем ложится на плечи пациентки.
Возможно, путаница, преувеличение роли и распространенности БВ, а также высокая частота рецидивов связаны с невыявленными ИППП, а не с истинным БВ? При этом лечение, которое проводят при БВ, не направлено на элиминацию безусловных патогенов. Может оказаться, что БВ в определенных случаях является биомаркером ИППП.
Патоморфоз ИППП на современном этапе касается почти всех заболеваний. Венерические заболевания протекают в стертых, атипичных и хронических формах, не имея патогномоничных симптомов. Не совсем понятно, с чем это может быть связано. Возможно, микроорганизмы таким образом приспосабливаются к новым условиям жизни современного человека, реагируя на применение «хозяином» антимикробных, антивирусных, иммунотропных препаратов, тип питания, современные условия проживания и т. д.
Согласно данным, полученным в настоящем исследовании, концентрация уреаплазм (Ureaplasma (urealyticum+parvum); U. parvum; U. urealyticum) во всех исследуемых группах была выше 104 lgГЭ/мл.
Выявление M. hominis во 2-й группе БВ/TV соответствует данным литературы, объясняется физиопатологией и динамикой взаимодействия между двумя микроорганизмами [28]. Этот вид молликутов является симбионтом T. vaginalis. M. hominis обладает способностью проникать в клетки трихомонад путем эндоцитоза и размножаться в координации с простейшим хозяином. Сочетание M. hominis–T. vaginalis характеризуется более быстрой скоростью роста. Недавно секвенирование вагинального микробиома выявило новый вид микоплазмы – M. girerdii, которая, учитывая строгую ассоциацию между ней и T. vaginalis, является облигатным симбионтом простейшего [29, 30].
БВ – скорее всего гетерогенное заболевание с множеством вариантов. Может быть, прав был Р. Кох: при наведении фокуса на микроорганизмы, возможно, найдется какой-то один микроорганизм, ответственный за развитие того или иного варианта БВ? И можно ли вообще познать БВ до конца? Вряд ли. Надежду дает только то, что число научных открытий в исследовании микробиома влагалища не прекращаются.
Заключение
У 53 (46,1%) из 115 женщин с бессимптомным БВ, не предъявлявших жалоб, проходивших периодический медицинский осмотр, были выявлены ИППП. Во всех исследуемых группах пациенток установлен выраженный влагалищный анаэробный дисбиоз, что является неблагоприятным фоном. Концентрация лактобактерий была снижена у всех пациенток, однако достоверно наиболее снижена (вплоть до полного исчезновения) в группе пациенток с микст-инфекциями. Наши данные не конечные, необходимо продолжать исследования в этом направлении.
Настоящее исследование продемонстрировало, что при выявленном бессимптомном БВ необходимо тестирование на ИППП. Не исключено, что бессимптомный БВ может быть маркером истинных ИППП, которые нуждаются в скорейшем лечении обоих половых партнеров. Возможно, это будет одним из направлений стратегии улучшения контроля над ИППП.


