Введение
В настоящее время псориаз рассматривается как хроническое системное воспалительное заболевание с иммуногенетической основой, обусловленное как аутоиммунными, так и аутовоспалительными реакциями [1]. Визуальные проявления болезни могут обнаруживаться не только на коже, но и на ногтевых пластинах, имеют значительную индивидуальную вариацию по локализации, площади вовлечения и характеру элементов [2]. Наиболее частой формой, встречающейся среди 85–90% больных, является бляшечный псориаз, характеризующийся четко очерченными эритематозными инфильтрированными папулами и бляшками, покрытыми серебристо-белыми чешуйками и обычно локализующимися на кожных покровах волосистой части головы, поясничной и параумбикальной областей, а также разгибательных поверхностей локтевых и коленных суставов [3, 4]. Наблюдаемые эффлоресценции отражают главные патогенетические процессы, лежащие в основе данного дерматоза, а именно: воспаление кожных покровов, неконтролируемую пролиферацию кератиноцитов и неоангиогенез как следствие нарушения регуляции иммунных реакций кожи [5]. Широкий спектр провоспалительных медиаторов не ограничивается только кожными покровами, т.к. признаки воспаления обнаруживаются и вне таковых. Данным фактом объясняют ассоциацию псориаза с многочисленными коморбидными состояниями, включая метаболический синдром, сердечно-сосудистые, желудочно-кишечные и психические заболевания [6].
На основании клинических проявлений псориаз первоначально расценивался как исключительно кожное, связанное с нарушением дифференцировки кератиноцитов заболевание. В середине 1980-х гг. в результате случайных наблюдений терапевтической эффективности применения циклоспорина, а позже трансплантации костного мозга, приведших к положительной динамике со стороны псориатических высыпаний, произошел значительный сдвиг парадигмы патогенеза [7]. Последующая работа была сосредоточена на идентификации и характеристике различных подмножеств Т-клеток, обнаруженных в коже и крови больных [8]. Основываясь на выявлении повышенной экспрессии таких цитокинов, как интерферон-γ (ИФН-γ), фактор некроза опухоли-α (ФНО-α) и ИЛ-12 в очагах поражения, ранние модели патогенеза предполагали, что псориаз является управляемым T-хелперами (Th – T-helpers) 1-го типа процессом [7, 9]. В конце 1990-х гг. был идентифицирован новый димерный цитокин, разделявший общую для ИЛ-12 субъединицу p40, но также содержавший уникальную p19, впоследствии названную ИЛ-23 [8]. ИЛ-23 стимулировал выработку ИЛ-17 из подгруппы CD4+-Т-клеток, которые были отрицательны по экспрессии как ИФН-γ, так и ИЛ-4, открытие, которое бросало вызов традиционной системе классификации Th1-Th2 [8]. Позже было показано, что ИЛ-23 индуцирует выработку ИЛ-17 активированными Т-лимфоцитами, названными впоследствии Th17 [8]. Обнаружение повышенных уровней ИЛ-17 и -23 в псориатических поражениях и высокая эффективность таргетного воздействия на них позволили идентифицировать псориаз как смешанную Th1/T17 болезнь [7].
Лекарственные средства при псориазе
История развития патогенеза псориаза отражается в лекарственных средствах, вводимых в практику в тот или иной период. Несмотря на расширение знаний, классические системные агенты и более ранние таргетные препараты и по настоящее время остаются актуальными в лечении псориаза.
В клинической практике вопрос о выборе тактики терапии в основном продиктован федеральными клиническими рекомендациями. В целом пациент с псориазом считается подходящим кандидатом для системной терапии, когда распространенность высыпаний превышает 10% площади поверхности тела, болезнь затрагивает особые области, такие как кожа головы или гениталий, и/или местная терапия не принесла результата. Последние годы при оценке необходимости системного лечения все больше внимания уделяется влиянию болезни на качество жизни больного, оцениваемое в клинической практике с использованием дерматологического индекса качества жизни DLQI (Dermatology Life Quality Index). Текущие руководства по лечению рекомендуют традиционные системные препараты или фототерапию в качестве лечения первой линии при псориазе средней и тяжелой степеней тяжести, тогда как биологический препарат применяется в качестве лечения второй линии в случае неэффективности, непереносимости или противопоказаний к применению традиционных системных средств [10, 11].
С учетом частого наличия сопутствующих заболеваний и негативного влияния кожных проявлений на психическое здоровье особое значение приобретают эффективность и безопасность терапии, главным образом потому, что у 50% пациентов болезнь манифестирует в возрасте до 30 лет и они могут нуждаться в медицинской помощи на протяжении десятилетий [12]. Однако из-за потенциальных рисков нежелательных явлений (НЯ) и кумулятивной токсичности системных препаратов до начала лечения требуется индивидуальная оценка риска и пользы для каждого пациента. Для обеспечения оптимального анализа и принятия сбалансированных решений важную роль приобретает понимание долгосрочных профилей безопасности и ожидаемых результатов доступных системных методов терапии [10].
Циклоспорин А (ЦсА) – это липофильный циклический полипептид, первоначально выделенный из гриба Tolypocladium inflatum. ЦсА связывается с цитоплазматическими белками, известными как циклофилины, и этот комплекс конкурентно связывается и ингибирует кальциневрин. Это приводит к снижению транскрипции ИЛ-2, ФНО-α, ИЛ-3 и -4, ИФН-γ и гранулоцитарно-макрофагальных колониестимулирующих факторов с последующим снижением уровней активированных Т-лимфоцитов [13]. ЦсА не влияет на функцию фагоцитарных клеток, не вызывает угнетения костного мозга, а его действие на иммунокомпетентные лимфоциты обратимо [14].
В клинической практике ЦсА преимущественно применяется короткими курсами продолжительностью от 12 до 24 недель для индуцирования ремиссии [15]. Мета-анализ 3 крупных рандомизированных клинических исследований (РКИ) продемонстрировал, что после 10–12 недель лечения ЦсА в дозах 1,25, 2,5 и 5 мг/кг/сут. наблюдалось снижение показателей PASI на 44,4%, 69,8 и 71,5% соответственно. Среднее время, необходимое для достижения по крайней мере 50%-ного снижения PASI от исходного уровня (PASI-50) составляло 4,3 недели для дозировки 5 мг/кг/сут., 6,1 недели для 2,5 мг/кг/сут., и 14,1 недели для самой низкой дозы. Возможности долгосрочной курсовой терапии ЦсА показаны в ретроспективном анализе с участием 193 больных со средним периодом наблюдения, составляющим 14 месяцев. В течение этого периода пациентами было проведено от 1 до 4 курсов приема ЦсА, средний показатель – 1,6, с вариациями дозирования лекарственного средства от 1,5 до 3,1 мг/кг/сут. PASI-50 был достигнут 91,3% пациентов, PASI-75 – 73,9% [16].
Лечение ЦсА имеет соотношение риска и пользы, которое считается приемлемым для краткосрочного лечения или в случаях, когда возможности использования иных методов терапии ограниченны. ЦсА может быть менее приемлемым для пациентов с повышенным риском некоторых серьезных НЯ, включая почечную недостаточность или гипертензию (например, пожилые пациенты) [10]. Соотношение риска и пользы ЦсА можно улучшить, изменив подходы к дозированию, используя в сочетании с другими видами лечения псориаза (например, топическими средствами) и сохранив кумулятивное время применения менее 2 лет [10, 17].
Метотрексат – это антиметаболит группы структурных аналогов фолиевой кислоты, оказывающий влияние на синтез нуклеиновых кислот за счет блокирования дигидрофолатредуктазы и ряда других ферментов [18]. Ингибируя синтез ДНК, метотрексат ограничивает эпителиальную гиперплазию, усиливает апоптоз активированных Т-клеток и подавляет хемотаксис нейтрофилов. Кроме того, препарат отвечает за снижение образования ряда провоспалительных цитокинов, таких как ФНО-α, ИЛ-1 и -6 [19, 20].
Еженедельная доза метотрексата обычно составляет от 7,5 до 25 мг с рекомендуемой максимальной дозой 30 мг/нед. [21]. Для улучшения переносимости назначают препараты фолиевой кислоты в дни, свободные от приема метотрексата [20]. Несмотря на длительный клинический опыт применения этого препарата, перечень крупных надежных исследований его эффективности и безопасности крайне ограничен [22]. Согласно ретроспективным исследованиям применения в реальной практике, терапия метотрексатом в дозировке 10–20 мг/нед. способствовало достижению ответа PASI-75 у 40–49% пациентов на 12-й неделе, 47–62% на 24-й и у 38–81% больных к концу первого года лечения [23].
Помимо значительной индивидуальной вариабельности в ответе на метотрексат до 30% пациентов прекращают лечение из-за НЯ, включающих диспепсические явления, гепатотоксичность, угнетение функции костного мозга и интерстициальные заболевания легких [24]. Также препарат является тератогеном и абортивным средством, что требует эффективных методов контрацепции на протяжении всего периода лечения и в последующие 3 месяца после прекращения как мужчинами, так и женщинами [21]. Тем не менее метотрексат имеет приемлемый профиль соотношения риска и пользы, продолжает играть важную роль в системной терапии псориаза [10]. Корректировки дозы и/или пути введения способны улучшить переносимость лечения [25].
Ацитретин – это ретиноид второго поколения, который проявляет свою антипсориатическую активность за счет модуляции пролиферации кератиноцитов и противовоспалительных путей [10]. Влияя на экспрессию генов, ацитретин ингибирует выработку кератиноцитами вазоэндотелиального фактора роста и может оказывать ряд противовоспалительных эффектов, включая уменьшение миграции нейтрофилов в эпидермис, ингибирование индуцированной ИЛ-6 активации Th17-клеток и способствование дифференцировке регуляторных Т-клеток [26].
Ацитретин характеризуется дозозависимым эффектом и в качестве монотерапии используется по 25–50 мг/сут.
Как и в случае с метотрексатом и ЦсА, число крупных исследований, оценивающих терапевтический потенциал данного ретиноида при псориазе, весьма ограничено [22]. Результатами 12-недельных РКИ с участием 80 больных стали ответы PASI-75 в группах дозирования 25, 35 и 50 мг/сут. у 47%, 69 и 53% пациентов соответственно [27]. Данные результаты резонируют с клиническим опытом, указывающим на наименьшие эффективность и скорость наступления клинически значимого ответа ацитретина по сравнению с остальными традиционными системными агентами [10, 21].
Из-за раннего появления и дозозависимости НЯ индивидуальное титрование дозы препарата обычно продиктовано не эффективностью, а переносимостью лечения. К наиболее частым НЯ отноятся сухость слизистых оболочек и кожных покровов, кожный зуд, шелушение ладоней и подошв, алопеция. Длительная терапия может быть также ограничена из-за потенциальных гепатотоксичности и гиперостоза, хотя доказательства возникновения последних неоднозначны. На основании тератогенного потенциала настоятельно рекомендуется женщинам репродуктивного возраста использовать эффективные противозачаточные средства на весь период лечения и в течение минимум 2 лет после отмены ацитретина [10]. Оказывая незначительное влияние на иммунную систему, ацитретин может быть полезен в определенных популяциях. Например, у пациентов с высокими кумулятивными дозами ультрафиолетового излучения в анамнезе или проживающих в эндемичных регионах [26].
Первыми генно-инженерными биологическими препаратами (ГИБП), зарегистрированными для терапии псориаза, стали ингибиторы ФНО [28]. Эффект антагонистов ФНО-α связывают с их косвенным влиянием на передачу сигналов ИЛ-17 посредством регуляции продукции ИЛ-23 из миелоидных и CD11c+-дендритных клеток [8]. В связи с широким пулом как продуцирующих, так и чувствительных клеток ингибирование ФНО-α рассматривается как таргетная терапия, но с более широко представленными мишенями по сравнению с более современными ГИБП, используемыми в терапии псориаза [29]. В настоящее время для лечения псориаза средней и тяжелой степеней тяжести одобрено четыре блокатора ФНО, а именно этанерцепт, инфликсимаб, адалимумаб и цертолизумаб [30].
Этанерцепт представляет собой рекомбинантный белок рецептора ФНО-α человека, соединенный с Fc-фрагментом иммуноглобулина G1 (IgG1), который конкурентно связывается со свободной и мембраносвязанной формами рецепторов ФНО [31]. Согласно ряду исследований, частота ответа PASI-75 через 12 недель при различных режимах варьируется от 10 до 28% при дозе 25 мг 1 раз в неделю, 26–39% при дозе 25 мг 2 раза в неделю и 35–54% при дозе 50 мг 2 раза в неделю [4]. Результатами 24-недельных РКИ стали показатели PASI-75 у 44% из тех, кто получал 25 мг 2 раза в неделю, и 59% при приеме 50 мг дважды в неделю [32]. Относительно низкая эффективность препарата по сравнению с иными ГИБП компенсируется подтвержденным временем высоким уровнем безопасности при применении в гериатрической и педиатрической популяциях больных псориазом, что позволяет этанерцепту сохранять свою актуальность и в настоящее время [31].
Адалимумаб – рекомбинантное, полностью гуманизированное моноклональное антитело, которое связывается с ФНО-α и блокирует взаимодействие с обоими его рецепторами на клеточной поверхности с высокой аффинностью и специфичностью. Ряд исследований демонстрирует дозозависимую эффективность адалимумаба со следующими результатами к 12–16-й неделям терапии: при введении 40 мг каждые две недели показатели PASI-75, -90 и -100 были получены от 57,9–79,6, 43 и 16,7–19% пациентов соответственно. Первоначальный прием 80 мг в неделю 0, а затем по 40 мг каждые 2 недели позволил достичь PASI-75 62,8% больных, а использование 80 мг каждые 2 недели – 81% [4]. Расширенное открытое исследование III фазы показало, что 76% пациентов с ответом PASI-75 или более на 16-й и 33-й неделях исследования сохраняли PASI-75 после 160 недель непрерывного лечения [33].
Инфликсимаб представляет собой химерное моноклональное антитело, состоящее из мышиного вариабельного участка и константного фрагмента человеческого IgG1-α, которое проявляет свое нейтрализующее действие путем связывания как с растворимыми, так и с трансмембранными молекулами ФНО-α [31]. В конце 10-недельного индукционного периода показатель PASI-75 определяется у 65,8–79,6% пациентов [4]. Результатами более продолжительных наблюдений использования инфликсимаба в дозе 5 мг/кг на 0-й, 2-й и 6-й неделях с последующим использованием каждые 8 недель стали ответы PASI-75 со стороны 53,6–56,8 и 66,3% больных на 50-й и 98-й неделях соответственно [34].
Цертолизумаб представляет собой моновалентный гуманизированный Fab-фрагмент антитела, конъюгированный с полиэтиленгликолем, который ингибирует ФНО-α дозозависимым образом. В РКИ III фазы 81,6% пациентов, принимавших цертолизумаб, смогли достичь PASI-75 к 16-й неделе, что делает его более эффективным по сравнению с другими ингибиторами ФНО-α. Уникальная структура цертолизумаба, заключающаяся в отсутствии Fc-фрагмента, позволяет использовать препарат в период беременности, т.к. он имеет минимальную способность проникать через плаценту и в грудное молоко [31].
Несмотря на более высокую эффективность препаратов данного класса по сравнению с классическими системными агентами, большинству пациентов они не обеспечивают полного контроля заболевания. Кроме того, нередко пациенты прекращают лечение ингибиторами ФНО из-за потери ответа и возникновения НЯ [28]. Это подтверждают результаты мета-анализа «выживаемости» блокаторов ФНО в реальной практике. Так, только 66% больных продолжают терапию этанерцептом к концу 1-го года, к концу 4-го их число уменьшается до 41%. Приверженность лечению адалимумабом и инфликсимабом через год оценивается как 69 и 61%, через 4 года – как 47 и 42% соответственно [35]. В связи с относительно коротким периодом от регистрации препарата для лечения бляшечного псориаза таковые сведения для цертолизумаба в литературных источниках не обнаружены.
Тем не менее ингибиторы ФНО характеризуются хорошей переносимостью, а возникающие НЯ обычно не требуют отмены препарата. Наиболее частые НЯ, присущие всем анти-ФНО-агентам, – это головные боли, реакция в месте инъекции или инфузии, кожные высыпания, анемия, повышение уровня печеночных трансаминаз, инфекции верхних дыхательных путей, синусит, кашель, фарингит, диарея, тошнота и боль в животе. К редким серьезным НЯ относятся тяжелые инфекции (сепсис и оппортунистические инфекции, такие как туберкулез), злокачественные новообразования (например, лимфома и немеланомный рак кожи), рассеянный склероз, волчаночноподобный синдром и декомпенсация сердечной недостаточности [36].
Устекинумаб представляет собой человеческое моноклональное антитело IgG1, нацеленное на общую для ИЛ-12 и -23 белковую субъединицу p40. В отличие от блокаторов ФНО устекинумаб специфически воздействует на важные в патогенезе псориаза сигнальные пути ИЛ-12/Th1 и -23/Th17 [29].
Дозирование устекинумаба зависит от массы пациента: для пациентов с массой тела менее или равной 100 кг доза устекинумаба составляет 45 мг, с массой тела более 100 кг – 90 мг. Два РКИ III фазы продемонстрировали, что индукционный период, включающий введение препарата на 0-й и 4-й неделях, способствует достижению ответа PASI-75 на 12-й неделе со стороны 66,4 и 75,7% пациентов. При непрерывном использовании устекинумаба каждые 12 недель после завершения индукционного периода ответы PASI-75 на 28-й неделе были получены со стороны 78,5 и 78,6%. Завершили 5-летние РКИ устекинумаба 68,7 и 70% пациентов, при этом 72 и 78,6% имели ответ PASI-75 [29]. Сообщаемая «выживаемость» устекинумаба в клинической практике – 82 и 56% к 1-му и 4-му годам использования соответственно [35]. Устекинумаб менее эффективен, чем ингибиторы ИЛ-17 и -23. Кроме того, у некоторых пациентов может наблюдаться ухудшение кожного процесса на третьем месяце межинъекционного периода [31].
Длительные наблюдения указывают на возможный более безопасный профиль устекинумаба по сравнению с ингибиторами ФНО-α без повышения рисков серьезных инфекций и злокачественных новообразований по сравнению с плацебо [29]. Наиболее частые НЯ: инфекции верхних дыхательных путей, артралгия, головная боль и эритема в месте инъекции. Они обнаруживались с одинаковой частотой в группах плацебо и устекинумаба и не зависели от дозы последнего. Серьезные инфекции были редкими и включали целлюлит, опоясывающий лишай и дивертикулит [37].
Апремиласт – это малая молекула, принадлежащая к семейству ингибиторов фосфодиэстеразы-4 [38]. Блокада фосфодиэстеразы-4 приводит к повышению внутриклеточного уровня циклического аденозинмонофосфата, таким образом влияя на активность протеинкиназы А. Последствия включают ингибирование ядерного транскрипционного фактора κB и как следствие – снижение продукции провоспалительных медиаторов, таких как ФНО, ИФН-γ, ИЛ-12 и -23 [12].
В клинической практике апремиласт назначают перорально по 30 мг 2 раза в сутки [38]. В двух РКИ на 16-й неделе PASI-75 был зафиксирован у 33,1 и 28,8% пациентов [15]. При непрерывном применении апремиласта в течение 104 недель показатель PASI-75 был достигнут 45,9% больных [39].
Долгосрочные клинические испытания апремиласта с последующим наблюдением до 3 лет показали, что к наиболее частым НЯ относятся тошнота, диарея, инфекции верхних дыхательных путей и головная боль. Сообщалось о связи с повышенным риском депрессии, суицидальных мыслей и поведения, а также с потерей массы тела. Тем не менее в ходе длительных исследований частота депрессии не увеличивалась с течением времени, а среднее изменение исходной массы тела составляло всего -1,53 кг за 3 года [10].
Апремиласт имеет благоприятный долгосрочный профиль безопасности. Продолжительность лечения не влияет на распространенность НЯ. Рекомендуется клиническая бдительность при наличии депрессии и суицидальных мыслей [10].
Совсем недавно биологические препараты, нацеленные на сигнальный путь ИЛ-17, были внедрены в клиническую практику [28]. Помимо прямого влияния на ключевой цитокин в патогенезе псориаза ингибиторы ИЛ-17 способствуют нормализации экспрессии широкого спектра генов иммунного ответа, включая IL22, IL17A, IL17F, IFNG, IL12B, TNF, IL1B, IL6, что может определять их высокую эффективность [40]. К данному классу лекарственных средств относятся секукинумаб, иксекизумаб и нетакимаб.
Секукинумаб стал первым ингибитором ИЛ-17A, одобренным в качестве лечения пациентов с псориазом. Это полностью человеческое моноклональное антитело IgG1, избирательно связывающее и нейтрализующее ИЛ-17A. Применение секукинумаба предусматривает индукционный период, при котором 300 мг препарата вводятся на 0-й, 1-й, 2, 3 и 4-й неделях, и последующий поддерживающий период – введение 300 мг каждые 4 недели. Секукинумаб имеет самый длинный послужной список в плане безопасности при использовании в реальных условиях из всех ингибиторов ИЛ-17. Его высокая эффективность сохраняется и при лечении особых локализаций, таких как псориаз кожи головы, ладонно-подошвенной области, а также псориатической ониходистрофии [31].
Иксекизумаб представляет собой гуманизированное моноклональное антитело IgG4 к ИЛ-17A [29]. Использование препарата предусматривает введение в дозировке 160 мг на 0-й неделе и 80 мг на 2-й, 4, 6, 8, 10 и 12-й неделях, в поддерживающий период 80 мг вводят каждые 4 недели. Ответы по PASI к концу индукционного периода позволяют расценивать иксекизумаб как наиболее быстродействующий ГИБП [31]. Как и секукинумаб, иксекизумаб показал свою эффективность при псориатических эффлоресценциях в трудноподдающихся терапии участках [29].
Нетакимаб – гуманизированное моноклональное антитело IgG1, нацеленное на ИЛ-17A. Эффективность и безопасный профиль препарата подтверждены как в РКИ IIB-фазы, так и в клинической практике [43, 44].
Общей особенностью этих таргетных препаратов является их быстрый клинический эффект. Все ингибиторы ИЛ-17 имеют аналогичный профиль безопасности, сопоставимый с другими утвержденными для лечения псориаза ГИБП. В отличие от блокаторов ФНО увеличения риска возникновения или реактивации туберкулеза не наблюдалось. Уникальным для этой биологической группы является повышение частоты регистрируемых слизисто-кожных инфекций, вызванных дрожжами рода Candida, в основном легкой или средней тяжести, и легко поддающихся лечению. Имеются ограничительные рекомендации по применению данных препаратов у пациентов с воспалительными заболеваниями кишечника [45].
Другой класс ГИБП, предлагающий столь же высокие показатели клиренса псориатических высыпаний, нацелен на ИЛ-23 [28, 42]. Блокада данного цитокина оказывает негативную регуляцию на провоспалительные T17-клетки и более эффективна, чем нацеливание на общую для ИЛ-12 субъединицу p40 [46]. В клинических исследованиях ингибиторов ИЛ-23 подтверждено их превосходство в достижимых клинических ответах над устекинумабом и анти-ФНО агентами [28]. К представителям класса относятся гуселькумаб и ризанкизумаб.
Гуселкумаб представляет собой полностью человеческое моноклональное антитело IgG1λ, которое ингибирует субъединицу p19 ИЛ-23. Режим использования включает введение 100 мг на 0-й и 4-й неделях и поддерживающую дозу 100 мг каждые 8 недель [31]. Имеются публикации, указывающие на успешно лечение, в т.ч. при локализации высыпаний на голове, ладонях, подошвах и при вовлечении ногтевых пластин [47].
Рисанкизумаб представляет собой гуманизированное моноклональное антитело IgG1, избирательно нацеленное на субъединицу p19. Его вводят в дозе 150 мг подкожно на 0-й и 4-й неделях с последующей поддерживающей дозой 150 мг каждые 12 недель [31].
Профили безопасности ингибиторов ИЛ-23 на данный момент выглядят благоприятными и сопоставимыми с блокаторами ИЛ-17 [37]. Ни одно из клинических испытаний ингибиторов ИЛ-23 III фазы на сегодняшний день не показало повышения риска возникновения и/или обострения воспалительных заболеваний кишечника и кандидозных инфекций [48].
Новые ГИБП, нацеленные на сигнальный путь ИЛ-23/T17, демонстрируют самую высокую эффективность среди всех системных агентов. Результатами РКИ, оценивающими данные агенты, стали ответы PASI-75 со стороны 65–90% пациентов на 12-й неделе терапии и достижение PASI-100 более чем 40% больных к концу первого года лечения, хотя данные о более долгосрочных результатах для большинства препаратов все еще ограниченны [29, 31, 42, 49–53].
С момента внедрения в клиническую практику ГИБП подняли планку терапевтических результатов при лечении псориаза, даже несмотря на то что они не эффективны во всех случаях, и сообщалось о потере ответа с течением времени [54]. Накоплены существенные доказательства, подтверждающие значительные преимущества более чистой кожи и значимый отрицательный эффект остаточных псориатических эффлоресценцй на качество жизни пациентов. Следовательно, как указывалось ранее, важно понимать профиль долгосрочной эффективности и безопасности терапии, в особенности способность обеспечивать свободную от высыпаний кожу в течение длительного времени [55]. В контексте данной проблемы и малой освещенности препарата в отечественной литературе нами демонстрируется клинический случай успешного длительного применения ингибитора ИЛ-17 иксекизумаба пациентом с бляшечным псориазом тяжелой степени тяжести.
Клинический случай
Пациент М. 63 лет наблюдается в отделении дерматовенерологии и косметологии Поликлиники № 1 УДП РФ с диагнозом «бляшечный псориаз». Болен более 25 лет, заболевание характеризуется тяжелой степенью тяжести, частыми обострениями и рефрактерностью к топическому лечению и узкополосной средневолновой ультрафиолетовой терапии. Пациент отягощен рядом ассоциированных с псориазом заболеваний, таких как ишемическая болезнь сердца, дислипидемия, атеросклеротический кардиосклероз, атеросклероз брахиоцефальных артерий, гипертоническая болезнь II стадии, метаболический синдром.
Состояние пациента до начала системной терапии: патологический кожный процесс носит хронический воспалительный характер, распространенный, симметричный, мономорфный. Локализуется на кожных покровах туловища с преимущественным вовлечением боковых поверхностей и поясничной области, разгибательной поверхности верхних конечностей, кистей, а также нижних конечностей. Представлен застойно-красными папулами и бляшками неправильных округлых очертаний размером до 10 см, умеренно инфильтрированными, с плоской поверхностью, покрытой серебристо-белыми, плотно спаянными, мелкопластинчатыми чешуйками. Триада Ауспитца положительна. Ногтевые пластины стоп изменены тотально, резко утолщены за счет подногтевого гиперкератоза грязно-желтого цвета. На ногтевых пластинах кистей определяются симптомы «наперстка» и «масляного пятна». Субъективно пациента беспокоит выраженный зуд в области высыпаний. PASI – 34,9, DLQI – 15 баллов.
На основании тяжести течения псориаза, наличия предикторов псориатического артрита и значительного влияния на качество жизни пациенту назначена генно-инженерная биологическая терапия препаратом иксекизумаб.
После проведенной первой инъекции препарата уже на 14-е сутки отмечено улучшение кожного процесса в виде умеренного уплощения папул и бляшек на кожных покровах поясничной области, конечностей и боковых поверхностей туловища, отсутствия шелушения на поверхности высыпаний поясничной области и значительное уменьшение интенсивности зуда.
Динамика кожного процесса до лечения и на фоне терапии иксекизумабом представлена на рис. 1, 2.
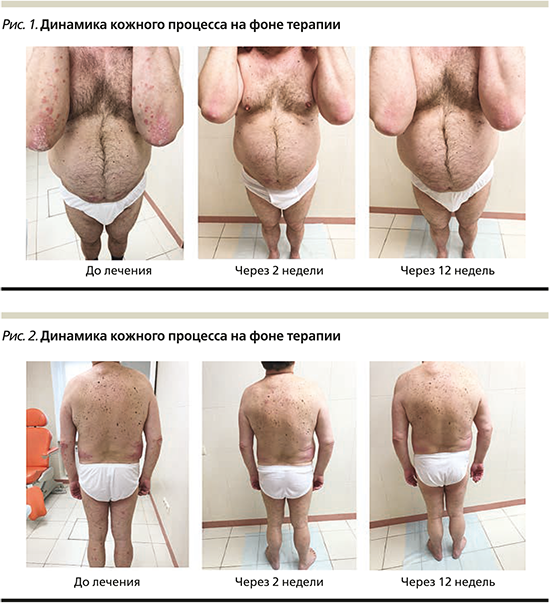
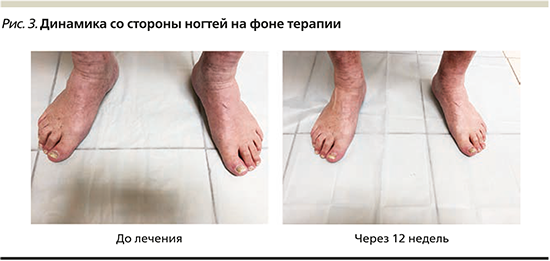
По завершении инициирующего курса иксекизумабом наблюдалось выраженное уплощение и исчезновение псориатических бляшек на коже туловища и конечностей и присутствие немногочисленных красноватых пятен с незначительным мукоидным шелушением. Отмечен рост видимо неизмененных ногтевых пластин. Отсутствие зуда.
На рис. 3 пациент на 12-й неделе терапии.
Результаты. До лечения показатели PASI составляли 34,9, на 2-й неделе терапии – 20,4, на 12-й – 2,4, на 20-й неделе был достигнут ответ PASI-100, сохраняющийся по настоящее время (более 68 недель).
До лечения значения DLQI составляли 15 баллов, что отражает очень сильное влияние кожного заболевания на жизнь пациента, после 1-й инъекции также сохранялись 10 баллов, после 7-й – 5, после 10-й – 0 баллов. То есть заболевание перестало негативно воздействовать на повседневную жизнь пациента и ограничивать ее. Результат сохранялся и в последующем периоде лечения.
Отмечалась хорошая переносимость препарата, из заявленных НЯ у пациента имелись кратковременные симптомы острого респираторного заболевания на 5-й неделе применения ГИБП, которые не потребовали изменений в тактике лечения. Сохранение высокой социальной активности в период эпидемии новой коронавирусной инфекции 2019 г. не стало причиной как прекращения применения ГИБП, так и инфицирования пациента.
Заключение
Открытие сигнального пути ИЛ-23/T17 и значительный терапевтический прогресс, достигнутый за последние два десятилетия, сделали псориаз одним из наиболее эффективно излечиваемых хронических воспалительных заболеваний во всей медицине [8]. Биологические препараты, направленные на эту сигнальную ось, демонстрируют наиболее высокие показатели результативности, безопасности и удовлетворенности пациентов [17].
Быстрый клинический ответ и подтвержденная долгосрочная эффективность позволяют отдельно выделить из данного ряда лекарственных средств иксекизумаб. Так, иксекизумаб – один из немногих представителей блокаторов ИЛ-17, имеющий опубликованные результаты 5-летней эффективности [55]. Данные факты в совокупности с результатами нашего клинического случая позволяют рассматривать иксекизумаб как один из рекомендуемых системных агентов для долгосрочного лечения пациентов с бляшечным псориазом среднетяжелой и тяжелой степенями тяжести.


