Введение
К сложным косметическим дефектам кожи лица можно отнести посттравматические рубцы, включая послеоперационные и ожоговые, а также травматические татуировки. Вышеуказанные патологические изменения зачастую приводят к серьезным визуальным недостаткам, сопровождающимся тревогой, депрессией и социальной дезадаптацией [1, 2]. Пациенты с ожоговыми рубцами сообщают, что избегают общественных мест, чувствуют себя непривлекательными и сексуально нежелательными из-за своей проблемы, скрывают рубцы даже от людей, находящихся в близких с ними отношениях [3].
Серьезным осложнением при наличии рубцов в области лица будет развитие контрактур височно-нижнечелюстного сустава и эктропиона век [4]. До 87% пациентов с ожоговыми рубцами, особенно гипертрофическими, сообщают о наличии выраженного зуда, нарушающего сон и повседневную деятельность. Исследования показали, что это может быть опосредовано воспалительными факторами, а также повышением количества в ткани рубца субстанции P, действующей на нервные окончания [5].
Механизмы образования травматической татуировки включают взрывы пороха и бытового газа, которые часто происходят при неправильном обращении с фейерверками или нарушении техники эксплуатации соответствующих устройств, дорожно-транспортные происшествия, минно-взрывные ранения в условиях войны и террористических актов. Частицы пороха и инородные тела в коже не опасны для жизни. Они, тем не менее, представляют собой неотложную ситуацию, потому что только при своевременном и квалифицированном лечении последствия для пациента могут быть критически минимизированы. Важно помнить о необходимости удаления частиц грязи в остром периоде (на открытой ране). После заживления и полной эпителизации сделать это не представляется возможным. Дополнительная опасность травматической татуировки состоит в возможности образования гранулемы инородного тела, гипертрофических и келоидных рубцов [6].
Традиционные методы лечения рубцов включают силиконовый гель, компрессионную одежду, инъекции кортикостероидов, массаж и хирургические манипуляции, однако все они в большинстве случаев оказываются недостаточно эффективными [7–10]. Применявшиеся методы лечения травматической татуировки – дермабразия и хирургическое иссечение – не позволяют удалять нежелательную пигментацию без рубцов и выраженной дисхромии кожи [11, 12]. Современные лазерные технологии в варианте монотерапии или комбинации с другими методами демонстрируют высокий потенциал для лечения как рубцовых изменений, так и травматической татуировки.
В связи с этим мы проанализировали возможности применения и эффективность различных лазерных систем в плане коррекции рубцовых изменений и удаления травматических татуировок по данным зарубежной литературы. Поиск осуществляли в базах данных PubMed и Google Shcolar с использованием набора ключевых слов «laser and scars» и «laser and traumatic tattoo» за период с 2000 по 2021 г.
Применение лазерных технологий в лечении посттравматических рубцов
Многочисленные исследования показали уменьшение зуда, толщины рубца, эритемы, нейропатической боли и необходимости хирургического иссечения, а также улучшение пигментации рубца, податливости, текстуры, термочувствительности, контрактуры, функции и общего качества жизни благодаря лазерному лечению [13–15].
Рубцы с разной степенью зрелости могут улучшаться даже после первой процедуры применения лазера. Работа при этом может быть направлена на поверхностные слои (эпидермис, дермо-эпидермальное соединение) для сглаживания кожи или на глубокие с целью уменьшить натяжение и вызвать ремоделирование дермы с аномальным коллагеном. Часто врачи могут адаптировать терапию, воздействуя на эпидермис, дерму или комбинацию обоих слоев кожи в зависимости от характеристик рубца [16].
Классификация рубцов по дисхромии (эритема, гипер-/гипопигментация) и толщине рубца или атрофии служит способом упростить методы определения наиболее подходящих лазеров в зависимости от индивидуальных характеристик рубца [17]. Они подразделяются на абляционные и неабляционные (работающие полным лучом), фракционные (абляционные и неабляционные), а также сосудистые в зависимости от целевого механизма действия [18].
Абляционные и неабляционные лазеры
Абляционные лазеры приводят к повреждению (испарению) поверхностных слоев кожи с последующим ремоделированием коллагена. Импульсные СО2-лазеры были первыми высокоэффективными абляционными лазерами, но при этом очень часто отмечалось развитие побочных эффектов в виде мокнутия, образования корок и дискомфорта от жжения. Долгосрочными осложнениями были изменения окраски кожи, рубцы и инфекции [19]. Появление эрбиевых лазеров, работающих на длине волны 2940 нм, частично решило проблему безопасности из-за минимальной зоны термического повреждения тканей, что привело к ускорению заживления ран, однако их эффективность оказалась ниже, чем у предшественников [20].
Неабляционные лазеры были разработаны для защиты эпидермиса и избирательного повреждения дермы. При этом электромагнитное излучение лазера должно иметь достаточно большую глубину оптического проникновения [21]. Применение данных установок привело к выигрышу в плане реабилитации по сравнению с абляционными лазерами, но и проигрышу в эффективности. И абляционные, и неабляционные лазеры в классическом варианте применения вызывают однородное тепловое повреждение на заданной глубине (работа полным лучом) [18].
Фракционные лазеры
Концепция фракционного фототермолиза впервые описана в 2004 г. как способ сбалансировать эффективность абляционных лазеров и безопасность неабляционных лазеров. Фракционные лазеры поддерживают селективность фототермолиза, избирательно воздействуя на определенные молекулы, поглощающие энергию заданной длиной волны, и создавая в коже микроскопические отверстия (колонки). Глубина микроскопических колонок колеблется от 0,2 до 4,0 мм.
Плотность лазерных лучей определяет количество термальных колонок в пределах обрабатываемой площади, а все промежуточные области состоят из неповрежденной кожи [18]. Окружающая непораженная кожа становится источником жизнеспособности, способствуя неоколлагеногенезу и ремоделированию тканей. Это уменьшает толщину и улучшает податливость гипертрофических рубцов, обеспечивая расширение объема движений в задействованных суставах [14].
При гистологическом исследовании рубцы, обработанные фракционными лазерами, демонстрируют почти полное восстановление нормальной структуры эпидермиса (эпидермальных отростков) и дермы (коллагеновых волокон), а также уменьшение воспаления и ангиогенеза через 6 месяцев после лечения [22].
Существует две разновидности фракционных лазеров – неабляционные и абляционные. Неабляционные фракционные лазеры (НАФЛ) делают колонны коагулированной ткани, состоящей из денатурированного коллагена, оставляя нетронутым эпидермис. Температура ткани в зоне воздействия повышается до 50–70°С.
С другой стороны, абляционные фракционные лазеры (АФЛ) создают столбы испаренной ткани с окружающим струпом и коагулированной тканью. Температура кожи в зоне воздействия повышается выше 100°С. НАФЛ имеют длину волны от 1540 до 1550 нм и материал активной среды эрбиевое стекло (Er: Glass). АФЛ в качестве активной среды могут использовать углекислый газ (СО2-лазер с длиной волны 10600 нм) или легированный эрбием иттрий-алюминиевый гранат (Er: YAG-лазер с длиной волны 2940 нм) [13].
НАФЛ показали хорошую эффективность при лечении рубцов с признаками дисхромии [23]. Хороший профиль безопасности позволяет использовать НАФЛ на всех участках тела с минимальным временем послеоперационного восстановления. Традиционно НАФЛ применяется в лечении гипертрофических рубцов от легкой до умеренной степени тяжести, в первую очередь затрагивающих эпидермис и сосочковую часть дермы. Тяжелые гипертрофические рубцы с вовлечением ретикулярной дермы и подкожно-жировой клетчатки часто требуют применения АФЛ [24].
АФЛ сочетают короткую длительность импульса с высокой энергией для повышения эффективности за счет использования тепла и образования микроколонок в коже. Высокие температуры вызывают большую, чем НАЛФ, степень ремоделирования дермы [25]. Белки теплового шока, металлопротеиназы и воспалительные цитокины участвуют в процессе быстрого заживления в течение 48 часов после абляции, чтобы заполнить испаренные столбики эпидермальными клетками и восстановить целостность кожи [26]. Образование нового коллагена приводит к уменьшению коллагена типа I и увеличению коллагена типа III [27]. Добавление коллагена III типа изменяет архитектуру дермы за счет увеличения гибкости, уменьшения толщины и улучшения молекулярной функции [27, 28]. Это приводит к значительному улучшению свойств рубцовой ткани [29–32].
Было показано, что АФЛ улучшают многочисленные характеристики ожоговых рубцов. В крупном исследовании Kawecki et al. [33], использовавшем Ванкуверскую шкалу рубцов [34] в качестве объективной меры, 31% пациентов имели разрешение эритемы с результирующим нормальным тоном кожи, 61% – преобразование гипертрофических рубцов в нормотрофические и 40% – полное размягчение рубцов после фракционной абляционной лазерной терапии.
Также применение АФЛ восстанавливает объем движений в суставах из-за устранения рубцовых контрактур [35] и даже может улучшать биодоступность лекарственных средств в ходе наружной терапии. Так Waibel et al. с положительным эффектом применили наружно суспензию триамцинолона непосредственно после абляционной лазерной обработки для улучшения доставки лекарственного средства в более глубокие слои кожи. Данный прием может усиливать противовоспалительное действие кортикостероидов при лечении гипертрофических рубцов [36].
Сосудистые лазеры
Для лечения рубцов в основном используются импульсные лазеры на красителях (PDL – pulsed dye laser), которые генерируют тепловую энергию с использованием длин волн около 595 нм. Такое излучение селективно действуют на микрососуды, вызывая их коагуляцию, что в конечном итоге приводит к уменьшению воспаления и отека. К дополнительным эффектам относятся уменьшение зуда, пигментации, гипертрофии и нейропатической боли в зоне образования рубца [37]. Избирательное разрушение кровеносных сосудов приводит к гипоксии тканей и катаболизму коллагена. Коллаген ремоделируется с уменьшением суммарного объема, что приводит к выравниванию кожи [38]. PDL проникает в кожу на меньшую глубину в сравнении с АФЛ. В связи с этим PDL используется в лечении незрелых тонких гипертрофических рубцов толщиной менее 1 см, сосудистой эритемы, участков с минимальным натяжением. Данные лазеры не изменяют структуру рубца и не приводят к ремоделированию коллагена, как АФЛ [17].
Оптимальное время для лазерной терапии
До недавнего времени считалось, что лазеры следует использовать только после достижения полного созревания рубца. Последние данные свидетельствуют: раннее начало применения НАФЛ или АФЛ уже через месяц после ожога или хирургической травмы может уменьшать симптомы, контрактуры, повышать подвижность рубца и улучшать процесс реабилитации [17, 39]. Тем не менее пока точно неясно, когда лучше всего начать лазерную терапию. Большинство стратегий зависит от характеристик созревания рубца. Количество процедур может варьироваться от 1 до 9 с интервалом от 4 недель до 3 месяцев [40]. В ряде исследований после хирургического лечения PDL, НАФЛ и АФЛ применялись в день снятия швов или спустя несколько недель с хорошими результатами и без развития побочных эффектов [41–43]. В связи с этим начало лазерной терапии как можно раньше после хирургического иссечения следует считать оправданным подходом [13].
Побочные эффекты лазерного лечения рубцов
Побочные эффекты лазерного лечения можно разделить на три группы: незначительные, умеренные и тяжелые [44]. Незначительные побочные эффекты варьируются от боли, эритемы и отека до инфекции, экхимозов и волдырей. Умеренные осложнения включают гипер- и гипопигментацию, в то время как серьезным побочным эффектом следует считать образование новых рубцов. Частота этих нежелательных явлений не зависит от возраста рубца на момент лечения или общей площади повреждений [45].
Применение Q-switched-лазеров
Лазерные системы, работающие по неабляционному принципу, могут использоваться в разных диапазонах длительности импульса. Q-switсhed – это режим, при котором длительность импульса измеряется в пико- или наносекундном диапазоне. В данном случае время взаимодействия лазерного луча и ткани обеспечивает механизм работы по типу фотоакустического удара, что приводит к дроблению ткани-мишени до мельчайших частиц (молекулярного уровня). Данный вид лазерного воздействия применяется при работе с татуировками и гиперпигментациями [39]. Поскольку некоторые рубцы имеют признаки дисхромии, работа в Q-switсhed-режиме позволяет убирать нежелательную пигментацию и существенно улучшать внешний вид дефекта.
Одной из последних технических новинок является использование неабляционного лазера, например Nd: YAG c длиной волны 1064 нм, в фракционном абляционном режиме за счет возможности генерации пакетного наносекундного импульса большой энергии (до 10 Дж). В данном случае отверстия в коже сопровождаются радиальными разрывами тканей. Данный эффект может приводить к дополнительному повреждению плотных коллагеновых волокон (образование микрорассечений). Применение вышеуказанного режима пока не исследовалось на предмет клинической эффективности, но несомненно представляет большой практический интерес.
В связи с этим представляем клинический случай успешного комплексного лечения послеоперационных рубцов в области лица.
Пациентка В. 50 лет обратилась в послеоперационном периоде (30 дней) с жалобами на образование эктропиона обеих нижних век вследствие формирования патологических послеоперационных рубцов.
Диагноз – «эктропион обеих нижних век. Экхимоз нижних век, распространяющийся на область щек. Рубцовая деформация кожи нижних век».
Локальный статус: процесс носит распространенный характер, наблюдается эктропион обеих нижних век, более выраженный справа, как следствие образования патологической рубцовой ткани. На коже нижнего левого века имеется округлый послеоперационный шрам диаметром 1 см. Отмечается экхимоз обеих нижних век, распространяющийся на область щек (рис. 1).
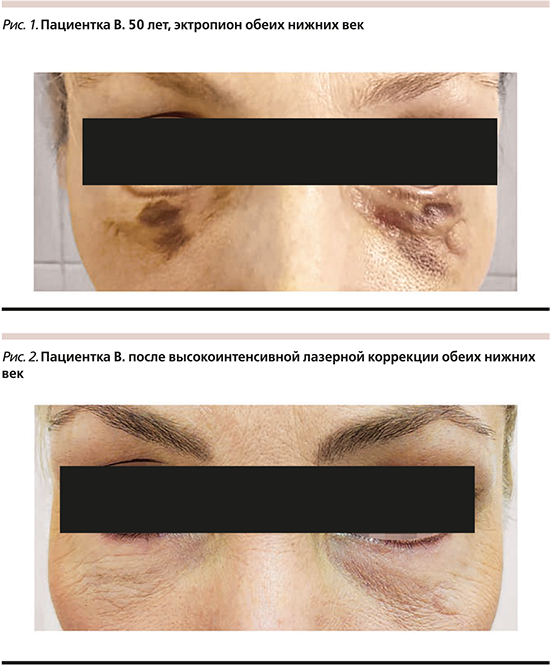
Протокол лечения: работа выполнялась с применением лазерной системы Fotona StarWalker MaQX. Процедура выполнялась в два этапа: один проход неодимовым Q-switch-лазером во фракционном режиме для работы с рубцовой тканью, позволивший сделать в коже микроотверстия (9*9/9 px/mm); второй этап: разрушение пигмента в Q-switch-режиме. Параметры лазерной системы, использованные для работы по заданной проблеме: 1064, MaQX – 1, FS20A, 1,0 Hz, 3,5 mJ/px; NdYAG 1064 Nm/KTP 532 Nm; MaQX-1, 0,7 дж/см, 0,5 Гц, количество проходов –1, выполнено две процедуры с интервалом в месяц.
Перед процедурой проводилась подготовка с применением крема Эмла и в процессе использовался аппарат Zimmer Cryo для охлаждения. Длительность реабилитационного периода продолжалась до полного восстановления, после процедуры отмечалась гиперемия, отечность держались в течении 5 дней (рис. 2).
Пациентка помимо высокоинтенсивной лазерной терапии получала следующие дополнительные препараты:
1. Дипроспан 1 мл в зону рубцовой ткани каждого века № 2 с интервалом 1 месяц;
2. Ультразвуковое введение ферменкола – 2 курса (№ 15) с интервалом 1 месяц;
3. Аутогемотерапия (Ахмеров) № 10;
4. Бепантен;
5. SPF-50.
Применение лазерных технологий для лечения травматической татуировки
Q-switсhed-лазеры (QS-лазеры) – наиболее подходящие системы для выведения очень мелких гранул краски и других чужеродных частиц. QS-лазеры (рубиновый, александритовый и Nd: YAG) излучают импульсы большой мощности с очень короткой длительностью (нано- или пикосекундный диапазон). Быстрое тепловое расширение вызывает фрагментацию и как следствие – образование акустических волн, которые распространяются в окружающие ткани. Фотомеханический и фотоакустический эффекты способствуют лазерному механизму удаления татуировок. Частицы татуировки удаляются фагоцитарными клетками и выводятся через лимфатическую систему и трансэпидермальные отверстия (при использовании фракционного режима). QS Nd: YAG также подходит для лечения травматических татуировок у пациентов с более темной кожей [47, 48].
Оригинальное техническое решение по «объединению» характеристик пико- и наносекундного импульса предложила компания Fotona. Была разработана новая технология формирования импульса ASP (Adaptive Structured Pulse) с лазерным генератором TMD (Transverse Mode Discrimination), позволившая получать наносекундный пакет, состоящий из высокоэнергетических пикосекундных импульсов, с недостижимой ранее энергией в 10 дж (гибридный импульс MaQX).
В дополнение решена и другая проблема, возникавшая при удалении татуировки, а именно образование газового пузыря под эпидермисом после первого прохода очага поражения.
В результате последующие Q-switched-импульсы не достигают глубоко расположенного пигмента и как следствие – теряется эффективность, возрастает риск осложнений, увеличивается количество процедур, удлиняется курс лечения. С целью устранения данного негативного эффекта предложено при первом проходе использовать аблятивную фракционную манипулу (FS20A) для «просверливания» микроотверстий, через которые происходит сброс давления газа, а также выделение продуктов распада микрочастиц (запатентованная технология FracTatTM). Таким образом, одна процедура выполняется в два этапа. Первый этап – делается один проход аблятивным фракционным неодимовым Q-switched-лазером, второй – выполняются проходы Q-switched-лазером, использующим гигантский структурированный наносекундный импульс (полным лучом, манипула R28).
Представлен клинический случай лечения травматической татуировки лица по вышеописанному протоколу.
Пациент 37 лет обратился с жалобой на приобретенный в результате травмы дефект в виде множественного точечного изменения кожи лица (рис. 3).
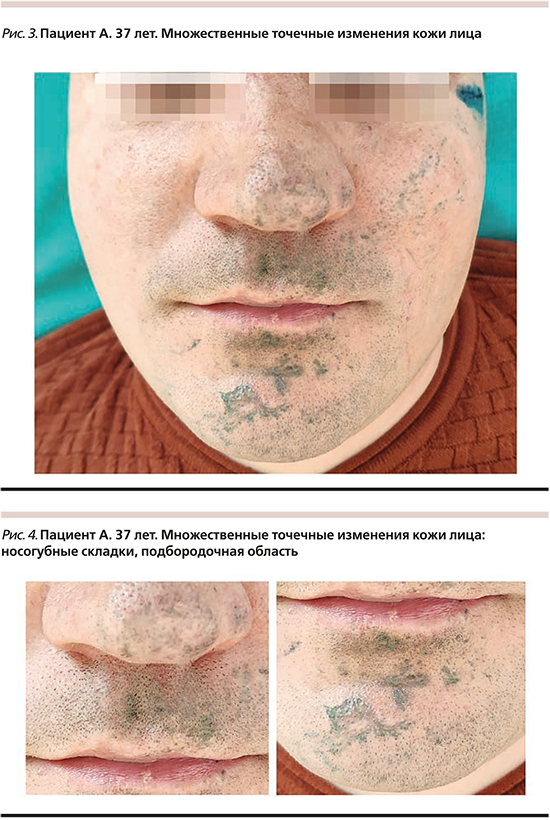
Диагноз – «множественные поверхностные инородные тела кожи лица, импрегнация кожи лица».
Анамнез: пациент поступил на лечение через 6 месяцев после получения травмы. Пострадал при взрыве петарды.
Локальный статус: поражение носит распространенный характер, татуировка располагается на коже лица, ушных раковинах. Представлена искусственными пятнами серо-голубого цвета, занимающими около 25% поверхности кожи лица (рис. 4).
Инструменты: коррекцию выполняли на аппарате StarWalker MaQX гибридным импульсом в два этапа.
Первый этап: один проход неодимовым Q-switch-лазером во фракционном режиме, позволивший сделать в коже микроотверстия (9*9/9 px/mm) для предотвращения образования газового пузыря.
Второй этап: разрушение пигмента в Q-switch-режиме.
Ход работы:
Было проведено две процедуры, осуществленные в два этапа.
1-я процедура: параметры: 1064, MaQX – 1, FS20A, 2,0 Hz, 9 mJ/px; 1064, MaQX – 1, R28, 3,0 Hz, 2,7 J/cm, 2,5 mm.
2-я процедура: параметры: 1064, MaQX – 1, FS20A, 2,0 Hz, 10 mJ/px; 1064, MaQX – 1, R28, 3,0 Hz, 3,5 J/cm, 2,5 mm.
Перерыв между процедурами составил 1 месяц. После каждой процедуры пациенту однократно вводили раствор преднизолона (30 мг, внутримышечно), наружно применяли примочки с раствором хлоргексидина и кремом бепантен. После заживления использовали крем с фотопротектором SPF 50.
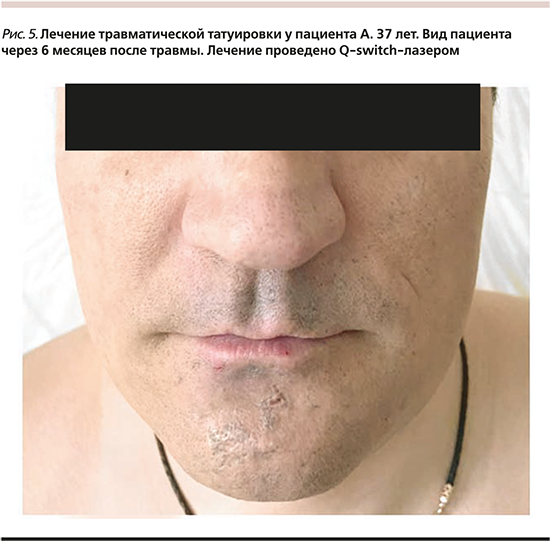
Реабилитация после первой и второй процедур составила 3 дня. Через 6 месяцев отмечен положительный эффект от проведенного лечения в виде 85%-ного удаления пигмента из кожи. Нежелательных реакций в ходе лечения и периоде наблюдения не зафиксировано. В данном случае прогноз для пациента благоприятный, при необходимости возможно проведение еще одной процедуры для достижения 100%-ного результата.
Заключение
Лечение рубцов представляет серьезную проблему, при этом лазерные технологии могут быть достаточно эффективными как в монотерапии, так и при сочетании с лекарственными средствами или физиотерапевтическими процедурами. Выбор лазера и параметров излучения зависит от многих причин: цвета, типа, толщины и локализации рубца, а также особенностей соматического статуса пациента. При лечении гипертрофических рубцов неабляционные фракционные лазеры менее эффективны, чем абляционные. Импульсные лазеры на красителях хорошо подходят для коррекции эритематозных рубцов. Q-switсhed-лазеры применяются в лечении рубцов с признаками дисхромии, но также имеют потенциал в плане ремоделирования ткани в случае использования во фракционном режиме.
Пока нет единого мнения, когда начинать процедуры лазерной коррекции: сразу после эпителизации раны или в стадии зрелого рубца? По всей видимости, первый вариант предпочтительный и показывает лучшие результаты, которые выражаются в уменьшении васкуляризации и толщины рубца. Лазерная терапия при лечении рубцов имеет хороший профиль безопасности. Незначительные побочные явления, включая боль, эритему, отек, инфекцию и экхимозы, ожидаемы и хорошо поддаются коррекции. Более тяжелые осложнения в виде гипер- и гипопигментации, а также образования новых рубцов встречаются гораздо реже.
Лечение травматических татуировок часто приводит к рубцам и неполному удалению пигмента. Единственный по-настоящему эффективный и безопасный метод – это применение Q-switсhed-лазера. Современный лазер Q-switсhed Nd: YAG с длиной волны 1064 нм и гибридным импульсом большой мощности является одним из самых универсальных и интересных лазеров в дерматологической практике. Длина волны 1064 нм хорошо поглощается меланином, частицами черных татуировок, в меньшей степени – гемоглобином. Кроме того, данная длина волны эффективно воздействует на пигментные хромофоры и позволяет избегать развития гипертрофических рубцов из-за отсутствия изменений нижележащих коллагеновых и эластических волокон. Таким образом, Q-switсhed Nd: YAG лазер идеально подходит для удаления профессиональных и травматических татуировок, о чем и свидетельствует представленный нами клинический случай.
Вклад авторов. Концепция и дизайн исследования – И.Г. Курганская. Сбор и обработка материала – К.С. Григо-рьев. Написание текста – Н.А. Шанина. Редактирование – А.В. Патрушев.


