Введение
Гормонопозитивный (ЭР+, люминальный) подтип рака молочной железы (РМЖ) – самый распространенный вариант при данной нозологии. Согласно литературным данным, его частота составляет порядка 70% от всех злокачественных опухолей молочной железы [1].
Воздействие на эстрогеновый рецептор является краеугольным камнем в лечении ЭР+-РМЖ.
В России около 30% пациенток уже при первичной диагностике РМЖ имеют местнораспространенный опухолевый процесс, т.е. опухоль выявлена на стадии, когда требуется комплексное лечение, включая проведение неоадъювантной (НАХТ) и адъювантной терапии [2].
На сегодняшний день известно, что как предоперационное, так и послеоперационное лечение РМЖ обладает одинаковой эффективностью в отношении увеличения показателей общей и безрецидивной выживаемости [3]. Однако НАХТ имеет ряд преимуществ: во-первых, она приводит к уменьшению массы опухоли и, соответственно, объема выполнения оперативного этапа до функционально выгодных и органосохраняющих вариантов; во-вторых, позволяет определять индивидуальную чувствительность опухоли к использованным противоопухолевым агентам. Клиническая регрессия опухоли коррелирует со степенью терапевтического патоморфоза в опухолях, служит важным прогностическим фактором, отражающим чувствительность опухоли к проводимому лечению. Полученные выводы позволяют определять оптимальный подход к назначению адъювантного лечения.
Очевидность того, что РМЖ – это неоднородная группа заболеваний, стала ясной для клиницистов еще задолго до появления суррогатных маркеров (рецепторов к эстрогену и прогестерону, HER2-neu, Ki-67). Тогда онкологи апеллировали лишь эмпирическими данными на основании «естественной истории роста» и метастазирования опухоли. С появлением иммуно-гистохимических маркеров появилось четкое понимание гетерогенности РМЖ.
На сегодняшний день терапия РМЖ крайне разнообразна в зависимости от биологического подтипа. Однако эта тенденция затрагивает прежде всего метастатические формы заболевания. В то же время при местнораспространенном процессе, к сожалению, это наблюдается не при всех вариантах. В частности, неоадъювантное лечение люминального РМЖ аналогично таковому, как при трижды негативном подтипе: проведение химиотерапии с включением антрациклинов и таксанов. Однако всем известно, что это две большие группы РМЖ с абсолютно разным клиническим течением, прогнозом, патогенезом развития злокачественного процесса. Вероятно, их лечение не должно быть унифицированным. Это подтверждается и различиями в результатах многочисленных исследований по проведению НАХТ в зависимости от наличия или отсутствия экспрессии ЭР. В частности, в исследовании ECTO полный патоморфологический ответ (pCR) после НАХТ наблюдался у 45% женщин с ЭР-негативными опухолями против 10,4% в группе больных ЭР-положительными опухолями [4].
На сегодняшний день имеются доказательства, согласно которым именно полный патоморфологический регресс позволяет добиваться увеличения показателей выживаемости – как безрецидивной, так и общей [5].
Очевидной причиной низкой частоты выраженных ответов на фоне НАХТ при люминальном РМЖ без гиперэкспрессии HER-2neu является, как правило, невысокий уровень пролиферации клеток и низкий/средний уровень злокачественности опухоли.
Также немаловажную роль играет и патогенез заболевания. Было опубликовано несколько крупных мета-анализов, которые показали, что химиоиндуцированная аменорея (ХИА) после адъювантной терапии люминального РМЖ у молодых женщин сопряжена с достоверно лучшим прогнозом в отношении безрецидивной и общей выживаемости. В частности, ученые из Китая в своей работе продемонстрировали, что ХИА ассоциируется с улучшением выживаемости без прогрессирования (ВБП; ОР=0,67; 95% ДИ: 0,61–0,74; р <0,001) и общей выживаемости (ОВ; ОР=0,60; 95% ДИ: 0,50–0,72; р<0,001). При анализе подгрупп обнаружено, что ХИА влияет на ВБП (ОР=0,73; 95% ДИ: 0,61–0,88; р=0,001) пациентов с положительной реакцией на ЭР; однако аналогичные результаты не наблюдались у ЭР-отрицательных пациентов (для ВБП: ОР=0,97; 95% ДИ: 0,66–1,41; р =0,858). Пациентки с ХИА достигли значительно лучшего прогноза, чем пациентки с сохранной менструальной функцией, независимо от статуса N, режима химио- или эндокринной терапии [6].
Этот факт позволяет сделать предположение, что при ЭР-экспрессирующих опухолях эффективность химиотерапии может быть обусловлена не только цитотоксическим, но и прежде всего антиэстрогеновым эффектом за счет блокирования функции яичников, тем самым приводя к химической кастрации.
К сожалению, этот процесс зачастую необратим, что крайне нежелательно в группе молодых женщин, которые, возможно, еще планируют реализацию детородной функции после радикального курса лечения РМЖ.
К настоящему моменту наука шагнула далеко вперед и в арсенале онкологов появляется все больше современных препаратов, что позволяет нам говорить не только об эффективности лечения, но и о качестве жизни.
Таким образом, принимая во внимание невысокую эффективность и токсичность НАХТ, патогенез развития люминального РМЖ, необходимы новые подходы к предоперационному лечению данной нозологии. С учетом наличия гиперэкспрессии ЭР разумно предположение об эффективности неоадъювантной гормонотерапии (НАГТ) этой категории больных.
Обзор клинических исследований
Мы изучили имеющиеся публикации в нескольких электронных базах данных (PubMed, MEDLINE, BMS), а также провели поиск активных клинических исследований на сайте ClinicalTrials.gov.
Анализ имеющихся данных позволил отметить, что большинство исследований на тему НАГТ были проведены среди популяции женщин, находившихся в менопаузе [7–8]. Это послужило включению гормонотерапии в современные рекомендации как вариант стандартного неоадъювантного лечения данной группы больных.
В частности, одним из первых рандомизированных исследований, сравнивших гормонотерапию больных в менопаузе с люминальным подтипом РМЖ напрямую со стандартной химиотерапией, стало отечественное исследование, проведенное в НМИЦ онкологии им. Н.Н. Петрова [9].
Авторы продемонстрировали, что частота объективного ответа при гормонотерапии сопоставима с таковой при химиотерапии – 65,5 и 63,6% соответственно (р>0,5). Не выявлено значимой разницы в показателях 5-летней безрецидивной выживаемости между 121 больной, получавшей неоадъювантную эндокринотерапию, и 118, получавшими химиотерапию: 71,0 и 67,7% (р>0,5). Также не было различий между гормоно- и химиотерапией в отношении частоты локорегионарного рецидива и появления отдаленных метастазов у больных (8,2 и 7,6%, р=0,99; 14,8 и 15,2%, р=0,83 соответственно).
Кроме того, авторы сделали вывод: дооперационное лечение позволяет предсказывать истинную гормоночувствительность РМЖ для последующего многолетнего адъювантного лечения и выделять группу больных с формально ЭР+ и/или ПР+опухолевым фенотипом, но нечувствительных к гормонотерапии.
Крайне ограниченное количество исследований было посвящено НАГТ молодых женщин.
Группа ученых из Европейского института онкологии (Милан, Италия) ретроспективно оценили эффективность летрозола и аналога гонадотропин-рилизинг гормона в качестве НАГТ 32 женщин в пременопаузе со стадией опухолевого процесса T2-4bN+M0 (опухоли экспрессировали ЭР и ПР более чем в 10% клеток). Только 1 пациентка достигла полного клинического ответа; 15 (47%) достигли частичного клинического ответа, что в целом составило 50% общего ответа. После 3-летнего периода наблюдения общая безрецидивная выживаемость составила 76% (83% у пациенток, ответивших на лечение, 70% у неответивших; 95% ДИ: от 59 до 93%) [10].
Исследователи из Южной Кореи стали первыми, кто провел проспективное рандомизированное исследование III фазы по оценке эффективности НАГТ по сравнению с НАХТ пременопаузальных больных ЭР+ HER2-отрицательным РМЖ [11].
Набор больных длился 8 лет (2012–2020). Включенные в исследование пациентки были случайным образом распределены (1:1) для получения 24-недельного курса НАХТ или НАГТ (гозерелин+тамоксифен). Основной целью было доказать не меньшую эффективность НАГТ по сравнению с НАХТ. Клинический ответ оценивался с помощью МРТ молочных желез. Вторичными конечными точками были частота pCR, изменение экспрессии Ki-67, частота органосохраняющих операций и качество жизни.
В общей сложности в исследование были включены 187 пациенток, из них НАХТ получили 95 женщин, НАГТ – 92; 87 пациенток в каждой группе завершили лечение. В группе НАХТ большим числом пациенток был достигнут полный или частичный ответ по сравнению с группой НАГТ (83,7 против 52,9%, 95% ДИ: 17,6–44,0, p<0,001). У 3 (3,4%) пациенток на фоне НАХТ и у 1 (1,2%) на фоне НАГТ наблюдался полный патоморфологический регресс (p<0,005). Не было различий в частоте конверсии объема оперативных вмешательств от мастэктомии до органосохраняющих вариантов (13,8% для НАХТ против 11,5% для НАГТ; p=0,531) и изменения Ki-67 (p=0,114). Частота нежелательных явлений ожидаемо была выше в группе НАХТ: 19 пациентов имели нежелательные явления 3-й степени или выше, в то время как в группе НАГТ выраженных побочных эффектов отмечено не было. Исследователи сделали вывод, согласно которому в общей популяции люминального HER2-отрицательного РМЖ стандартная НАХТ приводит к лучшим результатам по сравнению с НАГТ (гозерилин+тамоксифен).
Тем не менее авторы не исключают применения НАГТ, т.к. (1) частота органосохраняющих операций была сопоставимой; (2) не наблюдалось различий в изменении Ki-67 и (3) нежелательных явлений было намного меньше в группе НАГТ. Группа исследователей рекомендует НАГТ в клинической практике при ЭР+/HER2- РМЖ с низкой экспрессией Ki-67, опухолями средней/низкой степени злокачественности, клинически отрицательными по лимфатическим узлам, а также для пациенток с большими опухолями, для которых органосохраняющая операция неосуществима. Также авторы рекомендуют выполнять мультигенный анализ (например, Oncotype DX, Mammаprint) до начала НАГТ, чтобы выяснить, нужна ли химиотерапия конкретной пациентке.
Стоит отметить, что возможной причиной проигрыша группы НАГТ по сравнению с НАХТ в данном исследовании послужил выбор не самой эффективной гормональной опции. Опубликованы многочисленные исследования, демонстрирующие более низкую эффективность тамоксифена по сравнению с ингибиторами ароматазы и фулвестрантом, в т.ч. и в случае неоадъювантного лечения.
В частности, в рандомизированном двойном слепом исследовании III фазы STAGE было продемонстрировано, что у женщин в пременопаузе с ЭР-положительным РМЖ анастрозол приводил к лучшему общему ответу опухоли по сравнению с тамоксифеном независимо от исходного индекса Ki-67. Всего 197 пациенток были рандомизированы в группу анастрозола (n=98) или тамоксифена (n=99), из которых 185 завершили 24-недельный период неоадъювантного лечения и перенесли операцию на груди (95 в группе анастразола, 90 в группе тамоксифена). В группе анастрозола полный или частичный ответ имели больше пациенток, чем в группе тамоксифена, в течение 24 недель неоадъювантного лечения (анастрозол 70,4% [69 из 98 пациенток] против 50,5% тамоксифена [50 из 99 пациенток]; расчетная разница между группами – 19,9%, 95% ДИ: 6,5–33,3; p=0,004) [12].
Среди активных исследований стоит обратить внимание на открытое исследование NSABP FB-13 II фазы, посвященное изучению биологического и клинического эффекта неоадъювантной эндокринной терапии летрозолом, палбоциклибом и аналогом гонадотропин-рилизинг гормона пациенток в пременопаузе с положительным по рецепторам эстрогена HER2- отрицательным ранним инвазивным РМЖ. Пациентки будут получать летрозол 2,5 мг и палбоциклиб 125 мг перорально ежедневно в течение 21 дня 28-дневного цикла и гозерелин 3,6 мг подкожно в день 1 каждого 28-дневного цикла. На 6-й неделе исследуемой терапии пациенткам будут выполнены повторные биопсии. Пациентки с уровнем Ki-67 менее 10% продолжат получать исследуемую терапию в общей сложности 6 циклов. Пациентки со стойким Ki-67 ≥10% на 6-й неделе завершат исследуемую терапию и начнут НАХТ или перейдут к операции по усмотрению лечащего врача [13].
Собственное исследование
Учитывая недостаточную изученность вопроса НАГТ молодых женщин, а также ограниченное количество исследований на эту тему, нами было инициировано проспективное контролируемое исследование, где будет применена наиболее эффективная на сегодняшний день опция комбинированной гормонотерапии: агонист гонадотропин-рилизинг гормона+«чистый» антиэстроген (фулвестрант)+CDK4/6 ингибитор.
Проект реализуется на базе Санкт-Петербургского городского клинического онкологического диспансера. В настоящее время получено заключение Локального этического комитета о разрешении проведения данного исследования, ведется активное включение больных. Исследование зарегистрировано на международном портале ClinicalTrials.gov (Identifier: NCT04753177) [14]. Дизайн исследования представлен рисунке.
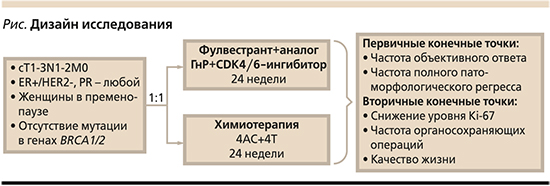
Целью нашего исследования стало выявление принципиально нового метода предоперационного лекарственного лечения РМЖ для возможности персонализированного подхода с учетом биологического подтипа опухоли. Команда исследователей ожидает от реализации проекта получение подтверждения целесообразности применения комбинированной гормонотерапии молодых женщин с люминальными подтипами РМЖ в неоадъювантном режиме.
Согласно протоколу исследования, оценка эффективности лечения проводится каждые 6–8 недель с помощью маммографии (предпочтительнее) или УЗИ молочных желез и аксилярных лимфоузлов (в отсутствие опухолевого узла на маммограммах в связи с анатомическими особенностями).
Также запланирована промежуточная трепан-биопсия опухоли и оценка уровня Ki-67 на 6-й неделе лечения в группе НАГТ. В отсутствие снижения или росте уровня Ki-67 и при прогрессирования процесса по результатам УЗИ/маммографии на фоне экспериментального лечения рекомендован переход к стандартному химиотерапевтическому лечению с включением антрациклинов и таксанов.
Всем пациенткам с целью подтверждения пременопаузального статуса проводится биохимический анализ крови для определения уровня ФСГ, ЛГ, эстрадиола до начала неоадъювантного лечения, на фоне него и после завершения.
С целью оценки качества жизни на фоне проводимого лечения пациентки проходят анкетирование по опроснику EORTC QLQ-C30 для оценки качества жизни.
Гипотеза исследования: НАГТ в комбинации с таргетной терапией пременопаузальных женщин с люминальным HER2-отрицательным РМЖ приводит к результатам не хуже, чем НАХТ, но с меньшей токсичностью.
Первичные конечные точки исследования:
1) Частота объективного ответа.
2) Частота полных патоморфологических регрессов (по классификации Миллера–Пэйна).
Вторичные конечные точки:
1) Снижение уровня Ki-67 в послеоперационном материале по сравнению с первичной биопсией.
2) Частота и выраженность нежелательных явлений.
3) Частота конверсий радикальных мастэктомий в органосохраняющие операции после проведенного неоадъювантного лечения.
4) Корреляция выраженности лечебного патоморфоза опухоли в группе НАХТ в зависимости от наличия биохимических и клинических признаков менопаузы.
5) Качество жизни.
Проектом предполагается продолжение деятельности по завершении исследования. В дальнейшем запланирована оценка отдаленных результатов показателей выживаемости: 3- и 5-летней безрецидивной выживаемости.
На сегодняшний день в исследование включены 9 пациенток, из которых 5 в группе НАХТ и 4 в группе комбинированной гормонотерапии. Однако делать какие-либо выводы на данном этапе рано.
С целью большего включения пациенток в исследование и получения более качественных результатов мы приглашаем к сотрудничеству врачей-онкологов всей страны. Пациентки из любого города могут получить обследование и лечение в рамках данного исследования в нашем учреждении бесплатно (при наличии направления по форме 057-У из поликлиники по месту жительства).
Выводы
Вопрос об объеме неоадъювантной терапии люминальных подтипов рака молочной железы, а также об используемых противоопухолевых агентах, остается дискутабельным. На сегодняшний день активно изучается метод комбинированной гормонотерапии у менопаузальных больных. Однако, в группе пременопаузальных женщин аналогичных исследований не было представлено до настоящего времени. В связи с этим, проведение такого рода инициативного исследования целесообразно и своевременно.


