Введение
По данным мировой статистики, сахарный диабет (СД) является одним из наиболее распространенных заболеваний и самым распространенным среди эндокринной патологии. Несмотря на большие достижения в исследовании патогенеза СД 2 типа (СД2), численность больных диабетом продолжает неуклонно расти и, по данным Международной диабетической федерации, в 2017 г. составила 424,9 млн человек. По прогнозу той же организации, к 2040 г. число больных СД увеличится до 642 млн. Одной из основных причин считается отсутствие своевременной диагностики заболевания, что приводит к прогрессированию диабетических осложнений вследствие развития микро- и макроангиопатий, способствующих поражению магистральных сосудов сердца и головного мозга, которые являются основной причиной инвалидизации и смертности больных СД2, определяя его социальную значимость [1, 2].
Высокая и растущая распространенность СД2 может быть частично объяснена факторами риска современного образа жизни, такими как отсутствие физической активности, курение и неправильное питание. Однако в последние десятилетия в современном обществе стал обычным еще один фактор риска: циркадные нарушения ритма жизни.
Регуляция углеводного обмена в норме
Циркадная система служит одним из самых фундаментальных свойств, присутствующих почти во всех организмах. Она генерирует суточные ритмы в поведенческих и физиологических процессах, позволяет предвидеть и адаптироваться к ежедневно меняющимся условиям окружающей среды. Последние исследования показывают, что циркадная система также играет важную роль в регулировании суточного ритма метаболизма глюкозы. Нарушение этого циркадного контроля или его координации относительно цикла окружающей среды приводит к нарушению главных механизмов регуляции углеводного обмена и увеличению риска СД2 и кардиоваскулярных осложнений [3]. Поэтому глубокое понимание механизмов, лежащих в основе регуляции уровня глюкозы циркадной системой и ее нарушений, может открыть новые горизонты в лечении и профилактике СД2 [4–6].
У большинства живых организмов каждый день характеризуется двумя фазами: первая отличается активностью и непосредственно связана с приемом пищи, вторая – отдыхом и голоданием. Питательные вещества, получаемые в течение активного периода, обеспечивают такие субстраты, как глюкоза, липиды и аминокислоты, которые насыщают метаболические связи в клетках, тогда как в течение периода покоя энергия и субстраты, хранящиеся в нашем организме, мобилизуются для поддержания метаболического гомеостаза.
Эндогенные циркадные ритмы вырабатываются мульти-осцилляторной системой, состоящей из центральных часов, расположенных в супрахиазматическом ядре гипоталамуса (SCN), а также периферических часов, представленных практически в каждом органе, ткани и клетке. Механизм молекулярных часов состоит из петель обратной связи с основной транскрипционно-трансляционной петлей отрицательной обратной связи, включающей ядра генов часов, в т.ч. CLOCK, BMAL1 (также известный как ARNTL), PER и CRY. SCN инициируется в основном световыми сигналами ретино-гипоталамического тракта. Через нервные, температурные или гормональные пути SCN передает сигналы синхронизации в другие области мозга и периферические органы, такие как шишковидная железа, надпочечники, печень, поджелудочная железа, мышцы, жировая ткань и желудочно-кишечный тракт [5, 7].
В дополнение к такому быстрому влиянию на функцию органа посредством «классического» нейроэндокринного контроля SCN также может влиять на функцию органа посредством синхронизации молекулярных часов в этих периферических органах. Периферические часы могут смещать свою работу различными стимулами, такими как физические упражнения и прием пищи, при этом пищевой сигнал – самый сильный «времязадатель» для многих связанных с метаболизмом органов, таких как как печень и поджелудочная железа (рис. 1).
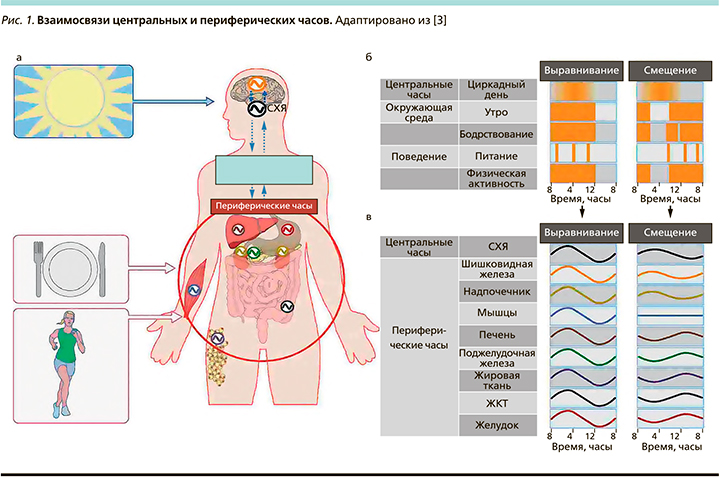
Нарушение механизмов циркадной регуляции
Циркадное смещение может происходить между центральными часами и циклами окружающей среды (например, свет–темнота; т.н. смещение среды) или поведенческими циклами (например, прием пищи–голодание, бодрствование–сон, активность–отдых; т.н. поведенческое смещение) или между центральными и периферическими часами по всему телу (внутреннее смещение; рис. 2).
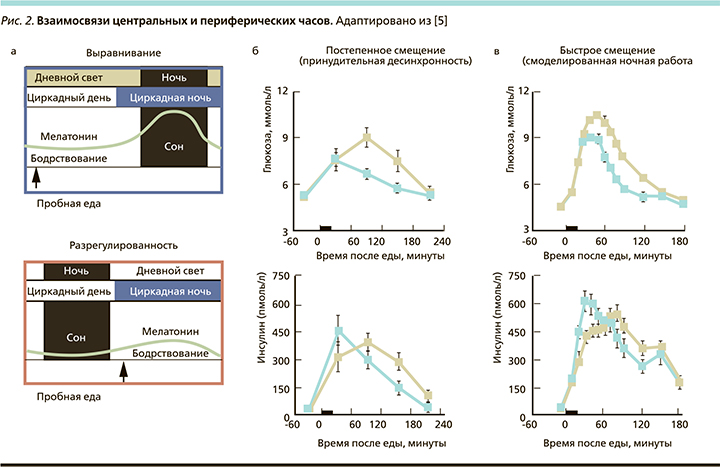
Циркадное смещение часто встречается в современном индустриальном обществе: искусственное воздействие света в сочетании со сменной работой и высокими социальными требованиями часто приводит к тому, что среда и поведение не соответствуют во времени эндогенным циркадным ритмам. Например, это часто происходит во время скользящего графика работы с чередованием ночных и дневных смен, при быстрой перемене часовых поясов (рис. 2), когда обычно наблюдается смещение между центральными циркадными часами, ритмами окружающей среды (например, свет–темнота) и поведенческими ритмами (например, нерегулярные приемы пищи) [8].
Гомеостаз глюкозы в крови можно рассматривать как парадигму циркадного контроля энергетического обмена. Действительно, в то время как в течение периода активности глюкоза крови в основном имеет пищевое происхождение, то в период голодания глюкоза стабильна в относительно узком диапазоне.
Также становится ясно, что для ежедневного поддержания гомеостаза глюкозы в крови контроль должен включать как гипоталамические (центральные) , так и периферические часы, например, в печени, поджелудочной железе, мышцах и белой жировой ткани [5, 10].
Суточные изменения в регуляции глюкозы хорошо изучены у здоровых людей. В 1960-х гг. исследования подтвердили, что толерантность к глюкозе и чувствительность к инсулину гораздо ниже вечером, чем утром. Последующие исследования, проведенные в конце XX в., также убедительно показали модель формирования инсулинорезистентности с использованием пероральных тестов на толерантность к глюкозе (OГTT), идентичных тестов с приемом пищи, внутривенной инфузии глюкозы и введением энтерального питания [4, 10, 11]. Вечернее снижение толерантности к глюкозе, по-видимому, связано с уменьшением чувствительности к инсулину и циркадным снижением функции бета-клеток, в то время как у пациентов с СД2 также выявлялся суточный ритм чувствительности к инсулину с тенденцией уменьшения его выработки в течение ночи [4].
Эти суточные закономерности в циркадном контроле глюкозы побудили исследователей провести интенсивные лабораторные исследования для выделения эндогенных циркадных паттернов контроля глюкозы (т.е. тех, которые не управляются циклами сна–бодрствования, голодания–приема пищи или темного света, а только циркадной системой).
Чтобы определить, влияет ли циркадная система на суточный ритм метаболизма глюкозы, рассмотренный выше, необходимо жестко контролировать поведенческие/окружающие воздействия, такие как сон, прием пищи и физическая активность [3]. Для контроля таких воздействий были предприняты экспериментальные лабораторные протоколы, что позволило оценить эндогенные циркадные паттерны метаболизма глюкозы.
Наиболее интересными представляются протоколы исследований циркадного уровня глюкозы, в которых минимизировано влияние воздействий окружающей среды, что позволяет регистрировать циркадные ритмы независимо от маскирующих эффектов [11].
Вышеупомянутые экспериментальные протоколы включают ограничение сна, которое, как известно, отрицательно влияет на метаболизм углеводов. Протокол принудительной десинхронизации – это подход, который меняет привычный ритм жизни и заключается в ограничении сна, лишении привычной пищевой активности, тем самым отделяя циркадные ритмы от привычных циклов поведения и окружающей среды.
В протоколе принудительной десинхронии участники изучаются в условиях отсутствия времени при слабом освещении в течение повторяющегося короткого или длительного цикла – сна–бодрствования [12, 13]. Протокол принудительной десинхронизации имеет дополнительное преимущество, заключающееся в том, что поведение, включающее голодание и прием пищи после сна, равномерно распределено по всем циркадным фазам. Это позволяет изучать отдельные влияния циркадных и поведенческих факторов, а также их выравнивание и смещение. Во всех вышеупомянутых протоколах глюкоза демонстрирует циркадный ритм с пиком активности в суточную ночь [14].
Другой экспериментальный подход к оценке влияния циркадной системы и циркадного смещения использует протокол, который имитирует быстрое и большое изменение поведенческих и экологических циклов, как это обычно случается в сменной работе. Исследования, выполненные на большой когорте участников, работающих в разные смены, показали, что циркадная система внесла больший вклад в разницу в инсулинорезистентности между утром и вечером, чем комбинированные поведенческие факторы и факторы окружающей среды. В частности, циркадная фаза увеличивала на 17% повышение постпрандиальной глюкозы вечером независимо от эффектов от поведенческих циклов. Ранняя фаза постпрандиальной выработки инсулина также была на 27% ниже вечером по сравнению с утренним. Таким образом, это циркадное влияние на инсулинорезистентность является, по крайней мере частично, результатом более сильного ответа бета-клеток поджелудочной железы в циркадное утро. Взятые вместе, данные этих экспериментальных протоколов показывают, что метаболизм глюкозы у здоровых людей находится под строгим циркадным контролем, который играет ключевую роль в функции бета-клеток поджелудочной железы [14–16]. Вполне возможно, что различия в суточном ритме метаболизма глюкозы между людьми с СД2 и без него могут быть связаны с влиянием циркадного ритма с учетом недавнихданных, согласно которым центральные биологические часы в SCN человека скомпрометированы у людей с СД2 [17]. Это подтверждено исследованиями, в которых показано значительное уменьшение количества иммунореактивных нейронов аргинин-вазопрессина (AVP-ir), нейронов вазоактивного кишечного полипептида (VIP-ir) и глио-фибриллярных кислых белков, иммунореактивных (GFAP-ir) астроглиальных клеток в SCN у людей с СД2 по сравнению со здоровыми лицами контрольной группы [18].
Эпидемиологические исследования образа жизни, связанные с несоответствием между ритмом жизни и циркадным циклами, показывают, что такие циркадные срывы способствуют развитию риска СД2.
Следует отметить, что люди, имеющие скользящий рабочий график, социальную нестабильность, постоянное позднее пробуждение и генетическую предрасположенность, часто имеют характеристики, связанные с циркадными нарушениями, которые могут предрасполагать их к более высокому риску СД2.
При СД кривая изменения уровня глюкозы крови будет зависеть от значимости вклада тех или иных нарушенных звеньев регуляции углеводного обмена. В экспериментальных исследованиях у крыс при повреждении SCN суточный ритм глюкозы крови исчезал, что подтверждает наличие регуляторных влияний ЦНС на циркадную динамику гликемии. Некоторыми авторами обнаружены анатомические нервные волокна, соединяющие SCN с печенью и поджелудочной железой и обеспечивающие прямую связь главного пейсмейкера с периферическими часами [19].
Патологические нарушения в структуре циркадной регуляции неизбежно ведут к изменениям суточной динамики регулируемых системой функциональных показателей. При патологии сердечно-сосудистой системы нарушается ритм ЧСС и АД в виде повышения или снижения вариабельности, смещения акрофаз ритма, изменения динамики в ночные и дневные часы. Эти изменения характерны и для больных СД с более выраженными подъемами уровня глюкозы крови, более длинным постпрандиальным периодом гипергликемии, а также с более значительными колебаниями гликемии по сравнению со здоровыми лицами [20, 21].
При всем многообразии патогенетических факторов, участвующих в формировании осложнений у больных СД2, хроническая гипергликемия в сочетании с ее высокой вариабельностью и измененным циркадным ритмом считается основной причиной развития микро- и макроангиопатий [22].
С представлениями о патогенетической роли высокой вариабельности гликемии (ВГ) в развитии осложнений согласуются результаты клинических исследований, показавших связь ВГ с развитием и прогрессированием ангиопатий. Первым крупным исследованием, показавшим связь сердечно-сосудистой патологии с ВГ у больных СД, стало Verona Diabetes Study [23].
В этом исследовании оценивалась связь ВГ в состоянии натощак и смертности по данным за 5 лет у 566 пожилых больных СД2. Вариабельность (но не уровень) гликемии натощак оказалась ассоциированной со смертностью от сердечно-сосудистых причин (р=0,007) независимо от других факторов риска. Роль ВГ как предиктора развития сосудистых осложнений у больных СД2 показана в многоцентровом проспективном исследовании ADVANCE [24]. Анализировалась вариабельность уровня HbA1c и гликемии натощак у 4399 больных СД2, входивших в группу интенсивного лечения. Вариабельность показателей гликемического контроля оценивалась по данным измерений на 3-м, 6, 12, 18 и 24-м месяцах исследования. Первичная комбинированная конечная точка включала микро- и макрососудистые осложнения. Риск развития микрососудистых осложнений оценивался по комбинированной конечной точке, включавшей ретинопатию (развитие пролиферативной ретинопатии, макулярного отека, слепоты или лазерной коагуляции сетчатки) и нефропатию (появление макроальбуминурии, начало заместительной почечной терапии или смерть от поражения почек). Макрососудистые осложнения включали смерть от сердечно-сосудистых причин, нефатальный инфаркт миокарда и нефатальный инсульт. Исследование показало линейную связь между вариабельностью уровня HbA1c и гликемии натощак с комбинацией микро- и макрососудистых осложнений [2, 13].
Заключение
Таким образом, многочисленные экспериментальные исследования на животных, полученные данные обследования здоровых людей указывают на существование устойчивых циркадного и ультрадианного ритмов динамики уровня глюкозы крови, сложившихся как в ходе эволюционного развития, так и под действием особенностей функционирования организма в окружающей среде [18, 22]. Сформировавшаяся в процессе фило- и онтогенеза циркадная модель нейрогуморальной регуляции углеводного обмена обладает выраженной надежностью из-за ее сложной иерархической организации и пластичности, однако широкое распространение диабета в популяции указывает на то, что современный уклад жизни и состояние окружающей среды, генетические мутации способны разрушать стройность этой системы. Современные представления о патогенезе СД2, как и других обменных заболеваний, свидетельствуют о том, что сбой определенного звена регуляции со временем ведет к патологической цепной реакции с вовлечением все большего распространения СД. Это неизбежно отражается на тяжести течения болезни и количестве осложнений и, очевидно, должно учитываться при разработке терапевтических подходов и методологии клинических исследований [2, 25].


