Введение
Злокачественное поражение первичного мочевого протока – рак урахуса, является редкой опухолью. По данным литературы, частота выявления рака урахуса составляет 0,35–0,7% от всех случаев онкологической патологии мочевого пузыря и только 0,01% от всех случаев злокачественных опухолей [1, 2].
По современным представлениям, урахус формируется после 10-й недели эмбрионального развития при постепенном сужении верхней части мочевого пузыря, который образуется за счет переднего отдела клоаки и дистального участка аллантоиса. Гистологически урахус состоит из трех слоев; внутренний слой выстлан переходным или кубическим эпителием; средний (подслизистый) выполнен соединительной тканью; внешний слой представлен гладкими мышцами.
Урахус распологается в ретциевом пространстве кпереди от брюшины и кзади от поперечной фасции. В этой области описаны две фасции, способствующие отграничению патологических процессов из урахуса: пупочно-превезикальная фасция Дельбе треугольной формы с вершиной в области пупка, которая расширяется книзу и переходит в фасциальный футляр m. Ievator ani; пупочно-пузырная фасция, которая прилежит к брюшине, покрывает урахус сзади, а латерально переходит в оболочку пупочных сосудов. Постепенно урахус облитерируется и превращается в пупочно-пузырную связку, однако примерно в половине случаев выявляют сообщение между верхушкой мочевого пузыря и незаращенным каналом урахуса, который в среднем составляет 1 мм в диаметре и имеет участки сегментарной обструкции слущенным эпителием.
К признакам рака урахуса относятся расположение опухоли по передней поверхности мочевого пузыря, отсутствие сопутствующих воспалительных изменений в слизистой оболочке мочевого пузыря по результатам биопсии опухоли, а также инфильтрация опухоли мышечной оболочки при преимущественно инфильтративном росте образования. При гистологическом исследовании характерно наличие остатков рудиментарного эпителия урахуса в опухоли, рост опухоли экзофитно за пределы мышечного слоя мочевого пузыря с инфильтрацией ретциевого пространства и распространением опухоли на пупочную складку [3–5].
В клинической практике наиболее часто для стадирования рака урахуса используют классификацию S. Sheldon et al. [6]:
- Cтадия I: опухоль ограничена урахусом и мочевым пузырем.
- Стадия II: опухоль распространяется за пределы мышечного слоя мочевого пузыря.
- Стадия III: метастазы в регионарных лимфатических узлах (в полости малого таза).
- Cтадия IV: метастазы в нерегионарных лимфатических узлах или отдаленные метастазы.
Опухоли урахуса могут развиваться из любого слоя – эпителиального, соединительнотканного или мышечного. Наиболее часто встречающимся гистологическим типом опухоли является аденокарцинома, часто встречается муцинарная аденокарцинома урахуса. В клинической практике описаны случаи переходно-клеточного рака урахуса и другие гистологические варианты [4, 7].
Клинические проявления заболевания связаны с локализацией новообразования и его распространением. Опухоли в области пупка определяются как объемные образования, безболезненные при пальпации, которые постепенно увеличиваются в размерах и могут сопровождаться появлением пупочного свища со слизистым отделяемым, инфильтрацией кожи или ее изъявлением. Суправезикальный отдел урахуса отграничен пупочно-превезикальной и пупочно-пузырной фасциями, поэтому симптомы обычно появляются на этапе значительного местного распространения опухоли. При этом первоначально по средней линии в надлобковой области удается пропальпировать подвижное безболезненное образование. На более поздних стадиях опухоль инфильтрирует окружающие ткани, врастает в стенку мочевого пузыря или в брюшную полость с формированием мочепузырно-кишечных свищей. Нередко значительному местному распространению опухоли урахуса соответствуют минимально видимые изменения слизистой оболочки мочевого пузыря, которые можно ошибочно принять за опухоль уротелия.
В связи с особенностями расположения опухоли первичного мочевого протока диагностика чаще всего происходит на поздних стадиях заболевания. Стандартным методом лечения, позволяющим достигать хороших результатов по выживаемости и безрецидивной выживаемости, можно назвать проведение оперативного лечения в объеме радикальной цистэктомии или резекции мочевого пузыря с удалением остатков урахуса (иссечением срединной попучной связки) и тазовой лимфаденэктомией. Роль адъювантной химиотерапии не доказана. При метастатическом поражении стандарта лекарственной терапии нет. Это объяснимо небольшим числом подобных пациентов в общей онкологической популяции и отсутствием в связи с этим рандомизированных клинических исследований.
В связи с этим интересен любой клинический опыт лечения столь редкой опухоли.
Клинический случай
Больной Т. 58 лет. Появление признаков заболевания отмечает с мая 2019 г., когда появилась кровь в моче. Пациент был экстренно госпитализирован в городскую больницу, где проводилась консервативная терапия. По данным компьютерной томографии и ультразвукового исследования (УЗИ) органов малого таза от 05.2019, объемное образование мочевого пузыря – 44×29×25 мм. 01.06.2019 проведена трансуретральная резекция простаты (ТУР), по результатам гистологии от 10.06.2020, данных за опухолевую патологию не выявлено, пациенту было рекомендовано повторное проведение ТУР с интервалом 3 месяца. На повторную ТУР в положенный срок пациент не явился, в декабре 2019 г. – экстренная госпитализация в связи с макрогематурией. По УЗИ органов малого таза от 1.12.2019: в мочевом пузыре по верхней стенке объемное солидное образование 36×35×30 мм. Проведена повторная ТУР 01.12.2019, по результатам гистологического заключения: фрагменты слизистой оболочки мочевого пузыря с картиной хронического цистита, с очаговой железистой метаплазией и формированием полипов сосочков. С учетом расхождения данных клиники, инструментальных методов и гистологического исследования вновь проведена ТУР; диагноз злокачественного процесса верифицирован. Гистологически низкодифференцированная аденокарцинома мочевого пузыря с ослизнением (наличием перстневидных клеток). Микропрепараты были пересмотрены в референс лаборатории, диагноз «опухоль урахуса» подтвержден.
Проведена позитронно-эмиссионная томография–компьютерная томография (ПЭТ–КТ) 02.2020, установлено множественное метастатическое поражение костей, очаг накопления радиофармпрепарата (РФП) в моче-вом пузыре, висцеральных метастазов не выявлено (рис. 1, 2). Данные ПЭТ–КТ подтверждены сцинтиграфией костей – метастазы (МТС) в кости. Простатический специфический антиген от 18.02.2020: 2,75 нг/мл. На основании совокупных данных установлен диагноз «рак урахуса», ст. IV гр. IV, T4 N0 M1, МТС в кости.
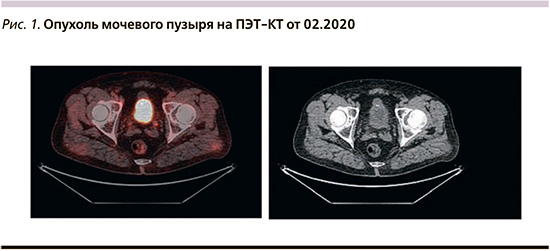
Пациент обсужден на онкоконсилиуме, принято решение о проведении паллиативной химиотерапии. С учетом отсутствия клинических рекомендаций и стандартов по лечению рака первичного мочевого протока, малого опыта лечения данной нозологии по литературным данным принято решение начать лечение с режима паклитаксел 175 мг/м2+карбоплатин AUC-5 1 раз в 21 день, проведение 2–3 курсов паллиативной химиотерапии (ПХТ) с последующей оценкой эффекта.
Из жалоб отмечены изнуряющая поллакурия до 1–2 в час, болевой синдром в костях, слабость. Обезболивание проводилось по 2-й ст. ВОЗ – Трамадолом 100 мг 2 раза в сутки. Статус по ECOG – 2.
С 26.02.2020 по 8.04.2020 проведено 3 курса ПХТ в режиме паклитаксел+карбоплатин 1 раз в 21 день. Также 1 раз в 28 дней получал золедроновую кислоту 4 мг на фоне приема препаратов кальция. Переносимость лечения была хорошей, побочных эффектов отмечено не было. На фоне лечения потребность в анальгетиках не нарастала.
После 3 курсов ПХТ имела место положительная динамика: снижение числа эпизодов мочеиспускания в 2 раза, снижение уровня слабости. Общесоматический статус – ECOG-1. С учетом положительной клинической динамики проведен 4-й курс ПХТ в прежнем режиме, после чего пациент направлен на ПЭТ–КТ.
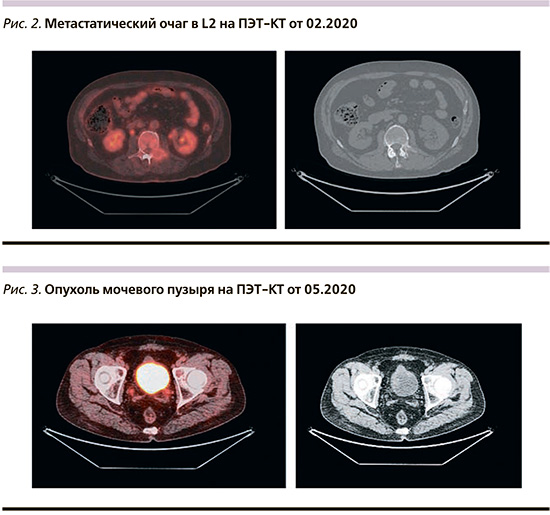
По данным ПЭТ–КТ от 12.05.2020, после 4 курсов ПХТ – смешанная динамика. В малом тазу: низкая фиксация РФП в опухоли урахуса с распространением на передне-верхнюю стенку мочевого пузыря 30×27 мм, SUVmax 0,7 – без динамики. Паравезикальная клетчатка тяжистая. Единичные наружные подвздошые лимфоузлы с обеих сторон до 9 мм, метаболически слабо активны, SUVmax – 1,5 (ранее 2,45). В костях признаки остеолитических изменений без четких контуров с патологической низкой фиксацией РФП, в динамике появилось слабовыраженное склеротическое отграничение: в левом поперечном отростке, дужке L2 (вздутие отростка, истончение кортикальной пластинки, сужение межпозвонкового отверстия L2-L3) – SUVmax 2,8 (ранее 3,2), остистом отростке, теле ТН9, теле ТН10 слева SUVmax 2,6 (ранее 3,5). Увеличился активный объем, слабовыраженный склероз без четких контуров ребер с низкой фиксацией РФП (наибольшие размеры в 6-м ребре справа, уровень фиксации РФП прежний SUV max 2,6, ранее – 2,65). Повышена активность, умеренный склероз костного мозга (более выражено в костях таза, крестца), увеличился в объеме активный очаг в боковой массе крестца слева SUVmax 4,2 (ранее SUVmax 4). В 7-м ребре слева в динамике появился паракостальный мягкотканный компонент (рис. 3).
Тактика лечения была обсуждена на консилиуме, решено провести еще 2 консолидирующих курса ПХТ в режиме паклитаксел 175 мг/м2+карбоплатин AUC5, затем провести лучевую на очаги в костях.
С 21.05.2020 по 11.06.2020 проведены 5-й и 6-й курсы ПХТ в режиме паклитаксел+карбоплатин 1 раз в 21 день, затем курс дистанционной лучевой терапии по паллиативной программе с 26.06.2020 по 10.07.2020 в СОД 30 Гр (10 фр) на метастатический очаг (7-е ребро слева – паракостальный мягкотканный компонент).
По завершении терапии 01.08.2020 проведено ПЭТ–КТ исследование.
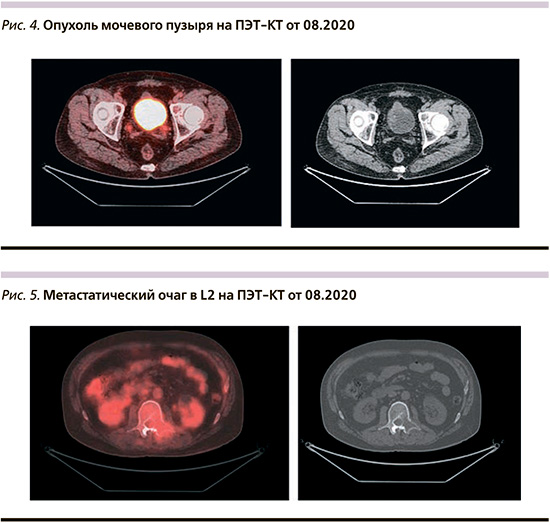
В динамике отмечено прогрессирование заболевания: появление метастатического поражения легких, рост опухоли мочевого пузыря, появление мягкотканного компонента в костных метастазах (рис. 4, 5). Клинически отмечено ухудшение состояния: нарастание интоксикации, болевого синдрома. 19.08.2020 осмотрен консилиумом, с учетом тяжелого состояния рекомендована симптоматическая терапия, 14.09.2020 наступил летальный исход.
Безусловно, диагностика и лечение редких опухолей – серьезная проблема онкологии. Рассматривая данный клинический случай, ретроспективно можно сделать вывод о поздней диагностике и позднем начале специального лечения: с момента появления симптомов до начала системной терапии прошло 10 месяцев. Проведение паллиативной ПХТ позволило сохранить удовлетворительное качество жизни пациента, получить контроль заболевания в течение 6 месяцев.
Информированное согласие. Пациент дал свое согласие на публикацию данных истории болезни и результатов обследования.
Заключение
Дальнейшее накопление опыта лечения пациентов с опухолями урахуса позволит разработать общепринятую тактику лекарственного лечения. Согласно нашему опыту, режим паклитаксел+карбоплатин показал хороший терапевтический эффект при низкой токсичности.



