Введение
По данным ВОЗ, рак предстательной железы (РПЖ) занимает третью позицию по частоте встречаемости среди всех злокачественных новообразований и прочное второе место среди мужчин (13,5%), уступив лишь раку легкого, который диагностируется у 14,5% больных [1, 2]. Смертность от РПЖ во всем мире стабильно занимает седьмое место, и тенденции к снижению смертности в последние годы не наблюдается.
В Челябинской области заболеваемость РПЖ выше, чем в среднем по России (41,45 на 100 тыс.) и в 2018 г. составила 53,39 случая на 100 тыс. населения. Смертность от РПЖ в Челябинской области также выше среднероссийских показателей (12,11 на 100 тыс.), составив 16,69 на 100 тыс. населения. На протяжении последних 10 лет наблюдается неуклонный рост заболеваемости РПЖ [3].
Основная причина смерти пациентов с РПЖ – прогрессирование опухолевого процесса. Самая частая мишень отдаленного метастазирования при РПЖ – костная система; висцеральное поражение, как правило, регистрируется на поздних этапах прогрессирования опухоли, а часть больных не доживает до развития у них висцеральных метастазов. Доказано, что костные метастазы служат независимым фактором риска общей выживаемости при РПЖ [4].
При РПЖ метастазы, как правило, остеобластические, а, как известно, именно остеобластические очаги сопровождаются болевым синдромом – одним из серьезных осложнений костных метастазов, приводящим к наибольшему снижению качества жизни больных. Болевой синдром, по разным данным, беспокоит до 80% пациентов с костными метастазами при РПЖ. При дальнейшем прогрессировании в зависимости от локализации и размера костные метастазы могут вызывать патологические переломы и компрессию спинного мозга – наиболее тяжелые осложнения, которые также значимо снижают качество жизни пациентов и влияют на продолжительность жизни [5].
В связи с этим терапевтические методы с благоприятным профилем токсичности, воздействующие именно на костные метастазы, представляют наибольший интерес. Одно из таких перспективных направлений – радионуклидная терапия. На сегодняшний день зарегистрировано и применяется в клинической практике несколько остеотропных радиофармпрепаратов. Хорошо известны и широко используются во всем мире бета-эмиттеры – самарий-153 и стронций-89, однако их применение ограничено их высокой гематотоксичностью. Согласно результатам проведенных еще в 1970-х гг. исследований, эти препараты не оказывают влияния на общую (ОВ) и безрецидивную выживаемость и во всем мире основным показанием к их назначению остается хронический болевой синдром при остеобластических костных метастазах [6].
В 2018 г. в РФ был зарегистрирован новый радиофармпрепарат – радия-223 дихлорид (Ra-223). Ra-223 – это первый и единственный на сегодняшний день таргетный радиофармацевтический препарат, излучающий альфа-частицы, который достоверно увеличивает общую продолжительность жизни больных кастрационно-резистентным РПЖ (КРРПЖ) с метастазами в кости.
Клинический случай
Пациент К. 1950 года рождения, диагноз: РПЖ T3bN1M1b, IV стадия, метастазы в кости.
18.11.2016 больному выполнена биопсия предстательной железы. Гистологическое заключение: умеренно дифференцированная аденокарцинома предстательной железы. Индекс Глиссона – 7 (3+4). По магнитно-резонансной томографии малого таза диагностировано поражение тазовых лимфоузлов, при остеосцинтиграфии – множественное поражение костей.
С декабря 2016 г. начата химическая кастрация аналогами лютеинизирующего гормона рилизинг-гормона, с января 2017 г. подключены бисфосфонаты – золедроновая кислота в дозе 4 мг 1 раз в 28 дней.
С марта по август 2017 г. проведено 8 циклов химиотерапии по схеме: доцетаксел 75 мг/м2 1 раз в 21 день.
В связи с сохраняющимся болевым синдромом 29.11.2017, 29.05.2018 и 11.01.2019 проведена радионуклидная терапия стронция-89 хлоридом, активность – 150 МБк.
В марте 2019 г. зарегистрирована кастрационная резистентность (рост уровня общего ПСА в динамике, появление новых очагов при остеосцинтиграфии).
Проведен консилиум: с учетом данных клинических исследований, действующих в 2019 г. клинических рекомендаций в качестве терапии первой линии КРРПЖ выбран Ra-223. Основные критерии выбора:
- множественное поражение костей, подтвержденное остеосцинтиграфией;
- отсутствие висцеральных метастазов, подтвержденное компьютерной томографией органов грудной клетки, брюшной полости и малого таза;
- размер забрюшинных лимфоузлов на момент начала терапии Ra-223 не превышал 5 мм;
- костные метастазы сопровождались болевым синдромом (пациент получал трамадол 100–150 мг/сут;
- общий статус ECOG – 1.
С июня по ноябрь 2019 г. пациент получил 6 инъекций Ra-223 55 кБк/кг 1 раз в 4 недели.
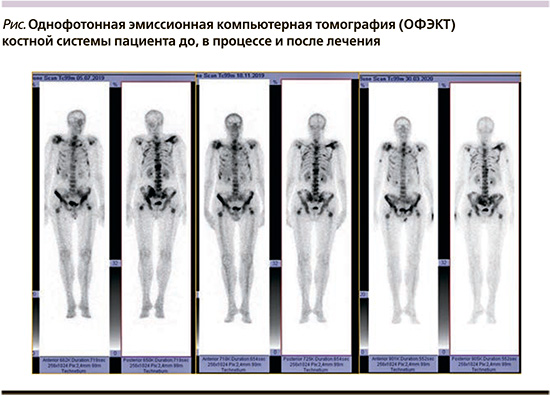
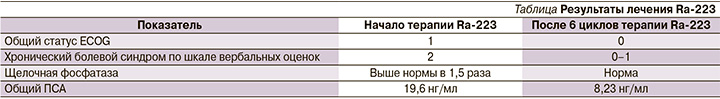
В результате лечения Ra-223 (см. таблицу) у пациента улучшилось общее состояние, уменьшился болевой синдром (больной полностью отказался от использования трамадола), нормализовался уровень щелочной фосфатазы, общий ПСА снизился более чем в 2 раза. По данным остесцинтиграфии (см. рисунок), достигнута стабилизация опухолевого процесса.
Из нежелательных явлений у пациента зарегистрированы снижение аппетита 1-й ст., нейтропения 1-й ст. Эти нежелательные явления были кратковременными, не требовавшими отмены либо отсрочки терапии.
Через 5 месяцев после завершения полного курса терапии Ra-223 зарегистрировано прогрессирование, появились новые очаги в костях по данным остеосцинтиграфии (см. рисунок), отмечен рост общего ПСА более чем на 50% от надира. Пациенту назначена терапия второй линии – абиратерон в дозе 1000 мг/сут.
Обсуждение
Увеличение ОВ при применении Ra-223 доказано в регистрационном исследовании III фазы ALSYMРСA, включившем 921 пациента с КРРПЖ с ≥2 симптомными метастазами в кости, без висцеральных очагов. При применении Ra-223 медиана ОВ составила 14,9 против 11,3 месяца у пациентов, получавших плацебо; риск смерти снизился на 30% (отношение рисков=0,70; 95% доверительный интервал – 0,58–0,83) [7]; значимо ниже был риск скелетных осложнений, достоверно увеличилось время до первого скелетного осложнения [8]. Эксплоративный анализ данных исследования показал, что эффективность Ra-223 (ОВ и частота скелетных осложнений) была сопоставимой с таковой у пациентов с выраженными симптомами (исходное использование опиатов) и минимальными симптомами (исходно использования опиатов не требовалось) [9]. Кроме данного исследования показатели эффективности и безопасности радия-223 оценивались в международном многоцентровом проспективном исследовании IIIb фазы iEAP, в которое вошли 839 пациентов, из них лечение Ra-223 получили и подверглись финальному анализу 696 больных КРРПЖ с ≥2 очагами костного поражения, без висцеральных метастазов. Полученные в iEAP результаты соответствовали данным регистрационного исследования ALSYMPCA: медиана ОВ составила 16 месяцев. Из факторов благоприятного прогноза ОВ по результатам этого исследования можно выделить следующие: соматический статус, соответствующий 0–1 по шкале ECOG (Eastern Cooperative Oncology Group), отсутствие боли и уровень щелочной фосфатазы <220 ЕД/л до начала лечения, а также выполнение ≥5 инъекций Ra-223 [10].
Таргетный остеомоделирующий эффект Ra-223 реализуется за счет того, что он, подобно кальцию, являясь его миметиком, захватывается костной тканью, образуя комплексы с гидроксиапатитом, прицельно воздействует на опухолевые очаги и участки ремоделирования костной ткани, сопутствующие метастатической трансформации. Ra-223 способствует не только элиминации опухоли, но и восстановлению, а также сохранению нормальной костной структуры, предотвращая развитие костных осложнений [10]. Преимущества альфа-эмиттера Ra-223 по сравнению с ранее известными бета-эмиттерами самарием-153 и стронцием-89 основаны на свойствах альфа-частиц, которые имеют более короткую длину волны, при этом обладют большей ионизационной способностью. Это приводит к двухцепочечным необратимым разрывам ДНК в отличие от бета-эмиттеров, вызывающих одноцепочечные повреждения. Короткой длиной пробега альфа-частиц в тканях обусловливается благоприятный профиль токсичности, т.к. окружающий метастаз костный мозг подвергается облучению в минимальной степени. Особенно важна низкая гематологическая токсичность Ra-223, являющаяся одной из основных проблем при применении самария-153 и стронция-89 [11–13]. Благоприятный профиль безопасности также объясняется фармакодинамикой Ra-223. Экскреция происходит в основном через кишечник, и только 5% выводится с мочой, что нивелирует гепато- и нефротоксичность.
Уже через сутки 99% радионуклидов локализуются в костях. Период полураспада Ra-223 до стабильного изотопа свинца составляет 11,4 дня [14].
Полный курс лечения состоит из 6 введений с интервалом 28 дней, доза препарата рассчитывается на килограмм массы тела пациента и составляет 55 кБк на 1 кг.
В отделении радионуклидной терапии ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» Ra-223 пациенты начали получать в 2019 г. На сегодняшний день проведено 64 введения 17 пациентам. Полный курс лечения получили 7 больных, остальные продолжают получать терапию Ra-223.
Заключение
Наш опыт применения Ra-223 демонстрирует соответствие данным, полученным по результатам клинических исследований и опубликованным в литературе. Ra-223 хорошо переносится пациентами, как правило, токсические реакции не превышают 1–2-й степеней и не требуют отсрочки введения либо редукции дозы препарата. Режим введения Ra-223 безопасен и удобен персоналу и пациентам. Лучевая нагрузка на персонал оказывается минимальной, т.к. альфа-излучение характеризуется минимально короткой длиной волны и низкой проникающей способностью. В связи с этим для работы с Ra-223 не требуются «закрытые» палаты, наличие специальной канализации. Благодаря появлению Ra-223 пациентам с КРРПЖ с костными метастазами без висцеральных поражений стал доступен еще один терапевтический метод с достоверным увеличением ОВ и благоприятным профилем токсичности, не ухудшающий качество жизни больных.
Вклад авторов
Концепция и дизайн исследования – Е.Б. Васильева.
Сбор и обработка материала – Е.Б. Васильева, К.А. Толпейкина.
Написание текста – Е.Б. Васильева, А.В. Важенин, К.А. Толпейкина, К.В. Чванова.
Редактирование – Е.Б. Васильева, К.А. Толпейкина.


