Введение
Топические глюкокортикостероиды (ТГКС) используются в дерматологии почти 70 лет. Появление ТГКС совершило «революцию» и позволило кардинально изменить прогноз в отношении терапии многих заболеваний кожи. Комбинированная кортикостероидная терапия фиксированными комбинациями (ФК), когда в составе лекарственной формы наряду со стероидом содержатся активные вещества с иным механизмом действия, известна более 30 лет. В состав первых лекарственных препаратов входили антисептики, например клиохинол, затем антибиотики или антимикотики, в дальнейшем появились формы, содержавшие одновременно ТГКС, антибиотик и антимикотик.
Терапия фиксированными комбинациями с ТГКС прочно заняла место в числе основных дерматологических препаратов. Это связано прежде всего с тем, что при многих заболеваниях кожи бактерии и грибы выступают в качестве или этиологического (пиодермии и микозы, отдельные формы экзем и др.), или значимого фактора в патогенезе (атопический дерматит, себорейный дерматит и др.) [1, 2]. В первом случае по ряду причин (неадекватное лечение, сопутствующая соматическая патология) может присоединяться компонент аллергизации очагов и дерматоз приобретает клинические признаки заболевания сочетанной этиологии. Во втором случае патогены (бактерии, грибы) либо поддерживают воспаление за счет сенсибилизации, либо осложняют течение (вторично инфицированные дерматозы). Оба сценария достаточно часто встречаются в клинической практике.
Значительную часть показаний к назначению комбинированных ГКС составляют сочетанные поражения или осложненные вторичной инфекцией дерматозы (аллергический дерматит, атопический дерматит, себорейный дерматит и многие другие), а также пиодермии/микозы (при наличии острых воспалительных явлений) [1, 2]. В ряде случаев, если не зачастую, врач может лишь только предполагать инфекционную составляющую воспалительного процесса, не имея возможности подтвердить его с помощью микробиологического или микологического исследования, и лечение назначается эмпирически. Еще одним аргументом в пользу назначения комбинированных препаратов является то, что при «стероид-чувствительных» дерматозах существует риск вызвать ятрогенное состояние локального иммунодефицита (применение ТГКС), предрасполагающего к инфекционным осложнениям. Взаимосвязь ТГКС и микробиома кожи долгое время рассматривали лишь в контексте относительно локального иммунодефицита как дополнение «воспалительного пейзажа» присоединением или активацией условно патогенной микрофлоры – бактериальной (фолликулиты, импетиго) или грибковой. Однако в реальности это значительно более сложные процессы, что обусловлено особенностями возрастной физиологии кожи, влиянием эпигенетических, экзогенных и средовых факторов. В то же время инфекционная сенсибилизация, поддерживая и потенцируя иммунное воспаление, существенно снижает эффективность ТГКС.
Необходимо отметить, что активной колонизации кожи различными патогенами больных дерматозами способствует и нарушение кожного барьера, обусловленное различными механизмами (нарушение процессов кератинизации, дефицит компонентов матрикса, дефект компонентов иммунной защиты, зуд). Значительная часть иммунопатогенетических путей развития воспалительных заболеваний, изменяющих иммунологическую защиту кожи, сами приводят к изменению биологического разнообразия микробиома, а зачастую и к замещению комменсалов кожи патогенными видами, в частности коагулазоположительными стафилококками, в т.ч. штаммами с множественной антибиотикорезистентностью [3]. На сегодняшний день основными патогенами, участвующими в реализации воспалительного процесса при дерматозах сочетанной этиологии, считаются стафилококки и условно патогенные дрожжевые грибы Malassezia и Candida. Таким образом, в реальной клинической практике при дерматозах сочетанной этиологии оправданно использование комбинированных с ТГКС препаратов с различных позиций, при этом основным является чувствительность потенциальных патогенов к компонентам препарата.
В Российской Федерации зарегистрировано три топических средства, в состав которых входят бетаметазон, гентамицин, клотримазол в двух лекарственных формах (мазь, крем): Тридерм® (АО «Байер», Россия), Акридерм® ГК (ОАО «Акрихин», Россия) и Канизон® плюс (воспроизведенный «Аджио Фармацевтикалз Лтд», Индия) [4]. Вопросы эквивалентности оригинального и воспроизведенных препаратов с точки зрения фармакодинамической эффективности остаются открытыми. В то же время следует отметить, что терапевтическая эквивалентность данных лекарственных средств (ЛС) обусловлена не только сопоставимостью фармакокинетики и номинальным составом, но и прежде всего их активностью в отношении этиологически значимых патогенов, оценить которую возможно в условиях эксперимента in vitro [16]. Возможные различия, которые в т.ч. могут быть обусловлены физико-химическими свойствами основы лекарственного средства и технологией производства [5].
Обзор исследования
В связи с высокой значимостью активности компонентов в отношении патогенных микроорганизмов представляет особый интерес определение антимикробной активности препаратов. Недавно были опубликованы результаты такого сравнительного исследования [6]. Оценку чувствительности бактериальных штаммов к исследуемым препаратам осуществляли с использованием метода разведения в агаре в соответствии с документом CLSI М07-А10 [7]. Чувствительность Candida spp. анализировали микрометодом разведения в бульоне в соответствии с ГОСТом Р ИСО 16256-2015 [8]. Концентрации гентамицина и клотримазола для основных растворов рассчитывали исходя из их содержания в готовых ЛС.
Все исследования выполняли в трех повторах. МИК определяли по наименьшей концентрации анибиотика, которая подавляла видимый рост микроорганизмов при сравнении с контролем роста без препарата.
Полученные результаты обрабатывали в программе Microsoft Excel, 2010. В качестве числовой характеристики МИК в экспериментах, выполненных методом серийных разведений, использовали медиану. Сравнение МИК каждого препарата оценивали с помощью однофакторного дисперсионного анализа (ANOVA) в программе SPSS Statistics v23. Достоверность различий оценивали при р<0,05.
Результаты сравнительной оценки МИК препаратов Тридерм® и Акридерм® ГК [6] в отношении контрольных штаммов и клинических изолятов основных патогенов приведены в табл. 1 и 2.
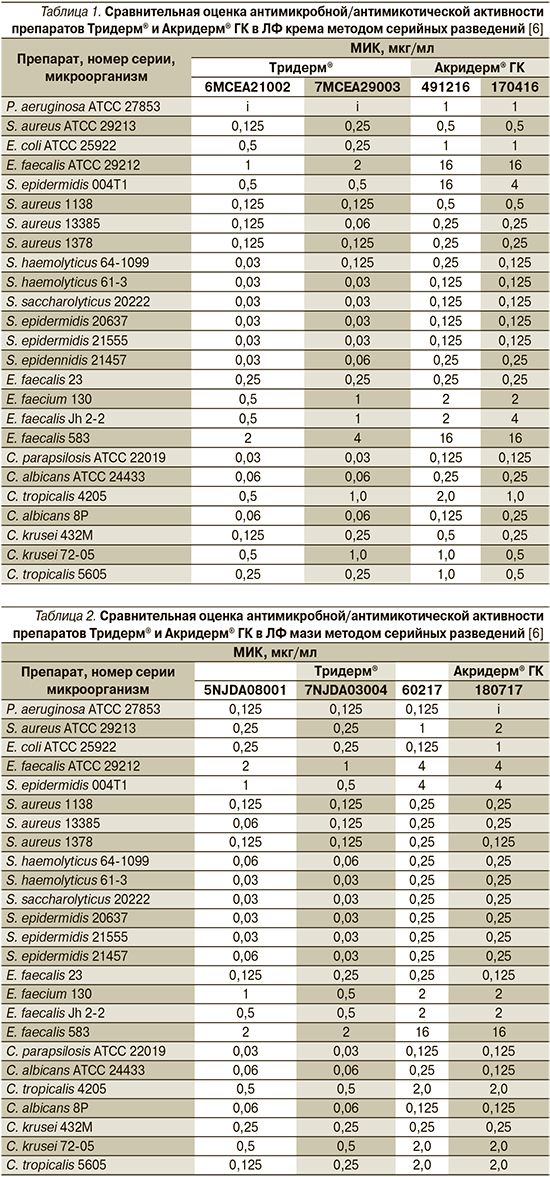
Как следует из полученных данных, активность исследуемых препаратов в обеих лекарственных формах не выходила за допустимый диапазон, за исключением мази Акридерм® ГК в отношении Staphylococcus aureus АТСС 29213, МИК которой на одно разведение превысила контрольное значение. Несмотря на то что уровни активности соответствовали допустимым, крем и мазь Тридерм® превосходили по значениям МИК обе лекарственные формы Акридерм® ГК в отношении контрольных штаммов в среднем на 2–4 разведения.
Как следует из представленных результатов, препараты Тридерм® (АО «Байер», Россия) и Акридерм® ГК (ОАО «Акрихин», Россия) в лекарственных формах (ЛФ) крем и мазь были схожими по спектру действия в отношении клинически важных патогенов независимо от их чувствительности к антимикробным агентам. Однако активность гентамицина и клотримазола в составе комбинированных средств Тридерм® и Акридерм® ГК различалась: МИК мази и крема Тридерм® в отношении 20 из 25 бактериальных и грибных штаммов были на 2–4 разведения ниже, чем МИК Акридерм® ГК. По отдельным видам микроорганизмов МИК различались на шесть разведений.
Акридерм® ГК в ЛФ-мазь (серия 60217) более активно воздействовал на грамотрицательные микроорганизмы, чем то же средство другой серии (180717): МИК в отношении Pseudomonas aeruginosa АТСС 27853 и Escherichia coli АТСС 25922 составили 0,125 и 1 мкг/мл соответственно (р<0,01). Аналогичные результаты получены в отношении штамма Enterococcus faecalis АТСС 29212: для Акридерм® ГК (мазь и крем) значения активности составили 4–16 мкг/мл, для Тридерм® (мазь и крем) – 1–2 мкг/мл (р<0,01).
Акридерм® ГК (крем и мазь) проявлял слабую активность в отношении клинического изолята Staphylococcus epidermidis 004Т1, устойчивого к метициллину, в отличие от Тридерм® (крем и мазь) значения МИК составляли соответственно 4–16 и 0,5–1 мкг/мл (р<0,003). Таким образом, активность препаратов Тридерм® по отдельным штаммам была на шесть разведений выше, чем у обеих ЛФ Акридерм® ГК. Штаммы Enterococcus faecium 130, Е. faecalis Jh 2–2 и ванкомицинрезистентный Е. faecalis 583 (р<0,001) также более чувствительны к препарату Тридерм® (крем и мазь), чем к Акридерму® ГК (крем и мазь). Допустимые отклонения МИК для данного метода не должны превышать 1–2 разведений, однако 16 из 18 клинических бактериальных изолятов более чувствительны к ЛФ Тридерм®, чем к Акридерм® ГК, при этом значения МИК различались на 2–4 разведения.
Схожие данные получили при сравнительной оценке активности ЛС в отношении Candida spp. Значения МИК исследуемых препаратов для 4 из 7 штаммов Candida spp., использованных в работе, различались на 2–4 разведения при меньших значениях МИК для крема и мази Тридерм®.
Проведенные исследования свидетельствуют о том, что активность гентамицина и клотримазола в составе комбинированных ЛС Тридерм® и Акридерм® ГК различается, в т.ч. в отношении Staphylococcus spp., Candida albicans. С учетом важной роли данных патогенов при дерматозах сочетанной этиологии [9–15] эффективность препаратов при их использовании в клинической практике также может различаться, однако это требует дополнительных сравнительных клинических исследований. В данном исследовании, проведенном in vitro, показано различие в антибактериальной/антимикотической активности воспроизведенных и оригинальных препаратов по ряду позиций.
Возможная причина различий может быть обусловлена качеством исходных субстанций, которое порой варьируется в широких пределах, при этом не выходя за границы официально установленных нормативов, а также основой препарата. Основа может влиять не только на многие свойства препарата в отношении клинических симптомов (например, мазь – окклюзионное действие, растворы – подсушивающее действие), но и на активность препарата и его потенциальные побочные эффекты [16]. Иногда при выборе компонентов основы воспроизведенных препаратов в большей степени ориентируются на удешевление производства и в меньшей степени учитывают особенности их взаимодействия с действующими веществами.
Известно, что основа обеспечивает стабильность препарата в процессе хранения и способствует доставке активного лекарственного вещества к месту его непосредственного действия. В состав препарата Тридерм® включена двухкомпонентная буферная система для поддержания кислой реакции (pH=4,5–5,5), что способствует обеспечению эффективности действия компонентов, прежде всего гентамицина, который проявляет свою активность при определенных значениях pH [16]. В воспроизведенном препарате буферная система монокомпонентна. Состав основы может влиять на аллергенный потенциал лекарственного средства: например, крем и мазь Тридерм не содержат парабенов, присутствующих в воспроизведенных препаратах, что определяет такие важные свойства, как растворимость, гомогенность и температурная устойчивость [16, 17]. Были отмечены разные профили растворения воспроизведенных и оригинальных ЛС [17].
Так, при сравнении реологических свойств крем Тридерм® показал устойчивые структурно-механические свойства при колебании в широком диапазоне температур (21–30°С), актуальных для накожного применения, в отличие от воспроизведенных аналогов [17].
Следует отметить, что оригинальный и воспроизведенный препараты, протестированные в настоящем исследовании, производятся в соответствии со стандартами Надлежащей производственной практики GMP (Good Manufacturing Practice). Однако это не исключает определенной разницы в технологических процессах, способной влиять на конечный результат.
Заключение
Многолетний опыт использования в дерматологии фиксированных комбинаций ТГКС с атибиотиком/антимикотиком сегодня представляется обоснованным с различных позиций, в т.ч. благодаря достижениям в изучении патогенеза иммунозависимых и инфекционных дерматозов. Применение комбинированных препаратов при дерматозах сочетанной этиологии должно обеспечивать противовоспалительный эффект без выраженной иммуносупрессии (наличие адекватного по силе активности ГКС) и способствовать элиминации патогенов (эффективный антибиотик/антимикотик). И несмотря на идентичный состав по активным компонентам, оригинальный и воспроизведенные препараты могут различаться, поскольку условия производства фармацевтических субстанций и вспомогательные компоненты, входящие в их состав, имеют различия, что может влиять и на саму биологическую активность.
Сегодня мы убеждены в том, что S. aureus, C. albicans не только вызывают инфекции кожи, но и принимают непосредственное участие в возникновении, развитии и поддержании воспалительного процесса при многих хронических заболеваниях кожи. Эрадикация патогенов или хотя бы сокращение их популяции способствует устранению ведущего воспалительного триггера и как следствие – купированию клинической симптоматики. И экспериментальные данные, и клинические исследования последних лет делают обоснованным состав препарата, включающий бетаметазон – ГКС сильной степени активности, доказавший свою эффективность и безопасность, отличающийся рядом преимуществ по сравнению с другими ТГКС; клотримазол – активный в отношении всех возбудителей поверхностных микозов и перспективный антимикотик с доказанным опытом эффективности при большинстве форм дерматофитии, кандидоза кожи; гентамицин – эффективный в отношении S. aureus и других бактерий кожи антибиотик с низким риском устойчивости к нему в популяции.
Результатами проведенных исследований показано, что в условиях in vitro активность крема и мази Тридерм® в отношении наиболее значимых микроорганизмов, вовлеченных в патогенез дерматозов сочетанной этиологии (Staphylococcus spp., Enterococcus spp. и Candida spp.), была выше, чем у препаратов Акридерм® ГК. Вместе с тем для качественной и количественной оценки терапевтической эффективности целесообразно проведение последующих сравнительных клинических исследований.
Источник финансирования
Статья опубликована при поддержке компании АО «Байер».


