Введение
К одним из наиболее распространенных методов лечения злокачественных опухолей относится использование цитотоксических химиотерапевтических средств. Данный тип лечения, основанный на различии в скорости деления нормальных и раковых клеток, сопровождается рядом побочных эффектов из-за общей уязвимости клеток к цитотоксической терапии. Чтобы уменьшить или устранить эти побочные эффекты, разрабатываются целевые методы лечения (таргетная терапия), атакующие только те сигнальные пути, которые способствуют росту опухолей. Эти терапевтические средства приводят не только к более высокой эффективности, но и к различным специфическим побочным эффектам. Препараты таргетной терапии чаще всего направлены на протеинкиназы, при активации которых происходит передача сигналов в клетках и регуляция фундаментальных процессов пролиферации и дифференцировки клеток.
Рецептор эпидермального фактора роста EGFR (epidermal growth factor receptor или HER1) – трансмембранный гликопротеин (170 kD), относящийся к семейству рецепторов EGFR, состоящего из ErbB1 (Her1), ErbB2 (Her2), ErbB3 (Her3) и ErbB4 (Her4). EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток [1].
Гиперэкспрессия EGFR часто связана с метастатическим фенотипом заболевания и коррелирует с плохим прогнозом [2]. Избыточная экспрессия EGFR и/или одного из его лигандов (EGF, TGF-α) при различных эпителиальных опухолях может быть причиной активной пролиферации трансформированных клеток [3, 4].
Для подавления EGFR-зависимого сигнального каскада реакции используют моноклональные антитела, связывающие внеклеточный участок рецептора или участвующие в образовании неактивного комплекса с EGF и TGF-α, и низкомолекулярные ингибиторы, способные блокировать внеклеточный или внутриклеточный домен EGFR и прерывать процесс фосфорилирования.
Кожные токсические реакции являются самыми частыми нежелательными явлениями при назначении ингибиторов EGFR и развиваются у 80% пациентов, принимающих препараты данной группы. Даже если выраженность побочного эффекта не достигает 3–4-й степени (около 20%), токсические реакции с проявлениями на коже значительно снижают качество жизни пациентов [5, 6]. Таким образом, кожная токсичность негативно влияет на возможность полноценно проводить противоопухолевую терапию, что подтверждается результатами анкетирования медицинских работников: развитие побочных эффектов ингибиторов EGFR со стороны кожи у пациентов в 60% случаев приводило к снижению дозы химиотерапевтического препарата, а в 32% – к полной отмене [7].
Самое частое проявление кожной токсичности ингибиторов EGFR – акнеподобная сыпь (АС), частота ее возникновения достигает 90% [5, 8, 9]. Диагностика и лечение АС затруднены, т.к. она по-разному оценивается и описывается онкологами и дерматологами. Предложенные российские рекомендации по сопроводительному лечению АС [10] и исследования, направленные на улучшение терапии этого побочного эффекта [11, 12], требуют дальнейших уточнений и оптимизации.
Клиническая картина АС представлена пустулами, появляющимися в течение первых недель после начала терапии. Увеличение числа высыпаний происходит к концу первого месяца лечения ингибиторами EGFR, далее возможна тенденция к ухудшению состояния кожи, появление новых элементов после каждой инфузии [5, 8, 13–15], чему предшествует предшествуют дизестезия и эритема в области возникающих высыпаний [16]. Знания об активности кожного процесса в зависимости от режима использования ингибиторов EGFR позволяют использовать схемы сопроводительного лечения в период обострений АС и проводить своевременную профилактику данного осложнения у онкологических пациентов, что может повышать качество жизни больных и эффективность таргетной терапии.
Цель исследования: изучить динамику АС у онкологических пациентов, получающих лечение панитумумабом – моноклональным антителом к EGFR в инфузионной форме.
Методы
Изучение динамики клинических проявлений АС проводилось в группе из 15 пациентов с колоректальным раком, получавших полихимиотерапию (ПХТ) с включением панитумумаба. Выраженность проявлений АС осуществялась с помощью индекса IGA (Investigator's Global Assessment) по 5-балльной шкале (0–5), где объективные симптомы дерматологических нежелательных явлений (дНЯ) оценивались от 0 до 5 баллов по степени выраженности: 0 – нет проявлений, 1 – минимальные, 2 – легкие, 3 – умеренные, 4 – выраженные, 5– крайне выраженные проявления кожной реакции на противоопухолевую таргетную терапию. Период наблюдения составил 10 недель, в течение которых пациенты получили 5 сеансов ПХТ с панитумумабом в дозе 6 мг/кг массы тела (1 сеанс в 2 недели). Определение IGA проводилось в день второй инфузии панитумумаба (на 14-й день терапии), и далее ежедневно на протяжении 8 недель. Для статистического анализа использовалось программное обеспечение XLSTAT ,версия 2014.5.03, Addinsoft США. При проведении статистической обработки данных использованы методы описательной, а также непараметрической статистики.
Результаты
АС развивалась после второй инфузии панитумумаба в среднем на 17,5±3,8 дня терапии ингибиторами EGFR. Оценка тяжести АС по показателю IGA проводилась ежедневно с 14 дня ПХТ (вторая инфузия панитумумаба) на протяжении 56 дней (см. таблицу).
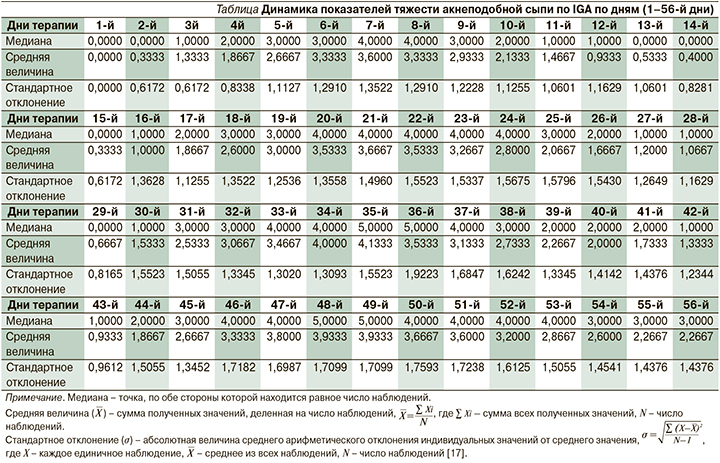
Выявлена волнообразная динамика кожной реакции в зависимости от инфузий моноклональных антител (рис. 1).
В первые недели терапии ингибитором EGFR возникновение АС было зарегистрировано на 3–4-й день после инфузии панитумумаба. Нарастание тяжести сохранялось вплоть до 7-го дня после введения препарата, затем отмечалось снижение активности кожной реакции и ее возобновление после очередного сеанса таргетной терапии с постепенным утяжелением после каждой инфузии моноклональных антител (рис. 1).
Клинический пример
Пациентка Н. 1969 г.р. В 2017 г. был поставлен диагноз «рак сигмовидной кишки рT4аN0M0». В январе 2017 г. проведена операция – обструктивная резекция сигмовидной кишки, после чего пациентка получила 12 курсов адъювантной ПХТ (январь–июль 2017 г.).
В марте 2018 г. отмечалось ухудшение процесса: в связи с закрытием стомы была произведена лапаротомия, при ревизии выявлен и гистологически верифицирован карциноматоз брюшины малого таза, метастазы в яичники. Выполнено восстановление непрерывности толстой кишки, двусторонняя аднексэктомия. Проведено 12 курсов ПХТ по схеме FOLFIRI+панитумумаб. По данным позитронно-эмиссионной компьютерной томографии (ПЭТ/КТ) от 13.10.18 на момент исследования по сравнению с исследованием от 22.06.18 отмечается уменьшение в размере параректального лимфатического узла, нивелирование метаболизма в послеоперационном шве. Признаков прогрессирования и рецидива не выявлено.
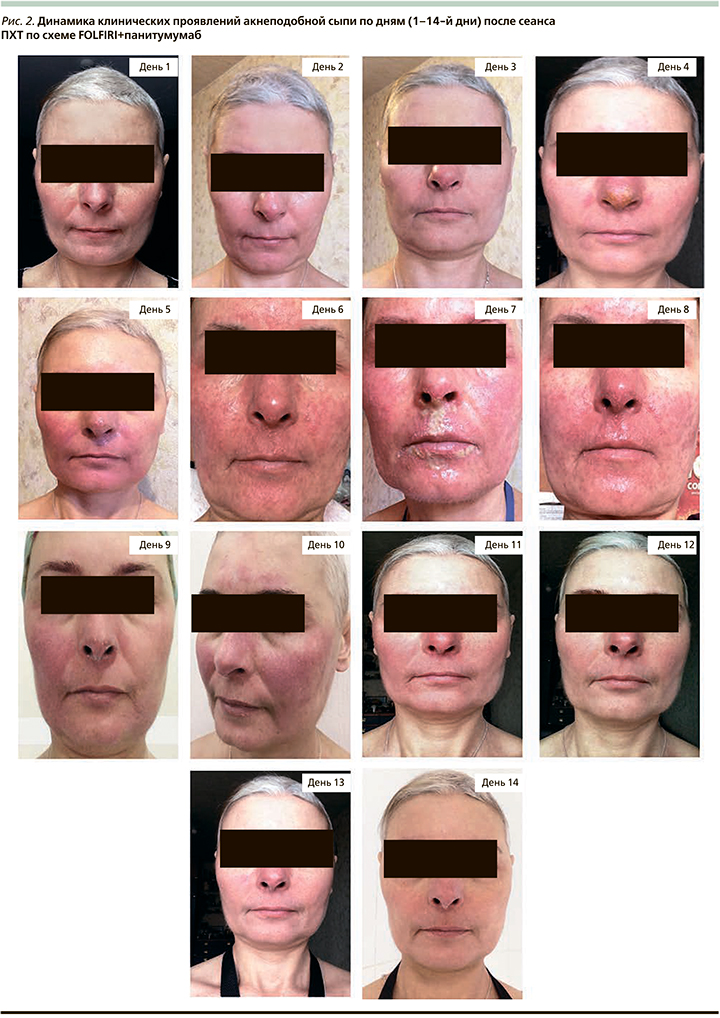
Во время проведения ПХТ по схеме FOLFIRI+панитумумаб отмечала появление кожной токсичности в виде акнеподобной сыпи на коже лица с волнообразной динамикой в зависимости от проведения инфузий (рис. 2).
Заключение
Выявленные особенности течения АС в зависимости от инфузии моноклональных антител (ингибиторов EGFR) позволяют назначать поддерживающую терапию АС в интермиттирующем режиме в период ожидаемого обострения (на 3-й день после инфузии) и отменять перед проведением сеанса химиотерапии для снижения лекарственной нагрузки.


