Актуальность
Акне вульгарное (аcne vulgaris) – хроническое воспалительное заболевание, проявляющееся открытыми или закрытыми комедонами и воспалительными поражениями кожи в виде папул, пустул, узлов. Приблизительно 95% мировой популяции переносят акне в течение жизни [1]. В 2010 г. акне занимало восьмое место среди самых распространенных заболеваний в мире [2], в то же время акне является самым распространенным дерматологическим заболеванием (13,2% всех консультаций дерматологов) [3].
Акне может наблюдаться в любой возрастной группе, однако чаще всего оно развивается в подростковом возрасте. Это мультифакториальный дерматоз, в патогенезе которого важную роль играют генетически обусловленная гиперандрогения и генетически детерминированный тип секреции сальных желез. Выделяют 4 основных звена патогенеза акне: увеличение продукции кожного сала, избыточный фолликулярный гиперкератоз, размножение Cutibacterium acnes и воспаление. Воспаление при акне первично, присутствует при всех формах и предшествует фолликулярному гиперкератозу, а С. acnes принимают активное участие в формировании микрокомедонов. В патогенезе акне задействовано множество различных медиаторов воспаления, часть которых активируется при пролиферации бактерий С. acnes (штаммы, участвующие в патогенезе акне, отличаются от штаммов здоровой кожи) в закупоренном протоке сальной железы [4–6].
По современной классификации выделяют четыре степени тяжести: комедональное акне, папуло-пустулезное средней и тяжелой степеней тяжести (при последнем в клинической картине могут быть единичные узлы) и очень тяжелое акне (узловатое, конглобатное, кистозное).
Тактика ведения пациентов зависит от степени тяжести, эффективности предыдущего лечения (если уже проводились курсы терапии) и качества жизни (например, при экскориированных акне даже при минимальных проявлениях акне может рекомендоваться системный ретиноид). В актуальных рекомендациях пересмотрены вопросы применения системных и топических антибиотиков (АБ), что связано с проблемами антибиотикорезистентности. Наибольшая частота встречаемости антибиотикорезистентности отмечается у пациентов со среднетяжелым и тяжелым течением акне [7]. Так, по данным ряда авторов, чувствительность штаммов С. аcnes к доксициклину составляла 28,8%, к тетрациклину – 31,1%, к эритромицину – 53,3%, к клиндамицину – 51,1% [8]. В связи с этим не рекомендуется использовать АБ в виде монотерапии, длительность курсов должна быть ограничена по времени до 8 недель, следует избегать назначения АБ для поддерживающей терапии и одновременного применения системных и топических АБ, особенно разных по химической структуре [9].
В последние годы наметилась тенденция к использованию противовоспалительных доз АБ в лечении пациентов с акне, в то же время указывается на необходимость применять бензоил пероксид (БПО) или фиксированную комбинацию адапален+БПО в терапии акне, показавшие эффективность даже при наличии антибиотикорезистентных штаммов Л.С. Круглова, Н.В. Грязева [7, 9].
В плане системной терапии акне из антибактериальных препаратов перспективным можно считать миноциклин (7-диметиламино-6‐диметил‐6‐дезокситетрациклин), наиболее часто назначаемый АБ при акне, который является полусинтетическим аналогом тетрациклина второго поколения [10]. Миноциклин обладает широким спектром антибактериального действия, включающий и грамположительную, и грамотрицательную флору, в т.ч. штаммы, устойчивые к пенициллинам и цефалоспоринам (стафилококки, стрептококки и т.д.). Препарат имеет лучший, чем тетрациклины первого поколения, фармакокинетический профиль; он полностью всасывается при приеме внутрь, и у него высокая биодоступность за счет липофильности [11]. Необходимо отметить, что прием пищи не влияет на биодоступность миноциклина. Препарат имеет высокий профиль безопасности и достаточно хорошо переносится. К наиболее распространенным побочным эффектам относятся тошнота, головокружение, полностью обратимые при прекращении приема препарата [12]. Миноциклин обладает противовоспалительным, антиапоптотическим и иммуномодулирующим действиями, а также, как было показано, нейропротективной активностью [13–15]. Путь CD40/40L регулирует ряд воспалительных процессов. Миноциклин снижает уровень CD40L на Т-клетках, тем самым оказывая противовоспалительное действие. Эти свойства не зависят от его антимикробной активности. Описанные неантимикробные свойства также объясняются способностью миноциклина ингибировать активность ключевых ферментов, таких как каспаза‐1 и -3, и усиливать BcL‐2 [16, 17]. Многие фармакологические преимущества миноциклина перед тетрациклинами первого поколения (окситетрациклином и тетрациклином) объясняются его повышенной растворимостью в липидах. Больший процент препарата всасывается из желудочно-кишечного тракта, и сывороточный период полувыведения увеличивается на несколько часов. Считается, что устойчивый уровень в крови способствует более высокой концентрации в коже и повышенному проникновению в кожный себум, хотя эта точка зрения спорна [18].
В результате высокой биодоступности миноциклина возможно использование более низких доз, что минимизирует риск развития нарушений колониальной резистентности [14].
Согласно клиническим рекомендациям Российского общества дерматовенерологов и косметологов по лечению акне вульгарного, миноциклин рекомендован в лечения узловатого акне умеренной и тяжелой степеней тяжести; конглобатного акне средне-тяжелой и тяжелой форм в дозе 50–200 мг/сут с общей длительностью терапии не более 8 недель (уровень убедительности рекомендаций – С, уровень достоверности доказательств – 2) [19]. Однако исследований по применению низких доз миноциклина в комбинации с топической терапией в доступной литературе нет, что определило цель данного исследования.
Цель исследования: повышение эффективности и безопасности терапии папуло-пустулезной формы акне путем включения в схему лечения системного антибиотика миноциклин в минимальной суточной дозировке 50 мг в сочетании с топической фиксированной комбинацией адапален+БПО в соответствии с клиническими рекомендациями.
Методы
В работе проводилась оценка эффективности и безопасности применения миноциклина в суточной дозировке 50 мг в комбинации с топической терапией фиксированной комбинацией адапален+БПО пациентов с папуло-пустулезным акне тяжелой степени.
В Российской Федерации с 2012 г. зарегистрирован и успешно применяется единственный препарат миноциклина – Минолексин капсулы по 50 и 100 мг № 20 в упаковке (производитель – АО «АВВА РУС», Россия). Под наблюдением находились 20 пациентов в возрасте от 14 до 39 лет. Среди них 16 женщин и 4 мужчин. В зависимости от возраста пациенты были распределены на 2 группы: 1-я (n=11) – вульгарное акне (пациенты 14–24 лет), 2-я группа (n=9) – акне взрослых (пациенты старше 25 лет). Все пациенты получали курс миноциклина в дозе 50 мг в сутки перорально в течение 6–8 недель, топический препарат (адапален+БПО) и специализированную дерматокосметику (очищение, увлажнение).
Оценка эффективности проводилась с учетом динамики показателей шкалы IGA (Investigator’s Global Assessment) [20]. В соответствии с данной шкалой эффективность определялась при IGA 0 (полное очищение) или IGA 1 (почти полное очищение) либо при улучшении на 2 балла по сравнению с исходным показателем. Кроме того, оценивалось влияние акне на качество жизни. Для этого использовался индекс HRQOL (Health-related quality of life). Была проведена оценка по 5-балльной шкале по четырем аспектам: самовосприятие, эмоциональная сфера, социальная сфера, симптомы акне [21].
Мониторинг безопасности включал общий и биохимический анализ крови (до терапии, через 1, 2 месяца от начала терапии). В биохимическом анализе крови определялись аспартатаминотрасфераза (АСАТ), аланинаминотрансфераза (АЛАТ), γ-глутамилтрансфераза (ГГТП), антинуклеарные антитела (ANA), такие нежелательные явления, как головная боль, тошнота, рвота, диспептические явления, пигментация, гепатотоксичность, волчаночно-эритематозно-подобный синдром.
Результаты
В соответствии с динамикой индекса IGA результаты 1-й группы были следующими: у 7 (64%) пациентов отмечено полное очищение кожи – IGA=0, у 4 (36%) – практически чистая кожа – IGA<1. Во 2-й группе у 5 (56%) пациентов отмечено полное очищение кожи – IGA=0, у 4 (44%) – практически чистая кожа – IGA<1 (рис. 1).
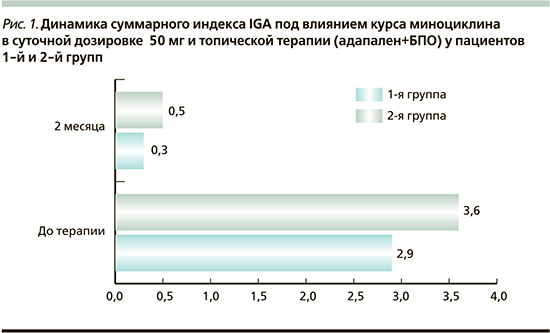
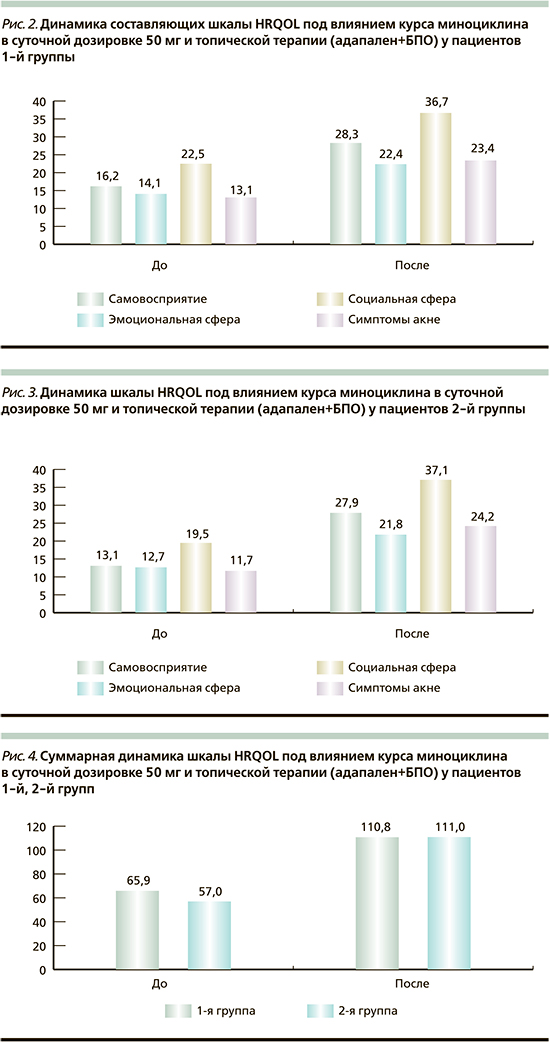
По данным опросника HRQOL, у пациентов 1-й группы показатели самовосприятия улучшились на 42,7%, эмоциональной сферы – на 37%, социальной сферы – на 38,7%, симптомы акне – на 44% (рис. 2).
У пациентов 2-й группы показатели самовосприятия улучшились на 53%, эмоциональной сферы – на 41,7%, социальной сферы – на 47,4%, симптомы акне – на 51,6% (рис. 3).
Суммарно, по данным шкалы HRQOL, имело место улучшение у пациентов 1-й группы на 40,5%, у пациентов 2-й группы на 48,6% (рис. 4).
Изменений со стороны формулы крови ни у одного пациента не было отмечено. Показатели АСАТ, АЛАТ, ГГТП у части (15%) пациентов через месяц имели тенденцию к увеличению, но не превышали 10% от исходных значений.
Данная отрицательная динамика не требовала отмены препарата и назначения гепатопротективной терапии. Уровни печеночных ферментов на протяжении всего периода наблюдения оставались в пределах нормы. Показатели ANA у пациентов групп исследования за период наблюдения не менялись. Среди побочных эффектов отмечались головная боль (5%), тошнота (10%), которые носили временный характер и не требовали специальной коррекции.
Обсуждение
Системные антибактериальные средства включены Американской академией дерматологии (ААД), Европейской академией дерматологии и венерологии (ЕАДВ), Российским обществом дерматовенерологов и косметологов (РОДВК). Миноциклин одобрен FDA и включен с 2012 г. во все зарубежные руководства в Европе, Америке, и Китае [1, 7, 19]. Миноциклин обладает широким спектром антибактериального действия, включающим и грамположительную, и грамотрицательную флору, в т.ч. штаммы, устойчивые к пенициллинам и цефалоспоринам (стафилококки, стрептококки и т.д.), которые помимо C. acnes могут играть определенную роль в поддержании воспаления при акне.
Основная проблема антибиотикотерапии – это растущая резистентность микроорганизмов ко всем антибиотикам, которая развивается и у C. acnes. Однако к миноциклину в настоящее время редко развивается резистентность. По данным современных исследований, резистентность C. acnes к эритромицину составляет 98%, к клиндамицину – 98,4%, к азитромицину – 100%, к тетрациклину – 30,8%, к доксициклину – 44,2%, к левофлоксацину – 9,6%, к миноциклину – 1,9% [22].
Миноциклин – наиболее липофильный антибиотик группы тетрациклинов, поэтому он легко преодолевает липидный слой мембраны бактериальной клетки – один из основных механизмов антибиотикорезистентности бактерий. Нужно учитывать, что миноциклин не применялся широко в России, следовательно, подавляющее большинство патогенных микроорганизмов не успело выработать резистентность. Кроме того, у миноциклина отсутствует перекрестная резистентность с другими препаратами тетрациклинового ряда и, следовательно, сохраняется чувствительность к миноциклину патогенных микроорганизмов, устойчивых к другим препаратам тетрациклинового ряда [23–25].
Эффект миноциклина в лечении акне не является дозозависимым, в связи с этим рекомендуется дозировка 50 мг/сут [26], при этом рядом авторов было показано, что при применении 1 мг/кг/сут (по сравнению с дозой 2 и 3 мг/кг/сут) частота развития побочных эффектов сопоставима с плацебо [27].
Несомненным преимуществом миноциклина является минимальное повышение фоточувствительности кожи по сравнению с другими тетрациклинами, поэтому препарат может назначаться в лечении пациентов с акне в течение всего года [28].
Выводы
- Системный антибактериальный препарат миноциклин высокоэффективен в сочетанном применении с фиксированной комбинацией адапалена+БПО у пациентов с папуло-пустулезным акне тяжелой степени, что подтверждается результатами проведенного клинического исследования.
- В результате проведенной терапии суммарно у 12 (60%) пациентов с папуло-пустулезным акне тяжелой степени было достигнуто полное очищение кожи – IGA=0 и у 8 (40%) пациентов была достигнута практически чистая кожа – IGA<1.
- Качество жизни пациентов с папуло-пустулезным акне тяжелой степени значительно улучшилось в результате проведенной терапии с включением миноциклина, о чем свидетельствуют индекс шкалы HRQOL (улучшение у пациентов 1-й группы на 40,5%, а у пациентов 2-й группы на 48,6%.
- Терапия антибактериальным препаратом миноциклин в сочетанном применении с фиксированной комбинацией адапалена+БПО является безопасной, о чем свидетельствуют результаты общего и биохимического анализа крови до и после лечения, а также отсутствие нежелательных явлений у пациентов, в т.ч. диспепсических симптомов со стороны желудочно-кишечного тракта.
Источник финансирования
Статья опубликована при поддержке АО «АВВА РУС», Россия.


