Введение
Лечение пациентов с местнораспространенными стадиями рака молочной железы (РМЖ), встречающимися в 20–25% случаев, уже в течение нескольких десятилетий начинается с первичной (неоадъювантной) терапии [1–3]. В последние годы неоадъювантное лечение все чаще используется и при операбельных опухолях с целью увеличения возможностей выполнения органосохраняющих операций, а также для ускоренной оценки эффективности новых видов терапии.
У 40–60% пациентов с полным клиническим ответом на системную терапию при микроскопическом исследовании гистологических препаратов выявляется резидуальная инвазивная опухоль [4]. С другой стороны, приблизительно у 20% больных с частичным клиническим ответом при микроскопическом исследовании определяется полный патоморфологический ответ (pCR). В рекомендациях по использованию критерия pCR для утверждения новых лекарственных препаратов FDA (США) определяет его как ypT0/is ypN0, что основывается на данных мета-анализа 12 тыс. пациентов, в котором обнаружено отсутствие различий в показателях выживаемости между группами ypT0 ypN0 и ypTis ypN0 [4]. Полный патоморфологический ответ (pCR) считается многими, но не всеми «суррогатным» маркером улучшения показателей выживаемости леченых пациентов [5].
Пациенты с остаточной опухолью после неоадъювантной химиотерапии (ХТ) подвержены большему риску рецидива заболевания по сравнению с теми, кто достиг pCR. До 2017 г. практически отсутствовали данные об эффективности дополнительной системной терапии, помимо «стандартного» лечения, которая бы снижала риск рецидива у пациентов с резидуальной опухолью. Даже у экспертов St.Gallen-2017 и ESMO-2017, -2018 не было единого мнения относительно того, следует ли рутинно назначать адъювантную терапию всем пациентам с резидуальной опухолью [6, 7].
Обычно под термином «постнеоадъювантное лечение» понимается терапия резидуального заболевания (остаточной инвазивной опухоли в молочной железе или в удаленных лимфатических узлах). На самом деле постнеоадъювантное лечение может предприниматься также в отношении пациентов, достигших полного патоморфологического регресса благодаря предоперационной терапии. Оно рекомендуется всем больным люминальными опухолями в виде многолетней эндокринотерапии (тамоксифен или ингибиторы ароматазы с супрессией овариальной функции агонистами ЛГ-рилизинг-гормона в пременопаузе), пациентам с HER2-позитивным ER-негативным РМЖ, достигшим pCR после неоадъювантной ХТ (таксаны, карбоплатин) в комбинации с таргетной терапией (трастузумаб±пертузумаб); рекомендуется продолжение таргетной терапии в адъюванте до года [7]. Назначение постнеоадъювантной терапии пациентам с трижды негативным РМЖ (ТНРМЖ), достигшим pCR после неоадъювантной терапии (антрацикли-ны±таксаны±карбоплатин), особенно больным с мутацией BRCA1/2, и использование PARP терапии (олапариб) остаются предметом рандомизированных клинических испытаний [8–10].
Роль дополнительной системной терапии в качестве постнеоадъювантного лечения в настоящее время изучается на пациентах с различными подтипами (фенотипами) РМЖ, особенно при самых агрессивных фенотипах: ТНРМЖ и HER2-позитивном РМЖ [11, 12].
Методы
В исследование включены сведения о 339 пациентах с РМЖ, получавших неоадъювантную системную терапию (НСТ) в НМИЦ онкологии им. Н.Н. Петрова МЗ РФ с 2015 по 2017 г.
Возраст женщин колебался от 28 до 77 лет, медиана возраста – 44 года. На амбулаторном этапе проводились следующие обследования: физикальное исследование (осмотр, пальпация), маммография, ультразвуковое исследование молочных желез, однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией (ОФЭКТ-КТ), трепан-биопсия опухоли с гистологическим и иммуногистохимическим исследованиями (ER, PR, Ki-67, HER2), пункционная биопсия подозрительных на метастазы подмышечных лимфатических узлов с цитологическим исследованием. На основании результатов оценки уровня экспрессии ER/PR, HER2, индекса пролиферации Ki-67, степени злокачественности (G) были определены иммуногистохимические подтипы (фенотипы) включенных в анализ пациентов.
У 102 (30,1%) больных был выявлен ТНРМЖ, у 102 (30,1%) – HER2-позитивный РМЖ, у 135 (39,8%) – люминальный В (ER+/HER2-) РМЖ. При дальнейшем анализе выяснилось, что опухоли 68 пациентов группы с HER2-позитивным РМЖ характеризовались ко-экспрессией рецепторов ER/PR и HER2, т.е. относятся ко второму варианту люминального В РМЖ. Пациенты с люминальным А РМЖ не включались в данное исследование, т.к. участвовали в отдельном исследовании неоадъювантной и постнеоадъювантной терапии.
Больные ТНРМЖ получили следующие схемы неоадъювантной терапии: 1) эрибулин+карбоплатин ×4 цикла, 24 (23,5%) пациента; 2) паклитаксел+карбоплатин×4, 26 (25,5%) пациентов; 3) AC×4 → паклитаксел×12, 13 (2,7%) пациентов; 4) паклитаксел+доксорубицин+карбо-платин×6, 37 (36,3%) пациентов.
Пациенты с ТНРМЖ с резидуальным заболеванием и регрессом 4–5-й степени по Miller-Payne и ypN+ получали две схемы адъювантной терапии: 1) FAC ×4 или АС×6, 39 (38,2%) пациентов; 2) капецитабин 4–6 циклов, 40 пациентов (39,2%).
Пациенты с HER2-позитивным РМЖ получали следующие схемы неоадъювантной терапии: 1) доцетаксел ×4 →FEC 4+трастузумаб, 8 циклов, 24 (47%) пациента; 2) АС×4 →доцетаксел×4+трастузумаб, 8 циклов, 22 (43%) пациента.
Пациенты с HER2-позитивным РМЖ с резидуальным заболеванием продолжали получать адъювантную таргетную (анти-HER2) терапию вместе (у части пациентов) с ХТ карбоплатином или капецитабином. Пациенты, достигшие 5-й степени регресса опухоли по Miller-Payne, продолжали получать трастузумаб после операции, т.е. в адъювантном режиме, до 1 года (без ХТ).
Пациенты с люминальным В (вариант ER+/HER2-) получали: 1) неоадъювантную эндокринотерапию (антиэстрогены или ингибиторы ароматазы 4 месяца), 36 (26,6%); 2) неоадъювантную ХТ АС×4 → паклитаксел×12; 3) ХТ по схеме FAC×6, 44 пациента (32,6%). 68 пациентов со вторым вариантом люминального В подтипа (ER+/HER2+) получали неоадъювантную ХТ: АС-4/FEC-4+ доцетаксел×4 →трастузумаб×4/8. У пациентов с резидуальным заболеванием (вариант ER+/HER2-) продолжалась адъювантная эндокринотерапия до 5 лет, у части из них с предварительной адъювантной ХТ.
При втором варианте (ER+/HER2+) продолжалась таргетная (анти-HER2) терапия до 1 года+ХТ с последующей эндокринотерапией до 5 лет. Адъювантная эндокрионотерапия до 5 лет проводилась и пациентам с люминальным В, достигших регресса 5-й ст. по Miller-Payne.
Материалом для исследования служили трепан-биоптаты опухолей молочной железы, взятые до начала НСТ, и хирургические препараты, полученные после ее завершения. Оценку степени лечебного патоморфоза проводили по классификации ypTNM, Miller-Payne и RCB (Residual Cancer Burden).
Результаты
В результате проведенного неоадъювантного системного лечения выраженный патоморфологический регресс опухоли (Miller-Payne 5-й ст. или RCB 0–1) достигнут 59 (58%) из 102 пациентов с ТНРМЖ. Соответственно, у 43 (42%) пациентов выявлено резидуальное заболевание (табл. 1). Чаще всего (в 62,5% случаев) резидуальное заболевание определялось у пациентов, получавших эрибулин+карбоплатин. Реже всего (в 27% случаев) резидуальное заболевание встречалось у пациентов, получавших комплекс «паклитаксел+доксорубицин+карбоплатин», 6 циклов.
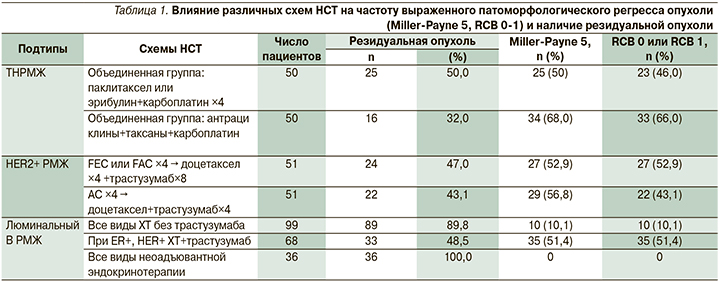
В объединенной группе пациентов, получавших таксаны+карбоплатин, резидуальная опухоль выявлена у 50% больных (табл. 2). Во 2-й объединенной группе пациентов с ТНРМЖ, получавших такую же терапию+антрациклины, резидуальная опухоль выявлялась реже (в 32% случаев; p=0,52).
У 56 пациентов (54,9%) с HER2-позитивным РМЖ достигнут патоморфологический регресс 5-й ст. по Miller-Payne. Резидуальное заболевание выявлено у 46 (45,0%) больных. При сравнении 2 групп пациентов, получавших НСТпо схеме «FAC×6, или FEC 6, или FEC×4+трастузумаб» по сравнению со схемой «АС×4 →доцетаксел×4+трастузумаб», резидуальное заболевание выявлено у 47,0 и 43,1% больных соответственно (p>0,5). Включение в схему неоадъювантной ХТ анти-HER-препаратов (трастузумаб) уравняло шансы достижения полного патоморфологического регресса (52,9 против 56,8%; p>0,5).
У пациентов с люминальным В-подтипом (вариант ER+/HER2-), получавших неоадъювантную эндокринотерапию (антиэстрогены или ингибиторы ароматазы), 5-я ст. патоморфологического регресса по Miller-Payne не была достигнута ни разу. У получавших неоадъювантную ХТ (АС×4 →паклитаксел×12; FAC×6), 5-я степень регресса достигнута в 10 из 99 случаев (10,1%). У 89,8% пациентов выявлена резидуальная опухоль.
При втором варианте люминального В-подтипа (ER+/HER2+) выраженный патоморфологический регресс (5-я ст. по Miller-Payne) достигнут у 35 из 68 (51,4%) пациентов, получавших неоадъювантную ХТ AC×4 или FAC×4 → таксаны+трастузумаб. У остальных (48,5%) пациентов выявлена резидуальная опухоль.
Таким образом, у пациентов с люминальным В-подтипом РМЖ с ко-экспрессией рецепторов стероидных гормонов и HER2+ добавление к неоадъювантной ХТ таргетной (анти-HER2) терапии увеличивает шансы достижения полного патоморфологического регресса по сравнению с одной ХТ и, соответственно, снижает частоту оставления резидуальной опухоли с 89,8 до 48,5% (p=0,034).
Из 339 пациентов, включенных в исследование, 235 (69,5%) подверглись мастэктомии, 104 (30,6%) проведена ораганосохраняющая операция (ОСО). Среди 212 пациентов с резидуальной опухолью 166 (78,3%) подверглись мастэктомии, 46 (21,7%) – ОСО. Среди 127 пациентов, достигших благодаря НСТ выраженного патоморфологического регресса опухоли (5-й ст. по Miller-Payne или RCB 1), 69 (54,3%) больных подверглись мастэктомии, 58 (45,7%) – ОСО. Таким образом, частота выполнения органосохраняющих операций пациентам, достигшим выраженного патоморфологического регресса опухоли (5-я ст. по Miller-Payne или RCB 0–1) RCB I), увеличивалось в 2 раза по сравнению с больными с наличием остаточной (резидуальной) опухоли (с 21,7 до 45,7%; p=0,048).
При медиане наблюдения в 41 месяц местный рецидив выявлен у 23 (10,8%) из 212 пациентов с резидуальной опухолью и у 5 (3,9%) из 127 – с выраженным патоморфологическим регрессом (5-я ст. по Miller-Payne или RCB 0–1; p=0,046). Рецидив заболевания (включая местно-региональный рецидив и отдаленные метастазы) выявлен у 74 из 339 (21,8%) пациентов, табл. 3.
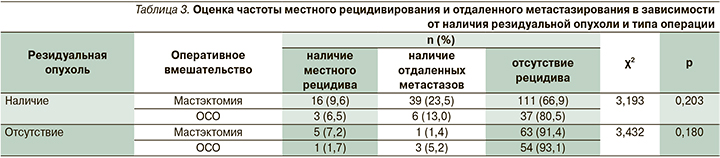
При этом во всей изученной группе пациентов (безотносительно фенотипа и варианта неоадъювантного и адъювантного системного лечения) рецидив заболевания выявлен у 61(26,0%) из 235 пациентов, подвергшихся радикальной мастэктомии, и лишь у 13 из 104 (12,5%) больных, подвергшихся органосохраняющему лечению (p<0,05). Эти отличия объясняются тем, что мастэктомии в основном выполнялись пациентам с большим объемом резидуальной опухоли (RCB 2–3, Miller-Payne 1–3-й ст.), в то время как органосохраняющее лечение проводилось пациентам, достигшим полного или выраженного (Miller-Payne 4–5-й ст., RCB 1) регресса опухоли.
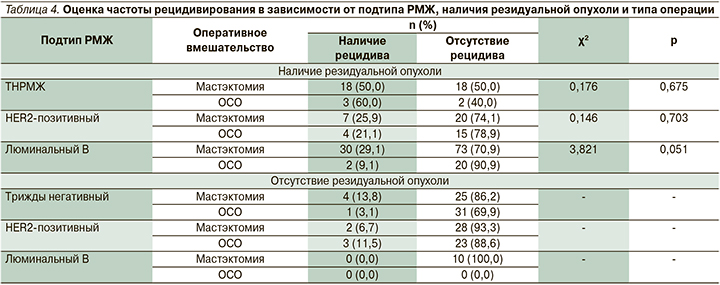
При достижении выраженного патоморфологического регресса (Miller-Payne 4–5-я ст., RCB 0–1) риск рецидива заболевания в первые 3,5 года после операции относительно невелик (от 3,1 до 13,5%) и достоверно не отличается при различных фенотипах РМЖ. Совершенно другая ситуация, когда эффект неоадъювантной терапии оказался минимальным с определением остаточной инвазивной опухоли в молочной железе или удаленных региональных лимфоузлах. Как следует из табл. 4, при наличии резидуальной опухоли рецидив заболевания возник у 21 из 41 пациента (51,2%) с ТНРМЖ, у 11 из 46 (23,9%) с HER2-позитивным РМЖ и у 32 из 125 (25,6%) с люминальным В-подтипом. Таким образом, при ТНРМЖ, в случаях когда не удается достичь полного патоморфологического регресса опухоли и остается инвазивная карцинома в молочной железе или региональных лимфоузлах, прогноз заболевания особенно отягощен и риск его рецидива (локальный и дистанционный) в 2 раза превышает таковой у пациентов с HER2-позитивным и люминальным В-подтипами (51,2 против 23,9 и 25,6%; p=0,02).
Обсуждение
При изучении отдаленных результатов лечения оказалось, что наличие резидуальной опухоли существенно ухудшает прогноз и показатели 3-летней безрецидивной и общей выживаемости при всех подтипах, особенно при ТНРМЖ (48,8 против 91,8%; p=0,01).
При достижении выраженного патоморфологического регресса (Miller-Payne, 5-я ст., RCB 0–1) показатели 3-летней безрецидивной выживаемости при различных подтипах РМЖ достоверно не различаются (91–91,8%).
При коэкспрессии ER+ и HER2+ (частично люминальный В подтип) все пациенты получали адъювантную анти-HER2-таргетную терапию до 1 года+эндокринотерапию до 5 лет. При этом адъювантный этап оказался таким же у пациентов, достигших на неоадъювантном этапе регресс 5-й ст. по Miller-Payne. С точки зрения долгосрочного прогноза главным фактором оказалось само достижение pCR или, наоборот, наличие резидуальной опухоли при всех подтипах РМЖ. Дальнейшие исследования неоадъювантного и постнеоадъювантного лечения с применением ингибиторов CDK 4/6 (палбоциклиб) и mTOR (эверолимус) покажут новые возможности преодоления резистентности к эндокринотерапии.
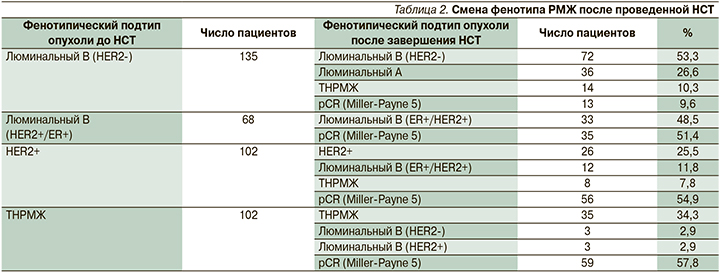
Как указывалось выше, 41 пациент с ТНРМЖ с резидуальной опухолью должен был получать после операции адъювантную ХТ (схемы FAC×4, AC×6 или капецитабин×6). На самом деле такую терапию получали 79 пациентов, достигших регресса-5 по Miller-Payne, но имевших метастазы в удаленных лимфатических узлах (38 больных). При использовании 1-й схемы (FAC ×4 или АС×6) рецидив заболевания выявлен у 13 из 39 (33,3%) пациентов. В группе больных, получавших адъювантное лечение капецитабином, рецидив заболевания выявлен у 8 из 40 пациентов (20,0%; p=0,050). Использование указанных схем в принципе снижало риск рецидива заболевания в обеих группах (отношение рисков – 3,5; 95% доверительный интервал – 1,0–11,8 и отношение рисков – 3,2; 95% доверительный интервал – 1,1–9,8). Но при этом риск летального исхода в большей мере снижался при использовании капецитабина, что и отражает более выраженную тенденцию к улучшению общей выживаемости. Под влиянием НСТ у части пациентов снижается не только стадия опухоли, но и клеточная плотность, индекс пролиферации Ki-67, меняется экспрессия рецепторов стероидных гормонов (ER/PR), HER2. Меняется и иммуногистохимический (ИГХ) фенотип опухоли. По нашим данным (табл. 2), приблизительно в 20% случаев происходит разнонаправленная смена ИГХ фенотипа, иногда в более благоприятную сторону (с экспрессией ER и PR), иногда в неблагоприятную – в сторону ТНРМЖ.
В уже завершенных клинических исследованиях адъювантного лечения резидуальных опухолей (CREATE-X), оценивавших фторпиримидины (капецитабин) при HER2-негативных опухолях или в проекте KATHERINE по оценке эффективности трастузумаба-эмтанзина (T-DM1) учитывался только первичный (до неоадъювантной терапии) фенотип РМЖ по материалу трепан-биопсии [13, 14].
Поэтому следующими шагами в поисках эффективных лекарственных средств должны быть широкие клинические испытания, учитывающие не только первичный (исходный) ИГХ-фенотип, но и молекулярный подтип резидуальной опухоли, оказавшейся не чувствительной к первичной терапии
Заключение
Пациенты с РМЖ любого ИГХ-подтипа, подвергшиеся НСТ и не достигшие патоморфологического полного ответа (pCR), нуждаются в альтернативной адъювантной терапии.
У пациентов с ТНРМЖ с резидуальной инвазивной опухолью после стандартной неоадъювантной ХТ, содержащей антрациклины и таксаны, назначение адъювантной терапии капецитабином и в целом использование фторпиримидинов улучшают показатели безрецидивной выживаемости.
Как показано в исследовании KATHERINE [14], у пациентов с HER2-позитивным РМЖ, не достигших pCR после стандартной неоадъювантной ХТ (+трастузумаб и пертузумаб), адъювантное таргетное лечение препаратом T-DM1 улучшает показатели выживаемости. В качестве альтернативы могут быть использованы отличные от неоадъювантной ХТ режимы+плюс таргетная анти-HER2-терапия.
Пациенты с люминальными опухолями (ER+/HER2-) с резидуальной опухолью после неоадъювантной эндокринотерапии (антиэстрогены, ингибиторы ароматазы, фулвестрант) и с опухолями, не чувствительными к неоадъювантной эндокринотерапии (в первые 4 недели лечения) нуждаются в адъювантной ХТ, включая таксаны.
Пациенты с люминальным В РМЖ (ER+/HER2+) с резидуальной опухолью после неоадъювантной терапии (анти-HER2-таргетная терапия+плюс эндокринотерапия или ХТ) нуждаются в альтернативной эндокринотерапии (фулвестрант) или ХТ (карбоплатин, капецитабин)+анти-HER2-терапия (TDM-1). При люминальных опухолях исследуются препараты, позволяющие преодолевать резистентность к эндокринотерапии в неоадъювантной и постнеоадъювантной терапии: ингибиторы CDK 4/6 (палбоциклиб, рибоциклиб), ингибиторы mTOR (эверолимус) и др. [15–21].
Дальнейший прогресс в лечении наиболее агрессивных типов РМЖ (трижды негативного и HER2-позитивного фенотипов) связывается с иммунотерапией. Уже завершены или продолжаются исследования прогностического или предиктивного значения опухоль-инфильтрирующих лимфоцитов (TILs). В рамках рандомизированных клинических испытаний оценивается вклад анти-PD-L1-иммунотерапии (атезолизумаб) в комбинации с химио- (ТНРМЖ) или с таргетной терапией (HER2+) при лечении пациентов с метастатическим или местнораспространенным РМЖ [22–27].


