Актуальность
Проблема профилактики и терапии тромбозов у беременных, рожениц и родильниц остается одной из самых актуальных в современном акушерстве. Ей посвящено множество исследований, печатных работ, приказов и клинических рекомендаций. Разобраться в этом изобилии материалов практическому врачу бывает весьма непросто. С чем связан рост популярности данной темы в последнее время? Причин немало.
Прежде всего изменились пациентки, с которыми имеет дело акушер: они в большинстве своем стали старше, а значит, имеют существенно бо́льший груз экстрагенитальной патологии и бо́льшие риски тромботических осложнений [1]. Так, в развитых странах увеличение частоты сердечно-сосудистых заболеваний, относящихся к группе высокого риска реализации тромботических осложнений, у беременных коррелирует с увеличением возраста первой беременности, который колеблется между 28,8 и 31,1 года [2]. Еще большие сердечно-сосудистые риски, которые в западных странах служат главной причиной материнской смертности, возникают в позднем репродуктивном возрасте, особенно на фоне других соматических проблем (сахарный диабет, артериальная гипертензия, ожирение), которые сами по себе являются фактором риска тромбозов [3]. Кроме того, в мире увеличивается число больных врожденной соматической патологией, достигающих детородного возраста, и женщин, для которых возможность выносить беременность появилась только с развитием новых медицинских технологий (протезированные пороки, коррекция обменных нарушений, вспомогательные репродуктивные технологии) – все они также относятся к группе высокого тромботического риска и нередко получают антитромботическую терапию пожизненно [4].
Следующая причина актуальности обсуждаемой темы – увеличение числа пациенток, для которых необходимость антикоагулятной терапии (АКТ) во время беременности и после родов очевидна в связи с генетически детерминированными (например, мутация фактора V и гена протромбина) и приобретенными (антифосфолипидный синдром) изменениями системы гемостаза, ведущими к гиперкоагуляции. Они также относятся к категории высокого тромботического риска [5–7].
Еще одна группа пациенток, в отношении которых обсуждается целесообразность АКТ, – женщины с проблемой невынашивания беременности, однако в настоящее время этот вопрос остается дискутабельным [8].
Беременность сама по себе – гиперкоагуляционное состояние с повышенным уровнем тромбоэмболий, преимущественно тромбоэмболии легочной артерии (ТЭЛА) и тромбоза глубоких вен. На сегодняшний день ТЭЛА является одной из ведущих причин материнской смертности в мире [9]. Риск венозных тромбоэмболических осложнений (ВТЭО) у беременных в структуре материнской заболеваемости и смертности достигает 4,7 на 100 тыс. рожденных живыми детей и продолжает расти во всем мире [10]. Многочисленные клинические факторы риска (тромбофилии, водный и электролитный дисбаланс, ожирение, возраст старше 35 лет и пр.) могут внести свой вклад в 5-кратное увеличение риска ВТЭО у беременных [11]. К исходному уровню (как до беременности) система гемостаза у родильниц возвращается только через 6 недель после родоразрешения, хотя все больше исследований описывают сохранение состояния гиперкоагуляции до 180 дней постнатального периода [12].
Таким образом, постоянный рост числа беременных высокого риска с ВТЭО и высокой вероятностью неблагоприятного исхода делает очевидной необходимость АКТ. Для понимания «кому», «когда» и «в каких дозах» она должна быть назначена, необходимо четко рассчитывать этот риск с выделением групп высокого, промежуточного и низкого рисков, а далее проводить его документированную переоценку в динамике: в прегравидарном периоде, на раннем сроке гестации, при осложнениях – на всем протяжении всей беременности, перед родоразрешением и в раннем послеродовом периоде, когда тромбоэмболия наиболее вероятна (до 0,5%) [13]. Каждый единичный фактор риска повышает возможность реализации ВТЭО у беременных в 2,5 раза [14], а проведение профилактической терапии антикоагулянтами снижает этот риск с 2,4–12,2 до 0–5,5% [15].
Возможности антикоагулятной терапии
На сегодняшний день перечень средств для АКТ у беременных, рожениц и родильниц ограничен тремя группами препаратов:
1) нефракционированный гепарин (НФГ) – его применение чревато гепарининдуцированной тромбоцитопенией (а значит, требует контроля уровня тромбоцитов каждые 2–3 дня), при длительной терапии – потерей массы костного вещества [16]; 2) антагонисты витамина К – только для пациенток с механическими клапанами сердца их назначение повышает риск невынашивания [17], эмбрио- и фетопатических [18, 19] нарушений и не является предметом обсуждения данного обзора; 3) низкомолекулярные гепарины (НМГ) – часто являются препаратом выбора для профилактики и лечения ВТЭО во время беременности из-за легкости управления, лучшей биодоступности и профиля безопасности, а также более предсказуемого дозирования по сравнению с НФГ [20]. В частности, доказаны более низкий уровень гепарининдуцированной тромбоцитопении [21], минимальный – остеопороза (0,04% беременных, получающих НМГ) [16] и кровотечений, описанных у беременных, получающих НМГ, по сравнению с НФГ [22]. Принятие решения о терапии НМГ во время беременности – ответственный шаг, поскольку при наличии показаний их назначают в течение всей последующей беременности и послеродового периода. Курсовое лечение НМГ недопустимо [23]. Один из самых востребованных акушерских антикоагулянтов, надропарин кальция, был внесен в Российские клинические рекомендации по профилактике ВТЭО в акушерстве и гинекологии во время беременности и родов в 2014 г. [24].
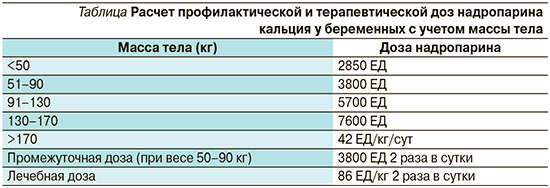
Актуальная тема для дискуссии в современном акушерстве – режим дозирования препарата. Расчет профилактической дозы НМГ (в зависимости от подсчитанного коэффициента риска ВТЭО и никак иначе!) производится врачом-акушером-гинекологом при постановке беременной на учет, исходя из массы тела на раннем сроке (в таблице приведены дозы НМГ на примере надропарина кальция) [25]. Индивидуальный подбор дозы препарата особенно важен для женщин с ожирением – это вариант максимально быстро достичь оптимальных параметров анти-Ха – показателя, который демонстрирует антикоагулянтную, противосвертывающую активность гепарина, позволяет оценивать действие гепариновой терапии и корректировать дозу препарата, определив, насколько угнетена активность IIа и Xа-факторов свертывания крови [26]. Подобный контроль беременных с ВТЭО важен еще и потому, что с увеличением срока растет потребность в дозе антикоагулянта и инструмент для оценки адекватности терапии необходим. НМГ могут быть назначены только при возможности еженедельного мониторирования уровня анти-Ха [27]. Кроме того, несмотря на рекомендуемые профилактические и терапевтические дозы, восприимчивость каждой беременной к препарату разная и зависит от возраста, веса и других индивидуальных особенностей. Это подтверждают описанные случаи возникновения ТЭЛА даже у беременных, получающих НМГ [28]. Целевые показатели анти-Ха от 0,7 до 1,2 МЕ/мл через 4–6 часов после подкожного введения гепарина [29]. В локальном отечественном протоколе [13] одобрено применение понятия «промежуточная доза» по данным исследования изменения активности антикоагулянтов у беременных [30]. Его введение аргументируется появлением новой антикоагулянтной фармакокинетики, связанной с физиологическими гестационными изменениями: увеличением объема распределения препарата, клиренсом, биодоступностью, более активным связыванием препарата плазменными белками и более низкими пиковыми концентрациями в плазме, чем у небеременных. При персонифицированном подборе дозы препарата важно помнить, что 1 ЕД надропарина кальция соответствует 0,41 МЕ анти-Ха.
Лечебные дозы НМГ назначаются при острой венозной тромбоэмболии – ТЭЛА и тромбозе глубоких вен дважды в день с расчетом дозы препарата на килограмм веса пациентки при раннем сроке гестации. Так, для беременной весом 70 кг терапевтическая доза надропарина кальция составит 6020 ЕД 2 раза в сутки.
Родоразрешение беременных, получающих антикоагулянтную терапию, – плановая междисциплинарная задача. Кроме акушера и анестезиолога может возникнуть необходимость привлечения к консилиуму гематолога или эксперта по тромбозам: например, если есть опасения, что пациентка не сможет длительно обходиться без антитромботической терапии [31]. Аналогичные коммуникации должны включаться при плановых акушерских процедурах у беременных, получающих НМГ (серкляж, индукция родов, плановое кесарево сечение, неакушерские операции) [31]. Показания к абдоминальному родоразрешению – исключительно акушерские. Родовозбуждение (или кесарево сечение) беременных высокого риска ВТЭО желательно планировать после 38 полных недель беременности, дабы пациентка не оказалась в состоянии акоагуляции экстренно. При этом терапевтическую дозу надропарина заменяют на НФГ не позднее, чем за 36 часов до манипуляции, с последующей его отменой за 4–6 часов до предполагаемых родов (и/или применения регионарных методов обезболивания) [23]. Это необходимо потому, что полная блокада антикоагулянтной активности протамина сульфатом возможна только в отношении НФГ, тогда как активность НМГ он может блокировать лишь на 60–80%. Связано это с бо́льшим периодом полувыведения и более длительным периодом рассасывания препарата НМГ из подкожной клетчатки [32]. В случае экстренного родоразрешения пациенток, получающих НМГ, начинать все равно приходится с протамина сульфата, однако может потребоваться его повторное введение [33]. При неэффективности протамина сульфата для инактивации НМГ рекомендуется использовать четырехфакторный концентрат протромбинового комплекса, а не свежезамороженную плазму, однако доказательной базы в акушерстве относительно экстренной блокады НМГ в такой ситуации нет [34, 35].
Беременным, получающим профилактическую дозу надропарина кальция 2 раза в сутки, накануне родоразрешения отменяется вечерняя инъекция с тем, чтобы на следующий день минимизировать акушерские и анестезиологические геморрагические риски [23, 31], т.е. с момента последней инъекции препарата должно проходить не менее 24 часов. При длительном ведении родов per vias naturales у рожениц высокого риска ВТЭО возможна коррекция гиперкоагуляции инфузией НФГ с ее прекращением за 4–6 часов до применения регионарной анестезии (под контролем АЧТВ). Все пациентки, получавшие во время беременности антикоагулянтную терапию, относятся к группе высокого риска кровотечений в родах и нуждаются в дополнительных превентивных мерах по его профилактике в соответствии с действующими протоколами [36].
Родильницам высокого риска терапия НФГ может быть возобновлена через 6 часов после родов. Введение надропарина кальция (в т.ч. в лечебных дозах) для профилактики риска ВТЭО вкупе с компрессионным трикотажем рекомендуется возобновить/начать через 12 часов после родоразрешения, переоценив риски ВТЭО. Надропарин кальция родильницам с высоким риском ВТЭО назначается в послеродовом периоде на 6 недель и не имеет противопоказаний при лактации [13]. Вероятность возникновения тромботических осложнений у рожениц в первые 3 месяца после родов увеличивается по сравнению с небеременными пациентками в 60 раз [37, 38]. В этой ситуации очень важна мотивированная приверженность терапии. В противном случае значимо возрастает риск тромбозов в послеродовом периоде: у 3 из 5 пациенток, пропустивших хотя бы одно введение препарата, возникают острые тромбоэмболические осложнения. Риск тромбоза глубоких вен увеличивается при однократном пропуске НМГ в 5 раз [39].
В заключение стоит отметить, что число применяющих АКТ беременных, рожениц и родильниц как пациенток врачей разных специальностей в ближайшем будущем, вероятно, будет увеличиваться. Поэтому важно соблюдение принципов единого междисциплинарного подхода к решению общих задач в интересах будущих матерей.
Заключение
В обзоре представлены данные исследований и действующих протоколов, посвященных вопросу профилактики и терапии тромботических осложнений у беременных, рожениц и родильниц.
Резюмируя представленные материалы, можно выделить следующие рекомендации:
- НМГ остаются препаратом выбора для профилактики и терапии ВТЭО у беременных и родильниц.
- Дозу НМГ следует определять, исходя из массы тела пациентки на раннем сроке беременности.
- Документированную оценку риска ВТЭО необходимо проводить в прегравидарном периоде, в раннем сроке гестации, при осложнениях – на протяжении всей беременности, перед родоразрешением и в раннем послеродовом периоде.
- Необходимо оценивать эффективность АКТ и проводить своевременную коррекцию дозы НМГ на основании еженедельного определения анти-Ха-активности.
- Беременных высокого риска ВТЭО, получающих лечебные дозы НМГ, за 36 часов до планового родоразрешения следует переводить на НФГ, который отменяется за 4–6 часов до применения регионарной анестезии под контролем АЧТВ.
- Беременным низкого риска, получающим НМГ, следует планировать родоразрешение через сутки после отмены препарата.
- Беременные, получавшие антенатально НМГ, представляют группу высокого риска по кровотечению в родах и нуждаются в дополнительных мерах его профилактики.
- Родильницам терапию НМГ следует назначать через 12 часов после родоразрешения.
- Пациенткам высокого риска ВТЭО необходимо проводить АКТ в послеродовом периоде в течение 6 недель.
- Надропарин кальция безопасен и эффективен для лечения ВТЭО во время беременности и в послеродовом периоде.
Источник финансирования
Статья опубликована при финансовой поддержке компании «Аспен».


