Введение
В настоящее время бронхиальная астма (БА) рассматривается как гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей. Гетерогенность проявляется вариабельностью клинических и функциональных признаков, особенностями течения (степенью тяжести) и исходами болезни, а также различными патофизиологическими механизмами и клетками воспаления [1, 2]. Большинству пациентов современная терапия ингаляционными глюкокортикостероидами (ИГКС) и длительно действующими β2-адреноагонистами (ДДБА) позволяет достигать контролируемого (полностью или частично) течения БА. Однако у 5–10% больных астмой наблюдается более тяжелое рефрактерное течение болезни с плохим контролем, частыми обострениями, требующими применения системных глюкокортикостероидов (СГКС), ускоренной потерей функции легких, несмотря на интенсивное лечение [3].
Определение и медико-социальное значение тяжелой бронхиальной астмы
В 2014 г. ERS (European Respiratory Society) совместно с ATS (American Thoracic Society) было принято определение, в соответствии с которым БА считается тяжелой, если для поддержания ее контроля требуются высокие дозы ИГКС в сочетании со вторым препаратом базисной терапии (и/или СГКС) или же контроль не достигается, несмотря на такое интенсивное лечение [3]. В дальнейшем руководством GINA (Global Initiative for Asthma) было уточнено, что тяжелая БА требует лечения, соответствующего 4–5-й ступеням терапии [4]. Аналогичные международным критериям тяжелой БА используются и в национальных рекомендациях [5, 6].
Во всех этих документах подчеркивается, что неконтролируемая и тяжелая БА не равнозначные понятия. Тяжелой считается астма, которая не контролируется, несмотря на приверженность пациента к максимально оптимизированной терапии, при наиболее полном устранении триггерных факторов и адекватном лечении коморбидной патологии. Тяжесть БА у пациентов, получающих лечение, оценивается ретроспективно (обычно через несколько месяцев), исходя из объема терапии, необходимого для контроля симптомов и обострений. Тяжелую БА нередко называют «тяжелой рефрактерной астмой», поскольку она определяется как невосприимчивая к лечению высокими дозами ИГКС [3]. Однако с появлением таргетной терапии понятие «рефрактерная БА» значительно сузилось. Поэтому в ретроспективную оценку тяжести БА в настоящее время включают и ответ на лечение иммунобиологическими препаратами (5-я ступень по GINA), в т.ч. если после их отмены течение астмы вновь ухудшается [4].
Именно тяжелая БА в наибольшей степени ассоциирована с низким качеством жизни, снижением и потерей трудоспособности, высокой частотой обострений и госпитализаций, в т.ч. в отделения реанимации и интенсивной терапии с интубацией трахеи и искусственной вентиляцией легких. В случае проведения искусственной вентиляции легких у больных астмой летальность достигает 7% [5].
С тяжелой астмой связаны очень высокие расходы здравоохранения из-за стоимости лекарств, врачебных посещений, госпитализаций, а также затрат на лечение побочных эффектов СГКС. Показано, что расходы здравоохранения на одного пациента с БА выше, чем при сахарном диабете 2 типа, инсульте или хронической обструктивной болезни легких, а затраты на тяжелую неконтролируемую астму составляют более 60% от стоимости лечения всех больных БА [4]. Пациенты с тяжелой астмой и их семьи также несут значительное финансовое бремя не только в связи с расходами на медицинскую помощь и лекарства, но и из-за потерянных доходов и ограничений в выборе карьеры.
Тяжелая эозинофильная бронхиальная астма
Многие годы тяжелая БА остается предметом многочисленных исследований, в которых анализируются особенности клинических, молекулярных и воспалительных эндо- и фенотипов этого заболевания [7–10]. И хотя в настоящее время отсутствует общепринятая классификация фенотипов, субфенотипов и эндотипов БА, в клинической практике определяют фенотипы астмы, которые достаточно просто идентифицируются с помощью рутинных методов диагностики. Часто выделяют такие фенотипы БА, как аллергическая, неаллергическая, поздно возникшая, с фиксированной обструкцией дыхательных путей, у больных ожирением [1, 11].
По характеру воспаления около 20 лет назад вычленили по меньшей мере 2 фенотипа тяжелой БА: эозинофильная и нейтрофильная [12, 13].
С помощью гистохимического изучения биоптатов слизистой оболочки бронхов у больных рефрактерной стероидзависимой БА показано, что утолщение базальной мембраны наблюдается только при эозинофильном характере воспаления и коррелирует с количеством тканевых эозинофилов. У тех же пациентов в анамнезе чаще отмечалась интубация во время тяжелых обострений БА и регистрировались функциональные признаки вовлечения мелких дыхательных путей.
В более поздних исследованиях была подтверждена зависимость тяжести течения БА от уровня эозинофилии крови (ЭК). Так, например, в британском когортном исследовании, включившем более 130 тыс. больных БА, 16% пациентов исходно имели ЭК >400 клеток/мкл. В течение 1 года наблюдения у них было на 42% выше число тяжелых обострений и на 28% чаще наблюдались обращения к врачу по поводу респираторной патологии, а также отмечалась более низкая частота контроля заболевания. При каждом увеличении содержания эозинофилов на 50 клеток/мкл по сравнению с референтной группой (<200 клеток/мкл) частота обострений нарастала, а отношение шансов для достижения контроля снижалось [14]. В другом современном исследовании ЭК >300 клеток/мкл была выявлена у 130 (26%) из 491 больного БА с дебютом во взрослом возрасте [15]. По сравнению с пациентами с меньшей ЭК у них были хуже контроль астмы и большая частота обострений, несмотря на лечение более высокими дозами ИГКС, они более чем в 2 раза чаще находились на поддерживающей терапии СГКС. У многих из этих больных отмечались низкие показатели функции внешнего дыхания, признаки фиксированной бронхиальной обструкции и «воздушных ловушек», а также повышение содержания оксида азота в выдыхаемом воздухе (FeNO). Кроме того, у них значительно чаще диагностировали назальный полипоз при эндоскопии и изменения в придаточных пазухах носа по данным компьютерной томографии (КТ).
Еще одно крупное исследование с изучением ретроспективной и проспективной когорт больных астмой с ЭК ≥400 клеток/мкл вновь продемонстрировало ассоциацию высоких уровней эозинофилии и FeNO со снижением показателей бронхиальной проходимости, возрастанием гиперреактивности бронхов, увеличением частоты риносинусита (РС) и полипоза носа [16]. В проспективной когорте, наблюдаемой в течение 12 месяцев, были подтверждены различия субгрупп больных БА в зависимости от уровня эозинофилии: при высоких значениях ЭК контроль астмы был хуже, а обострения чаще по сравнению с «неэозинофильной» группой.
Также изучались особенности БА в зависимости от наличия или отсутствия сочетанной эозинофилии крови и мокроты [15,16]. Исследовалась индуцированная мокрота, в которой за пороговый уровень эозинофилии принималось значение 3%. Конкордантность тканевого и системного эозинофильного воспаления с наибольшей частотой обнаруживалась у больных с высокой ЭК, в то же время были выделены подгруппы пациентов с эозинофилией мокроты, не сопровождаемой ЭК. Именно при таком локальном эозинофильном воспалении наблюдаются лучшие результаты лечения ИГКС и, напротив, конкордантное системное и тканевое воспаление плохо отвечает на топические ГКС, особенно в низких/средних дозах. Кроме того, в подгруппах больных БА с сочетанием эозинофилии крови и мокроты концентрируются пациенты с вовлечением в патологический процесс носа, придаточных пазух и мелких дыхательных путей, что позволило авторам сделать заключение, согласно которому такая эозинофильная астма несет черты системного заболевания [15, 16].
Результаты многочисленных исследований эозинофильных болезней, достижения в понимании механизмов их развития, разработка и внедрение таргетных биологических препаратов стали основанием для принятия в 2017 г. консенсуса ERS по тяжелой эозинофильной БА (ТЭБА). Целью этого краткого руководства для лечащих врачей стало определение возможных критериев ТЭБА, в нем содержатся практические указания, кто и как должен вести этих пациентов [17]. В консенсусе подчеркивается, что раннее выявление больных ТЭБА имеет важное значение для полноценного лечения и улучшения прогноза болезни. Однако идентифицировать этих пациентов в повседневной практике не всегда просто, в т.ч. в связи с противоречиями самого определения фенотипа ТЭБА. Этот фенотип был по-разному описан в литературе, но доминировала точка зрения, согласно которой для ТЭБА кроме выраженного эозинофильного воспаления характерно преимущественно позднее начало болезни.
В настоящее время предполагается, что ТЭБА, возникшая во взрослом возрасте и характеризующаяся персистирующим ограничением воздушного потока, дистальным воспалением и воздушными ловушками, а также вовлечением верхних дыхательных путей в виде полипозного РС (ПРС), – это отдельный (самостоятельный) фенотип тяжелой астмы. Его признаки, выявленные в различных исследованиях, далеко не всегда встречаются «в полном наборе» у всех пациентов. В связи с этим в консенсусе ERS предложены диагностические критерии, помогающие в максимальной степени охарактеризовать этот паттерн БА (см. таблицу).
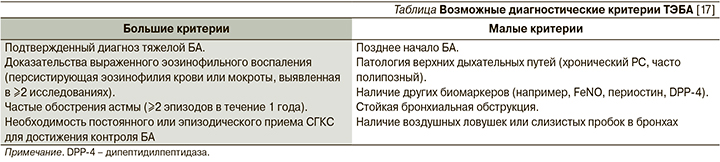
При обсуждении диагностических критериев ТЭБА следует обратить внимание практикующих врачей на то, что тяжелая эозинофильная и тяжелая аллергическая (атопическая) БА – не синонимы, хотя между ними возможен перекрест. Так, в исследовательской программе по изучению тяжелой БА (SARP – Severe Asthma Research Program) атопический вариант астмы был диагностирован не менее чем у 60% больных с тяжелым течением болезни [7]. В этом исследовании был проведен один из первых кластерных анализов, на основании которого было выделено пять кластеров БА. Три кластера представлены аллергической БА с дебютом в детском возрасте, два из которых характеризовались легким или среднетяжелым течением и благоприятными исходами (кластеры 1 и 2), один – тяжелым течением с выраженной, но вариабельной обструкцией бронхов (кластер 4). В 5-м кластере оказалась тяжелая БА с поздним дебютом и фиксированной бронхиальной обструкцией, чаще наблюдавшаяся у женщин. Атопия в этом кластере выявлена у 66% пациентов, что свидетельствует о возможности развития аллергической БА во взрослом возрасте. У многих пациентов с тяжелой атопической астмой в 4-м и 5-м кластерах отмечалась эозинофилия, а также наблюдалась патология придаточных пазух носа в 45 и 53% случаев соответственно. В уже цитировавшемся выше исследовании, касавшемся конкордантности тканевой и системной эозинофилии при тяжелой неконтролируемой БА, среди пациентов с ЭК ≥400 клеток/мкл атопия выявлялась в 65–68% случаев [16]. Таким образом, под «зонтиком» ТЭБА кроме неаллергической может быть и тяжелая атопическая астма. Это связано с многообразной ролью эозинофилов при аллергии, которые не только являются агрессивными эффекторными клетками поздней фазы IgE-опосредованных реакций, но они и активно вовлечены в регуляцию иммунного ответа, связанного с Т-хелперами 2-го типа (Th2), продуцируя иммунорегуляторные цитокины и непосредственно взаимодействуя с Т-лимфоцитами и дендритными клетками. Эозинофилы играют важную роль в формировании персистирующего аллергического воспаления и тканевом повреждении, а также в хронизации болезни, включая механизмы тканевого ремоделирования [18].
И наконец, еще один вариант ТЭБА – это аспирин-индуцированное респираторное заболевание (АИРЗ), наиболее часто включающее триаду признаков: БА, ПРС, гиперчувствительность к аспирину и нестероидным противовоспалительным препаратам. К характерным особенностям АИРЗ относится выраженная эозинофильная инфильтрация верхних и нижних дыхательных путей [19, 20].
Таким образом, не только тяжелая БА в целом, но и ТЭБА является гетерогенным заболеванием, включающим разные фенотипы. В то же время, по современным представлениям, в основе перечисленных вариантов ТЭБА лежит один патофизиологический процесс (эндотип) – Т2-тип воспаления, который характеризуется аномальной продукцией цитокинов не только Th2-лимфоцитами, но и врожденными лимфоидными клетками 2-го типа (ILC2 – innate lymphoid cells type 2). То есть при Т2-типе воспаления в патологический процесс вовлечены как адаптивный, так и врожденный иммунитет, промоторами которого могут быть не только аллергены, но и бактерии, вирусы, ирританты, аэрополлютанты и другие неантигенные субстанции, стимулирующие высвобождение из дыхательного эпителия «алармических» цитокинов: интерлейкинов (ИЛ-33, -25) и тимического стромального лимфопоэтина (TSLP – thymic stromal lymphopoietin), которые активируют ИЛ-C2. Эозинофильное воспаление обусловлено Т2-типом воспаления при различных заболеваниях, таких как неаллергическая ТЭБА, атопическая БА, АИРЗ, ПРС, эозинофильный эзофагит, атопический дерматит и др. [9, 17, 20].
Интерлейкин-5 и возможности воздействия на эозинофильное воспаление
На протяжении длительного времени основными препаратами для подавления воспаления, в т.ч. эозинофильного, при лечении БА были ГКС. Однако, как уже отмечалось, ТЭБА для части больных остается рефрактерной даже при использовании высоких доз ИГКС в сочетании с ДДБА, что диктует необходимость внедрения в клиническую практику новых, основанных на персонализированном подходе методов лечения, учитывающих патотогенетические особенности эндотипа БА [4]. Одно из таких направлений – использование таргетной (целевой) терапии на 5-й ступени ТЭБА с применением анти-ИЛ-5-препаратов. Предпосылкой к разработке лекарств этой группы стало следующее обстоятельство: именно ИЛ-5, избыточно продуцируемый при ТЭБА, играет ключевую роль при эозинофильном воспалении: активирует созревание, дифференцировку и пролиферацию эозинофилов, их миграцию в респираторный тракт, а также способствует выживанию зрелых клеток и стимулирует их цитотоксичность [9]. Действие ИЛ-5 реализуется через α-субъединицу специфичного рецептора (ИЛ-5-Rα), экспрессируемого на эозинофилах и в меньшей степени базофилах [21].
В России к настоящему времени зарегистрировано два препарата таргетной терапии, связывающих ИЛ-5 и таким образом влияющих на регулирование количества эозинофилов в периферической крови и легочной ткани: моноклональные антитела к ИЛ-5 – меполизумаб и реслизумаб [22].
Меполизумаб – это гуманизированное моноклональное IgG1-антитело, которое с высокой специфичностью связывается с ИЛ-5, тем самым предотвращая его соединение с α-цепью рецептора ИЛ-5-Rα на эозинофилах и базофилах, и снижает количество эозинофилов как в мокроте, так и в крови. Высокоселективный характер связывания меполизумаба с ИЛ-5 (в наномолярных дозах) не влияет на биологическую активность других цитокинов, чем объясняется в целом низкая частота его системных побочных эффектов [21].
Меполизумаб при лечении ТЭБА: эффективность и безопасность
В 2009 г. были опубликованы результаты двух рандомизированных контролируемых исследований (РКИ) в небольших группах больных тяжелой БА, характеризующейся рецидивирующими обострениями и эозинофильным воспалением, резистентным к ИГКС и СГКС [23, 24]. В обоих РКИ было показано, что меполизумаб эффективно уменьшает частоту обострений астмы и уровень эозинофилов как в крови, так и в индуцированной мокроте при ежемесячном внутривенном введении в дозе 750 мг, а у больных стероидзависимой БА препарат значительно снижает потребность в преднизолоне после применения в течение 4 месяцев [24]. В более длительном из этих исследований, продолжавшемся в течение 1 года, была получена дополнительная важная информация [23]. КТ, проведенная до и после 12 ежемесячных внутривенных инфузий меполизумаба, показала значительное уменьшение толщины и общей площади стенок дыхательных путей по сравнению с плацебо. Полученные результаты свидетельствуют о возможном тормозящем действии меполизумаба на ремоделирование бронхов, что особенно актуально при тяжелой БА. Эти данные корреспондируют с предыдущими наблюдениями о способности меполизумаба уменьшать отложение белков внеклеточного матрикса в ретикулярной базальной мембране слизистой оболочки бронхов, а также снижать уровень трансформирующего фактора роста-β1 (ТФР-β1) в жидкости бронхоальвеолярного лаважа [21]. Таким образом, потенциальный антиремоделирующий эффект меполизумаба, весьма вероятно, связан с его угнетающим действием на эозинофилы, которые служат клеточными источниками ТФР-β1, одного из наиболее важных факторов роста, способствующего структурным изменениям дыхательных путей при астме [18].
Первоначальные данные о положительном эффекте меполизумаба для больных ТЭБА позднее были подтверждены в крупном многоцентровом РКИ DREAM [25]. Более чем 600 пациентов с ТЭБА, характеризующейся частыми тяжелыми обострениями, были распределены в 4 группы, получившие с 4-недельными интервалами 13 внутривенных инфузий плацебо или 1 из 3 доз меполизумаба (75, 250 или 750 мг). При всех используемых дозах меполизумаб эффективно снижал уровень эозинофилов в крови и мокроте, а также частоту обострений БА на 39–52% независимо от уровня IgE и атопического статуса.
В 2014 г. опубликованы результаты двух других РКИ (MENSA и SIRIUS) по оценке эффективности меполизумаба для пациентов с ТЭБА, которые в предыдущем году перенесли более двух обострений, требовавших лечения СГКС, несмотря на использование высоких доз ИГКС в комбинации с дополнительными противоастматическими препаратами [26, 27]. В крупном исследовании MENSA, включившем 576 человек, пациенты получали плацебо или меполизумаб в дозе 75 мг внутривенно или 100 мг подкожно каждые 4 недели на протяжении 32 недель. Обе дозы меполизумаба вызывали достоверное уменьшение числа обострений астмы на 47 и 53% соответственно, а также значительное улучшение качества жизни и контроля БА [26].
В последующем («post hoc») анализе результатов исследования MENSA изучалось возможное влияние на эффективность меполизумаба объема или вида базисной терапии, получаемой пациентами [28]. Оценивалась среднегодовая частота клинически значимых обострений у пациентов, получавших меполизумаб или плацебо, на фоне разного количества препаратов (ИГКС + 1, 2 или ≥3 контролирующих средств) и их типа (ИГКС, ДДБА, тиотропий, антагонисты лейкотриеновых рецепторов, ксантины, недокромил/кромолин натрия). Уменьшение частоты обострений при применении меполизумаба по сравнению с плацебо было выявлено во всех группах, но наибольшее снижение отмечено в подгруппе максимальной базисной терапии (ИГКС + ≥3 других препаратов, включая тиотропий), в которой больные, вероятно, имели наибольшее бремя заболевания. Эти данные свидетельствуют, что меполизумаб может быть эффективным вариантом терапии даже для самых трудных для лечения пациентов с ТЭБА.
В исследовании SIRIUS с участием 135 больных оценивали возможность снижения дозы СГКС у стероидзависимых больных на фоне лечения меполизумабом подкожно в дозе 100 мг 1 раз в 4 недели в течение 20 недель. Меполизумаб оказывал стероид-спарринг-эффект, приводя к редукции дозы преднизолона на 50% по сравнению с плацебо [27]. Несмотря на снижение поддерживающей дозы СГКС, частота обострений БА уменьшалась, а контроль астмы и качество жизни пациентов улучшались. Кроме того, в обоих исследованиях зафиксировано умеренное возрастание объема форсированного выдоха за первую секунду (ОФВ1).
Продолжением исследований MENSA и SIRIUS было открытое 52-недельное исследование COSMOS, целью которого стала оценка долговременной эффективности и безопасности меполизумаба для 651 пациента [29]. Было показано, что клинический эффект, достигнутый в закрытой фазе, включая значительное снижение ежегодной частоты обострений БА и ежедневной дозы СГКС, при продолжении лечения сохраняется.
Важным аспектом применения таргетных иммунобиологических препаратов является их безопасность. В исследованиях DREAM, MENSA, SIRIUS [25–27] отмечен благоприятный профиль безопасности меполизумаба, сопоставимый с таковым плацебо, за исключением небольшого увеличения частоты развития местных реакций при подкожном введении. Не было сообщений об анафилаксии, что в дальнейшем было подтверждено в открытом исследовании COSMOS, в котором 651 пациенту сделано по 13 инъекций препарата [27]. Во всех этих РКИ положительные результаты на наличие антител к меполизумабу встречались нечасто, их титры были, как правило, низкими и со временем уменьшались. Случаев выявления нейтрализующих антител не зарегистрировано.
Авторы Кокрановского обзора, выполненного в 2017 г. и посвященного анализу клинических исследований препаратов, связывающих ИЛ-5 (меполизумаб, реслизумаб), и блокатора рецепторов ИЛ-5 (бенрализумаб) в лечении БА [30], отметили, что они не увеличивают совокупной частоты серьезных нежелательных явлений по сравнению с плацебо. Обобщенный анализ исследований меполизумаба показал даже снижение их частоты за счет серьезных нежелательных явлений, связанных с обострениями БА.
Важным этапом изучения эффективности и безопасности меполизумаба было проведение длительного открытого исследования COLUMBA [31], в которое включались пациенты, участвовавшие в исследовании DREAM [25]. Наблюдение за больными ТЭБА, получавшими на фоне стандартной базисной терапии каждые 4 недели подкожно 100 мг меполизумаба, продолжалось до 4,5 лет; общее время терапии составило 1201 пациенто-год. Исследование подтвердило эффективность меполизумаба в отношении снижения частоты обострений и улучшения контроля заболевания. За период наблюдения среднее количество обострений БА в пересчете на 1 год составило 0,68 на каждого участника, а их общая частота снизилась на 61%, 33% больных не перенесли ни одного обострения за все время исследования. В отдельных подгруппах пациентов, стратифицированных на основе количества эозинофилов крови до лечения (>150 клеток/мкл, >300, >400, >500 клеток/мкл), частота обострений на фоне терапии меполизумабом оказалась одинаковой. Не было отмечено различий и при сравнении больных с ранним (<30 лет) и поздним (>30 лет) началом БА, у которых было зарегистрировано 0,69 и 0,67 обострения в год соответственно. Следует подчеркнуть, что авторы наблюдали несколько более высокую частоту обострений у пациентов с сопутствующим хроническим РС (1,04 против 0,69 обострения в год у больных без РС). В процессе лечения содержание эозинофилов в крови уменьшилось на 78% к 4-й неделе (в среднем с 240 до 50 клеток/мкл) и оставалось таким же в течение всего периода мониторинга.
В исследовании COLUMBA были также отмечены благоприятный профиль безопасности и низкая иммуногенность препарата, кроме того, не обнаружено формирования толерантности к меполизумабу. Количество злокачественных новообразований, диагностированных во время терапии, не превышало стандартных показателей для лиц соответствующего пола и возраста в США, по данным регистра онкологических заболеваний.
Таким образом, результаты клинических исследований меполизумаба при ТЭБА ответили на многие поставленные вопросы: показано достоверное снижение частоты обострений, улучшение контроля БА, качества жизни и функции легких, а также продемонстрирована возможность снижения дозы или полной отмены СГКС без потери контроля БА и высокая безопасность препарата. Важным итогом многолетней работы было определение оптимальной дозы, кратности и пути введения меполизумаба, в т.ч. на основании выводов многоцентрового РКИ MUSCA, проведенного в 146 клиниках 19 стран [32]. В настоящее время для лечения ТЭБА рекомендованы подкожные инъекции меполизумаба 1 раз в 4 недели в дозе 100 мг независимо от массы тела пациента. В РФ меполизумаб одобрен к применению с 18 лет, в США и большинстве стран ЕС – с 12 лет [4, 6, 10, 22].
Определение биомаркеров для прогноза эффективности терапии меполизумабом
Поиск биомаркеров, позволяющих прогнозировать эффективную таргетную терапию больных ТЭБА с целью персонального отбора пациентов для лечения меполизумабом, стал еще одним важным аспектом проведенных исследований. Известно, что количество эозинофилов в крови представляет собой устойчивую величину между регулируемым ИЛ-5 высвобождением эозинофилов из костного мозга и депонированием клеток в тканях, а эозинофильный фенотип БА характеризуется повышенным накоплением эозинофилов в дыхательных путях [10, 15, 17]. Показано, что уровень ЭК >400 клеток/мкл хорошо коррелирует с содержанием эозинофилов в индуцированной мокроте >3% (т.е. с той величиной, которая соответствует эозинофильному воспалению дыхательных путей), а минимальным порогом чувствительности для выявления эозинофилии мокроты является ЭК, составляющая 220 клеток/мкл [16].
В результате изучения эффективности меполизумаба установлено, что из массы потенциальных демографических и клинических предикторов влияния анти-ИЛ-5-терапии на течение БА самым значимым и надежным показателем служит количество эозинофилов в периферической крови, отражающее повышенную активность ИЛ-5. Более того, было продемонстрировано, что эффект таргетной терапии зависит от уровня ЭК в значительно большей степени, чем от эозинофилии мокроты [10, 33].
Ретроспективный анализ данных 1192 пациентов, участвовавших в исследованиях DREAM и MENSA, позволил рассчитать пороговое значение ЭК, необходимое для оценки прогноза эффективности меполизумаба по снижению частоты обострений БА. Таким параметром оказался уровень эозинофилов в периферической крови, составивший ≥150 клеток/мкл [33]. Однако авторы отмечают, что данный уровень эозинофилии попадает в диапазон нормальных значений, поэтому не может быть использован для всей гетерогенной популяции больных БА, а может применяться только для хорошо очерченной подгруппы пациентов. Исходя из этого, предложено рассматривать два пороговых значения, которые могут быть использованы в разных субгруппах больных: 1) более высокий уровень эозинофилов крови (>300 клеток/мкл) для выявления потенциальных «ответчиков» на лечение меполизумабом в общей популяции больных ТЭБА и 2) более низкий порог (>150 клеток/мкл) для оценки возможности терапии меполизумабом в когортах больных с ранее выявленной эозинофильной БА, в т.ч. среди пациентов, регулярно получавших СГКС, в связи с чем у них возможно снижение ЭК. Тем не менее невысокий уровень эозинофилии в таких случаях может быть достаточно чувствительным предиктором положительного ответа больных ТЭБА на меполизумаб [10, 33].
Проблемы выбора таргетной терапии для больных тяжелой бронхиальной астмой
Как уже отмечалось, ТЭБА является гетерогенной болезнью, объединяющей разные клинические варианты астмы, в основе которых лежит Т2-тип воспаления. Несмотря на распространенное представление о том, что тяжелая аллергическая и тяжелая эозинофильная БА – это разные фенотипы заболевания [17], в ряде работ регистрируется перекрест между ними [7, 15, 16, 34]. Иными словами, ТЭБА по своему патогенезу может быть как аллергической (IgE-зависимой), так и неаллергической. Проблема перекреста и, соответственно, попытки разграничения эозинофильной неаллергической и эозинофильной аллергической (атопической) БА становятся актуальными в связи с все более широким внедрением таргетной терапии, направленной на разные мишени астматического Т-зависимого воспаления.
И если лечение астмы ГКС является, по образному выражению K.F. Chung, «одним размером для всех», то иммунобиологическая терапия должна быть персонализированной, проводимой «правильному пациенту правильным лекарством в правильное время» [9].
В одном из недавних исследований перекреста фенотипов БА у больных в разных возрастных группах астма определялась как эозинофильная при трех пороговых значениях эозинофилов крови: ≥150, ≥300 или ≥400 клеток/мкл, а диагноз атопической БА подтверждался при обнаружении аллерген-специфических IgE ≥0,35 МЕ/мл для любого из девяти распространенных круглогодичных аллергенов [35]. В зависимости от применяемой градации уровня эозинофилов 31–78% больных детей и 21–69% взрослых были классифицированы как страдающие эозинофильной БА. При этом 68% пациентов имели признаки и того, и другого фенотипа при использовании порогового значения ЭК >150 клеток/мкл.
При изучении клинических особенностей поздно возникшей эозинофильной БА показано, что у трети больных с уровнем ЭК ≥300 клеток/мкл выявляется сенсибилизация к основным ингаляционным аллергенам [15]. В то же время у большинства пациентов с эозинофильной поздно возникшей астмой без признаков атопии определялся значительно повышенный уровень общего IgE, что может указывать, по мнению авторов, не только на сенсибилизирующее действие поллютантов, но и на активацию Th2-иммунного ответа суперантигенами Staphylococcus aureus. В последние годы появились доказательства значительной роли антигенов золотистого стафилококка в патогенезе ПРС, а также неатопической БА [36, 37].
С этими представлениями согласуются результаты исследований, в которых показано, что у пациентов с поздно возникшей эозинофильной БА и высоким уровнем IgE в 2 раза чаще отмечался полипоз носа и в 6 раз чаще регистрировались изменения на КТ придаточных пазух [15].
Касаясь вопроса перекреста фенотипов при ТЭБА, следует привести данные еще одного, уже процитированного исследования DREAM [25], в которое были включены более 600 пациентов с ТЭБА, в половине случаев характеризовавшейся атопическим вариантом. В контексте фенотипических особенностей ТЭБА необходимо подчеркнуть, что меполизумаб эффективно снижал уровень эозинофилов в крови и мокроте, а также частоту обострений астмы независимо от уровня IgE и атопического статуса. Иначе говоря, больные как с тяжелой неаллергической, так и с тяжелой аллергической (IgE-опосредованной) БА, но сопровождавшейся при этом в обоих случаях признаками эозинофильного воспаления, могут успешно лечиться меполизумабом.
Этот факт представляется весьма важным для клинической практики, т.к. анти-IgE-терапия, несмотря на высокую эффективность омализумаба во многих случаях тяжелой атопической БА (снижение эозинофилии, уменьшение частоты обострений и другие благоприятные эффекты), имеет ряд ограничений. На сегодняшний день препарат одобрен только для больных тяжелой аллергической БА с доказанной сенсибилизацией хотя бы к одному круглогодичному ингаляционному аллергену. Кроме того, применение омализумаба лимитируется уровнем общего IgE >1500 МЕ и высокой массой тела пациента. И наконец, далеко не все пациенты, полностью соответствующие всем этим требованиям, отвечают на терапию омализумабом [5, 17].
Прямых сравнительных исследований меполизумаба и омализумаба при лечении тяжелой эозинофильной аллергической астмы не проводилось. Что касается непрямого сравнения их терапевтических эффектов на популяции с перекрестом фенотипов у больных тяжелой БА, которые могут получать оба вида лечения, то недавно представленные систематический обзор литературы, а также мета-анализ РКИ и когортных исследований, показали, что меполизумаб по меньшей мере так же эффективен, как и омализумаб, в предотвращении обострений астмы и улучшении функции легких, а профили безопасности обоих препаратов не имели существенных различий [38, 39].
В связи с расширением спектра иммунобиологических лекарств для применения в клинической практике и появлением кроме давно используемого омализумаба (связывающего свободный IgE), новых препаратов, нейтрализующих ИЛ-5 (меполизумаб и реслизумаб), было выполнено исследование для определения популяций больных тяжелой БА, подходивших для лечения тем или иным видом таргетной терапии [34]. Это первое в своем роде проспективное обсервационное исследование в реальной практике было проведено с учетом клинических фенотипов БА с целью выявления доли пациентов, которым подходит лечение исключительно омализумабом, или меполизумабом, или реслизумабом, или препаратами более чем одной группы (перекрестная популяция). Исследование проводилось в шести странах (Австралия, Великобритания, Германия, Канада, США, Франция) в соответствии со стандартизированным набором критериев для лечения этими препаратами. В результате из 502 больных тяжелой неконтролируемой аллергической и/или эозинофильной БА старше 12 лет, ранее не получавших биологических препаратов, 20% пациентов подходило лечение меполизумабом, а приемлемость терапии омализумабом варьировалась в соответствии с национальными рекомендациями от 7 до 21%. Небольшую (6%) долю составили больные тяжелой БА, для которых оказалось пригодным лечение реслизумабом; значительные ограничения пула больных были связаны с уровнем ЭК ≥400 клеток/мкл (критерий включения больных в исследования III фазы для этого препарата), на который опирались авторы данного проспективного наблюдения [34].
Что касается перекреста популяций, то из числа больных, подходивших для терапии меполизумабом, для третьей части было приемлемо лечение омализумабом. Среди пациентов, которым было показано лечение омализумабом, совпадение с целесообразностью применения меполизумаба колебалось от 35 до 73% в зависимости от национальных рекомендаций. Напротив, частота совпадений к назначению омализумаба и реслизумаба оказалась ожидаемо низкой (11–14%), что было в основном обусловлено количеством эозинофилов для назначения реслизумаба ≥400 клеток/мкл. Перекрест между показаниями к меполизумабу и реслизумабу наблюдался в 18%, несмотря на то что оба препарата являются анти-ИЛ-5-антителами. Это вновь было связано с различными пороговыми уровнями эозинофилов, применяемыми в качестве критериев приемлемости данных препаратов для больных ТЭБА.
Таким образом, группы пациентов, нуждающихся в лечении анти-ИЛ-5- или анти-IgE-препаратами, часто различны, что связано с фенотипической гетерогенностью ТЭБА и может стать причиной неудачи таргетной терапии. Исследование стало одним из шагов к вниманию принципов отбора больных для лечения моноклональными антителами и принятия клинических решений в реальной практике.
Что касается практических аспектов иммунобиологической терапии ТЭБА, то в международных и национальных рекомендациях [4–6] подчеркивается необходимость дифференцированного подхода к выбору терапии в зависимости от фенотипических особенностей тяжелой астмы. Диагностика атопической (IgE-зависимой), в т.ч. эозинофильной, астмы служит основанием для анти-IgE-терапии омализумабом. При наличии противопоказаний или недостаточной эффективности омализумаба, оцениваемой не ранее 16 недель, целесообразно назначение анти-ИЛ-5-терапии. При неаллергической ТЭБА целесообразна первоначальная таргетная анти-ИЛ-5-терапия меполизумабом при количестве эозинофилов в периферической крови ≥150 клеток/мкл на момент начала терапии или ≥300 клеток/мкл, зарегистрированных в течение предыдущих 12 месяцев. Лечение реслизумабом рекомендуется при ЭК ≥400 клеток/мкл, а бенрализумаб (моноклональные антитела против рецептора ИЛ-5) может применяться при ЭК ≥300 клеток/мкл [6].
При рассмотрении возможности назначения иммунобиологических препаратов больным ТЭБА необходимо исключить паразитарные инфекции, которые могут быть причиной ЭК. Пациентов с нелеченым паразитозом таргетная терапия потенциально может приводить к распространению инфекции. Следует также проводить дифференциальный диагноз с аллергическим бронхолегочным аспергиллезом и эозинофильным гранулематозом с полиангиитом, т.к. ТЭБА может быть одним из проявлений этих заболеваний [4].
Меполизумаб в лечении полипозного риносинусита
Среди широкого круга коморбидных с БА заболеваний патология верхних дыхательных путей занимает ведущее место, а ПРС часто ассоциирован с наиболее тяжелой астмой, в т.ч. с ТЭБА [15, 17, 40]. Кластерный анализ, проведенный в исследовании SARP [7], показал, что около половины больных тяжелой астмой были прооперированы в связи с хроническим РС, включая ПРС. В настоящее время при хроническом РС, так же как и при БА, выделяют различные фенотипы на основании тяжести и продолжительности симптомов, уровня контроля, атопического статуса, коморбидности, наличия или отсутствия полипов, клеточного характера воспаления [41].
В последние годы накапливаются данные о том, что у людей белой расы в 80–90% случаев ПРС ассоциирован с Т2-типом воспаления, характеризующимся участием эозинофилов и тучных клеток, повышением уровня IgE и ряда интерлейкинов, включая ИЛ-4, -5, -9 и ИЛ-13. Общностью этиопатогенетических механизмов, в т.ч. Т2-типом воспаления, объясняется тесная взаимосвязь ТЭБА с ПРС [40–42]. Поэтому неудивительно, что эндотип-ориентированная иммуннобиологическая терапия хронического РС рассматривается сейчас в качестве одного из перспективных направлений, особенно для больных неконтролируемым тяжелым течением болезни и частыми рецидивами назального полипоза [43].
Поскольку при ПРС преобладает Т2-тип воспаления и важную роль в его развитии играет ИЛ-5, вполне очевиден интерес к анти-ИЛ-5-терапии при эозинофильном фенотипе ПРС. В 2011 г. опубликованы результаты первого РКИ, свидетельствующие о положительном эффекте меполизумаба при тяжелом рецидивирующем назальном полипозе, рефрактерном к ГКС-терапии 30 больных [42]. Это исследование было коротким по продолжительности с проведением только 2 внутривенных инфузий меполизумаба в дозе 750 мг с интервалом 4 недели. Однако, несмотря на малое число инъекций, достоверно уменьшились размеры полипов, по данным КТ и эндоскопии, снизились ЭК и содержание сывороточных маркеров активности эозинофилов и ИЛ-5. Одной из важных целей работы была оценка безопасности препарата, что в итоге и было продемонстрировано.
В более позднем РКИ, в котором участвовали 105 пациентов с тяжелым рецидивирующим, терапевтически резистентным полипозом носа, выполнялись 6 внутривенных вливаний меполизумаба в дозе 750 мг каждые 4 недели. В результате значительно большая доля больных группы меполизумаба по сравнению с плацебо не нуждались в хирургическом вмешательстве на 25-й неделе: 16 (30%) против 5 (10%) соответственно (р=0,006). У больных, получавших меполизумаб, наблюдалось достоверное улучшение объективных эндоскопических параметров, а также показателей, оцениваемых пациентами, включая данные специализированного опросника SNOT-22 (Sino-nasal Outcome Test – Синоназальный тест оценки результатов) и визуально-аналоговых шкал. Профиль безопасности меполизумаба был сопоставимым с таковым для плацебо [44].
В 2018 г. опубликованы данные небольшого открытого ретроспективного исследования эффективности меполизумаба для пациентов с АИРЗ (подтвержденного провокационным тестом с аспирином) в реальной клинической практике в Бостоне (США) [45]. Результаты были проанализированы у 14 человек после не менее чем 3 подкожных инъекций меполизумаба в дозе 100 мг с интервалами 4 недели, который назначался в связи с ТЭБА. Исходное содержание эозинофилов крови составляло у пациентов в среднем 842/мкл, также наблюдался назальный полипоз, в анамнезе отмечалось в среднем около 3 полипэктомий на протяжении жизни с медианой времени до рецидива полипоза 3 месяца, несмотря на терапию ГКС и десенситизацию аспирином. Половина больных до назначения меполизумаба ежедневно принимали СГКС.
В динамике оценивались количество эозинофилов в крови, ОФВ1, данные вопросников SNOT-22 и ACT (Asthma control test – тест по контролю астмы). После 3–11 доз меполизумаба значительно уменьшилось содержание эозинофилов в крови, а также снизилась оценка по шкале SNOT-22, свидетельствуя об улучшении синоназальных симптомов, в т.ч. таких, как аносмия и блокада носа. Лечение меполизумабом привело к достоверному улучшению контроля астмы, по данным АСТ, и была отмечена тенденция к увеличению ОФВ1 (исходно 62,9±6,3%, после меполизумаба – 68,3±5,5%; р=0,16). За время исследования ни одному из пациентов не потребовалась операция на пазухах, в течение этого периода не отмечено увеличения дозы или начала приема СГКС, а 5 из 7 больных смогли снизить суточную дозу СГКС.
Кроме результатов вышеприведенных исследований заслуживают внимания недавно опубликованные отдельные клинические наблюдения, в которых оценивалась эффективность терапии меполизумабом ТЭБА и коморбидного тяжелого ПРС [46, 47]. Речь идет о 62-летней женщине и 51-летнем мужчине, страдавших на протяжении длительного времени аллергической ТЭБА, имевшей неконтролируемое течение на фоне лечения высокими дозами ИГКС в комбинации с ДДБА, тиотропием и пероральным преднизолоном по 5–10 мг/сут. Кроме того, второй пациент на протяжении года безуспешно получал анти-IgE-терапию омализумабом. В обоих случаях ТЭБА сочеталась с хроническим ПРС, рефрактерным к проводимой терапии, включая СГКС. В первом наблюдении эффективность меполизумаба оценивалась через 4 месяца лечения, во втором – через 8 месяцев (по 100 мг подкожно 1 раз в 4 недели). У обоих больных за указанный период наблюдения на фоне снижения ЭК отмечалось увеличение показателей контроля БА и функции внешнего дыхания, выраженность симптомов ПРС также существенно снизилась, что сопровождалось полным восстановлением обоняния.
У одного из больных в процессе 8-месячной терапии преднизолон постепенно был полностью отменен, при этом за время наблюдения обострения астмы или ПРС отсутствовали [47]. Во время лечения меполизумабом каких-либо нежелательных реакций отмечено не было, хотя авторы подчеркивают, что необходим более длительный срок мониторинга.
Заключение
Завершая обзор, следует еще раз подчеркнуть сложность лечения больных с тяжелым неконтролируемым течением астмы, при которой около половины случаев приходится на эозинофильный фенотип заболевания. Современные представления о патогенезе ТЭБА основаны на ведущей роли эозинофильного (Т2-типа) воспаления, с которым ассоциированы основные патофизиологические и клинические эффекты: рецидивирующее течение с тяжелыми обострениями, выраженная бронхиальная обструкция, ремоделирование дыхательных путей, часто встречающийся коморбидный ПРС.
Известно, что центральная роль в регуляции и повышенной активации эозинофилов осуществляется Т2 «специфическим» спектром цитокинов, среди которых одним из ведущих считается ИЛ-5. Этим обстоятельством обусловлено внедрение в клиническую практику при ТЭБА таргетной анти-ИЛ-5-терапии. Как показывают результаты исследований, анализируемых в данном обзоре, применение меполизумаба больными ТЭБА уменьшает уровень эозинофилии, снижает частоту обострений, улучшает контроль заболевания и функции легких, повышает качество их жизни. Достоинством терапии меполизумабом является возможность достижения положительных клинических эффектов на фоне снижения дозы СГКС и даже их полной отмены. Наконец, отметим клиническую эффективность меполизумаба при ПРС – коморбидной патологии, отягощающей течение астмы и часто обусловливающей назначение СГКС.
С учетом высокой эффективности и безопасности меполизумаба имеются все основания рекомендовать его для более широкого применения больными ТЭБА.


