Введение
Преждевременные роды (ПР) – ведущая причина перинатальной заболеваемости и смертности в мире [1]. Ежегодно в мире рождаются около 15 млн недоношенных детей, что составляет около 10% от всех новорожденных, и этот показатель не имеет тенденции к снижению [2]. При этом 50–70% перинатальной смертности и около 50% всех случаев неврологической заболеваемости детей в возрасте младше 5 лет связаны с осложнениями, обусловленными недоношенностью [3].
В связи со столь высокой социальной и экономической значимостью проблемы точное прогнозирование могло бы обеспечить надлежащие (или предотвратить ненужные) госпитализации или переводы в стационары III уровня.
На сегодняшний день наиболее значимым и эффективным скрининговым мероприятием в отношении риска развития спонтанных ПР, в т.ч. многоплодных, является трансвагинальная ультразвуковая (УЗ) цервикометрия [4]. Однако данный метод обладает характерной для скрининга достаточно низкой специфичностью – 48–68% [5, 6]. Поэтому для уточнения прогноза ПР целесообразно использовать диагностические тест-системы, основанные на определении различных биохимических маркеров в цервико-вагинальном секрете в сочетании с оценкой длины шейки матки (ДШМ) [7]. В настоящее время в мире разработаны и используются экспресс-тесты, основанные на выявлении в цервико-вагинальном секрете трех белков-маркеров: фетального фибронектина, фосфорилированного протеина, связывающего инсулиноподобный фактор роста (ФПСИФР), и плацентарного α1-микроглобулина (ПАМГ-1). На территории Российской Федерации зарегистрирован только один тест – Актим Партус® производства Медикс Биохимика, Финляндия, основанный на определении ФПСИФР. Ряд исследователей рекомендуют его в качестве экспресс-теста при высоком риске ПР [8, 9]. Однако, по данным мета-анализа, включившего 43 исследования и 10 203 пациентки, общая прогностическая способность теста ограничена [10].
Что же касается фибронектина, то мета-анализ (6 рандомизированных клинических исследований и 546 женщин) показал, что тестирование его не связано с профилактикой ПР или улучшением перинатальных исходов [11], к тому же, по данным М. Bruijn et al., тест ФПСИФР превосходит фибронектин по специфичности [12].
Тест ПАМГ-1 обладает более высокой прогностической эффективностью по сравнению с ФПСИФР [13, 14] и фибронектином [15, 16], однако, согласно данным J. Varley-Campbell et al., доказательная база его эффективности недостаточна и необходимы дальнейшие более крупные исследования [17].
Цель исследования: сравнить точность прогнозирования тестов, основанных на определении ПАМГ-1 и ФПСИФР-1 у женщин, которые обращаются с признаками и симптомами ПР, для прогноза времени их наступления.
Методы
Нами на базе ГБУЗ ГКБ № 1 им. Н.И. Пирогова, филиал «Родильный дом № 25», с декабря 2015 по июнь 2017 г. проведено сравнительное проспективное наблюдательное исследование, в которое на 1-м этапе вошли 70 женщин со сроком беременности от 20/0 до 36/6 недель, самостоятельно обратившихся с признаками, симптомами или жалобами, при которых можно предположить угрожающие ПР (болезненные и безболезненные сокращения матки, схваткообразные боли внизу живота, тупая боль в пояснице, напряжение в малом тазу и т. п.), подписавшие добровольное информированное согласие на участие в исследовании.
Критерии исключения:
- прием токолитических препаратов до взятия образца цервико-вагинального содержимого или до измерения ДШМ;
- раскрытие маточного зева ≥3 см или длина сокращенной части цервикального канала ≥3 см при трансвагинальной УЗ-цервикометрии;
- предлежание плаценты;
- срок беременности <20/0 или ≥37 недель;
- явный разрыв плодных оболочек, определяемый видимым на глаз истечением жидкости из цервикального канала;
- шов на шейке матки;
- симптомы, не связанные с идиопатическими ПР (например, возникшие после травмы);
- бимануальное исследование, произведенное до взятия образца цервико-вагинального содержимого;
- возраст менее 18 лет и недееспособные;
- женщины, участвующие в исследовании токолитических препаратов;
- все пациентки, к которым была применена индукция родов или произведено кесарево сечение до начала активной родовой деятельности, а именно до начала регулярных схваток каждые 10 минут продолжительностью не менее 40 секунд или раскрытия маточного зева ≥3 см.
Процедура исследования
Женщинам, соответствующим критериям включения, на 1-м этапе проведен забор влагалищного содержимого для определения ПАМГ-1 с помощью теста Партошур (AmniSure® International, LLC, Boston, MA) и цервикального секрета для определения ФПСИФР-1 с помощью теста Актим Партус (Медикс Биохимика, Финляндия) в соответствии с рекомендациями производителей и оценки тестов.
На 2-м этапе проведен клинический осмотр пациентки, УЗИ (в т.ч. трансвагинальная цервикометрия) для выявления наличия критериев исключения. При этом специалист, оценивавший результаты тестов, не имел информации, полученной на 2-м этапе, а специалисты, участвовавшие во 2-м этапе, и пациентка не знали результатов тестов.
Дальнейшие диагностические и лечебные мероприятия проведены в соответствии с клиническим протоколом МЗ РФ от 17.12.2013 № 15-4\10\2-9480 «Преждевременные роды» и не зависели от результатов тестов.
На 3-м этапе проведена оценка времени до наступления родов.
Исследование одобрено локальным Этическим комитетом.
Статистическая обработка полученных результатов проведена с помощью прикладного пакета IBM SPSS Statistics 20. Определены следующие параметры: чувствительность, специфичность, положительное прогностическое значение, отрицательное прогностическое значение для тест-систем на ПАМГ-1 и ПСИФР-1, ДШМ при трансвагинальном УЗИ (<30 мм), и осуществлена оценка времени наступления родов на основе определения вышеперечисленных параметров в течение ≤7, ≤14 дней, а также взаимосвязь между результатами вышеперечисленных исследований и родами <37 недель беременности. Для расчета различий показателей чувствительности и специфичности использовали хи-квадрат по методу МакНемара, доверительный интервал рассчитывали по методу Клоппера–Пирсона.
Результаты исследования
Первоначально в исследование вошли 70 пациенток. На 2-м этапе из исследования были исключены 20 женщин (у 19 ДШМ >30 мм, у 1 диагностирован преждевременный разрыв плодных оболочек). На заключительном этапе из исследования была исключена 1 пациентка, родоразрешенная оперативным путем до начала регулярных схваток. Таким образом, в окончательный анализ были включены 49 женщин.
Диапазон возраста пациенток составил от 19 до 40 лет, в среднем – 29,8±4,8 года. Срок беременности исследуемых на момент поступления в стационар составил от 20,5 до 36 недель, в среднем – 29,4±4,1 недели. ДШМ, измеренная при трансвагинальном УЗИ, колебалась от 3 до 29 мм, в среднем – 17,7±3,6 мм. Токолитическая терапия проведена 47 (95,9%) женщинам, кортикостероидную терапию с целью профилактики респираторного дистресс-синдрома (РДС) новорожденного получили 44 (89,8%) пациентки. Акушерский пессарий с целью коррекции истмико-цервикальной недостаточности был установлен 2 (4,1%) женщинам. У 4 (8,2%) пациенток роды произошли в течение 7 дней с момента поступления в стационар, еще 2 (4,1%) родили в течение последующих 7 дней, у 1 (2,0%) произошел поздний самопроизвольный выкидыш на сроке 21,5 недели (родился мертвый плод массой 440 г). Данные представлены в табл. 1.
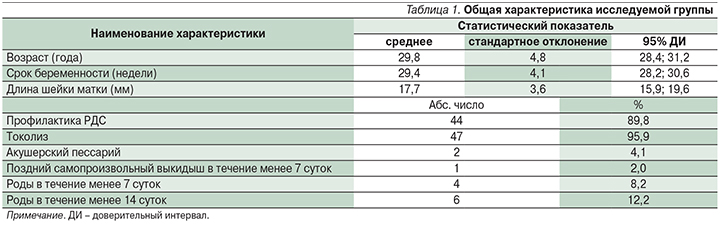
Таким образом, у 7 (14,3%) женщин беременность завершилась досрочно в течение 14 дней с момента поступления в стационар. В этой группе была 1 перинатальная потеря (сверхранние ПР на сроке 23,5 недели – мальчик с весом при рождении 555 г умер на 3-е сутки жизни).
Тест ФПСИФР был положительным у 10 (20,4%) женщин, тест ПАМГ-1 – у 4 (8,2%). Согласно цели исследования, нами проведена сравнительная оценка диагностической эффективности двух тестов. Полученные результаты представлены в табл. 2.
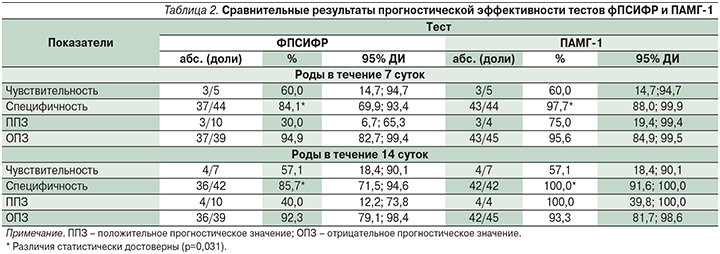
Тесты ПАМГ-1 и ФПСИФР для прогноза спонтанных ПР в течение <7 дней продемонстрировали следующие результаты: чувствительность – 60 и 60% соответственно (p=1,0), специфичность – 97,7 и 84,1% соответственно (р=0,031), положительное прогностическое значение – 75 и 30% соответственно, отрицательное прогностическое значение – 95,6 и 94,9% соответственно.
Подобные результаты были получены и при оценке в группе, где роды прошли в течение <14 дней с момента поступления. Тест ПАМГ-1 по сравнению с таковым фПСИФР обладал достоверно большей специфичностью: 100 и 85,7% соответственно (р=0,031), и лучшим положительным прогностическим значением: 100 и 40% соответственно. Чувствительность у обоих тестов была одинаковой и составила 57,1%. Показатель отрицательного прогностического значения также практически не различался – 93,3% у ПАМГ-1 и 92,3% у ФПСИФР.
Обсуждение
Полученные нами результаты показали, что у 85,7% (42 из 49) пациенток, включенных в анализ, несмотря на клинические симптомы, данные трансвагинальной цервикометрии, не произошло ПР, при этом у 33 (78,6%) ДШМ была <25 мм. Все эти женщины были госпитализированы в стационар, токолитическая терапия проведена 41 (97,6%) из них, профилактика РДС – 40 (95,2%). Следовательно, необходим метод, который бы имел и высокую чувствительность, и высокую специфичность для определения риска ПР.
Согласно нашим данным, тест ПАМГ-1 показал достоверно более высокую специфичность при определении прогноза ПР в течение <7 и 14 суток с момента госпитализации пациенток, чем тест ФПСИФР (99,7 и 100% против 84,1 и 85,7% соответственно). Положительное прогностическое значение теста ПАМГ-1 оказалось также более высоким, чем ФПСИФР, – 75 и 100% против 30 и 40% соответственно. Напротив, чувствительность обоих тестов была невысокой – 60 и 57,1%.
Таким образом, согласно полученным нами, а также опубликованным ранее данным [10–17], в настоящее время не существует единственного метода, позволяющего с высокой точностью прогнозировать ПР. Исходя из результатов исследования, можно констатировать, что совместное использование УЗ-цервикометрии и теста ПАМГ-1 позволяет проводить корректную маршрутизацию и своевременно начинать регламентированную терапию при положительном результате теста и укорочении шейки матки (<25 мм).
Отрицательный результат теста и длина шейки матки ≥ 25 мм позволяют избегать госпитализации, снижать риски, связанные с токолитической и кортикостероидной терапией, а также оптимизировать расходование человеческого ресурса и бюджетных средств.
Однако проведенного нами исследования недостаточно для выработки корректных рекомендаций в двух других ситуациях (положительный тест и длина шейки матки ≥25 мм и более; отрицательный тест и длина шейки матки <25 мм). Следует согласиться с мнением J. Varley-Campbell et al. о неубедительных на данный момент доказательствах эффективности теста ПАМГ-1 из-за небольшого числа пациенток в ранее проведенных исследованиях [6, 13–16]. В то же время авторы этого систематического обзора указывают на необходимость проведения тестирования всем женщинам с симптомами угрожающих ПР в сроке <30 недель по экономическим соображениям [17]. Таким образом, более масштабные доказательные исследования позволят окончательно оценить эффективность теста ПАМГ-1.
Заключение
По сравнению с тестом ФПСИФР тест ПАМГ-1 служит лучшим предиктором самопроизвольных ПР в течение 7 и 14 дней при сохранении очень высокого отрицательного прогностического значения. Оба теста представляют собой простые в использовании офисные методы, которые дают быстрые результаты и не требуют специального оборудования для анализа. Кроме того, тест ПАМГ-1 не требует осмотра с помощью зеркал и может использоваться после вагинального обследования и полового акта. Однако данных исследования и существующей доказательной базы недостаточно для широкого внедрения тестирования ПАМГ-1 в клиническую практику.


