Введение
По данным Всемирной организации здравоохранения, одной из ведущих причин ишемического инсульта (ИИ) во всем мире является фибрилляция предсердий (ФП), причем число пациентов, страдающих этой аритмией, в перспективе будет неуклонно расти в связи с наметившимся в последние десятилетия трендом старения населения. ФП выявляется у 20–30% больных с ИИ. Неклапанная ФП повышает риск ИИ в 5 раз [1–3]. Кардиоэмболический инсульт, ассоциированный с ФП, нередко осложняется геморрагической трансформацией (ГТ), имеет высокую частоту рецидивов тромбоэмболических событий (повторный ИИ, симптомные системные эмболии) и, как правило, приводит к неблагоприятному функциональную исходу [4].
Основным способом первичной и вторичной профилактики ИИ у больных с ФП является антикоагулянтная терапия (АТ) [1, 3]. Однако слишком раннее ее применение после ИИ сопряжено с высоким риском ГТ, а слишком позднее – с повторным ИИ и системными эмболиями. В связи с этим вопрос о сроках начала АТ у пациентов с ИИ и ФП активно обсуждается ведущими мировыми экспертами, т.к. свидетельства, основанные на доказательной медицине, до сих пор отсутствуют. Например, AHA/ASA (American Heart Association/American Stroke Association) рекомендуют индивидуальный подход к АТ после обсуждения возможных рисков тромбоэмболических и геморрагических осложнений в срок от 4 до 14 дней от дебюта ИИ для большинства пациентов с ФП, а при высоком риске ГТ – за пределами этого срока [3, 5, 6]. Еще с 2013 г. рекомендации ESC/EHRA (European Society of Cardiology/European Hearth Rhythm Association) по неклапанной ФП базируются на мнении консенсуса, известного как «правило 1–3–6–12 дня», или «правило Динера», причем единственным критерием для принятия решения служит клиническая тяжесть инсульта (балл по шкале инсульта Национальных институтов здоровья, NIHSS) [7, 8]. Тех же принципов придерживаются канадские и австралийские руководства по ведению больных с ИИ [2]. Однако ГТ является комплексным патологическим процессом, включающим ишемическое и реперфузионное повреждение мозга, коагулопатию и нарушение целостности гематоэнцефалического барьера, поэтому одного критерия тяжести ИИ для принятия решения о сроках начала АТ, очевидно, недостаточно. Таким образом, прогнозирование ГТ может значительно влиять на процесс принятия решения о начале или возобновлении АТ.
В 2017 г. разработана и успешно апробирована шкала HTI (Hemorrhagic Transformation Index), которая оценивает риск ГТ у больных с ИИ в бассейне средней мозговой артерии (СМА) в первые 2 недели от дебюта заболевания [9]. Несмотря на то что существует ряд аналогичных шкал, остается неисследованным вопрос об их прогностическом влиянии на возможные сроки начала АТ у больных с ФП и ИИ.
Целью настоящей работы стала оценка вероятности ГТ по шкале HTI для уточнения возможных сроков начала АТ у больных с ФП и ИИ в бассейне СМА.
Методы
Данная работа является субанализом ранее проведенного исследования [9]. Из уже имевшейся базы данных, состоявшей из 783 больных с ИИ в бассейне СМА, госпитализированных в течение первых 12 часов от дебюта заболевания, были отобраны 304 пациента с любой формой ФП. Еще на этапе создания шкалы HTI пациенты были рандомизированы в группы разработки и валидизации с помощью генератора переменных Бернулли с параметром вероятности 0,7.
Все больные проходили обследование и получали лечение в Республиканском головном сосудистом центре ГАУЗ МКДЦ Минздрава РТ в соответствии с действующим стандартом оказания помощи больным с ИИ. Изучались клинические, лабораторные и инструментальные данные при поступлении.
Пациентам при поступлении выполнялась бесконтрастная компьютерная томография (КТ) головного мозга, по которой оценивали симптом гиперденсивной СМА и объем инфаркта по шкале ASPECTS (Alberta Stroke Program Early CT Score) [9]. КТ в динамике выполнялась на 7-й и 14-й дни либо в любое время при наличии клинических показаний. Все пациенты имели хотя бы одно КТ-исследование в динамике.
Конечной точкой исследования была любая ГТ на КТ в динамике в течение 14 дней от начала ИИ. Симптомной считалась ГТ в соответствии с определением NINDS [10]. ГТ была далее классифицирована на геморрагический инфаркт 1-го, 2-го типов, либо паренхиматозную гематому 1-го, 2-го типов, согласно исследованиям ECASS [11].
Исследование одобрено локальным этическим комитетом ФГБОУ ВО «Казанский ГМУ» Минздрава России. С учетом ретроспективного характера работы информированного согласия пациентов не требовалось.
Описательная статистика включала медианные значения (M) с межквартильным диапазоном (МКД) и проценты, а базовые характеристики сравнивались между группами пациентов по критерию U-Манна–Уитни либо χ2-критерия Пирсона для непрерывных и категориальных переменных соответственно.
Оригинальная шкала HTI состоит из 9 категорий вероятности ГТ: число баллов варьируется от 0 до 8. Однако для удобства применения шкалы HTI в прогнозировании сроков начала АТ число категорий было уменьшено до 3–4 путем группировки баллов.
В результате было создано 4 варианта распределения баллов – модели, которые сравнивались между собой и правилом Динера на точность прогноза ГТ у пациентов из группы разработки с помощью бинарной логистической регрессии (БЛР) и ROC (receiver operating characteristic)-анализа.
Аналогичное тестирование пациентов из группы валидизации проводилось после выбора окончательной модели. Коэффициенты БЛР групп разработки и валидизации сравнивались между собой по методу Дж. Визи (J. Weesie) [12]. Возможные сроки начала АТ сопоставлялись между правилом Динера и шкалой HTI по расчетам прогнозируемой вероятности (ПВ) ГТ.
Результаты исследования
По базовым характеристикам пациенты из групп разработки и валидизации не отличались друг от друга (табл. 1).
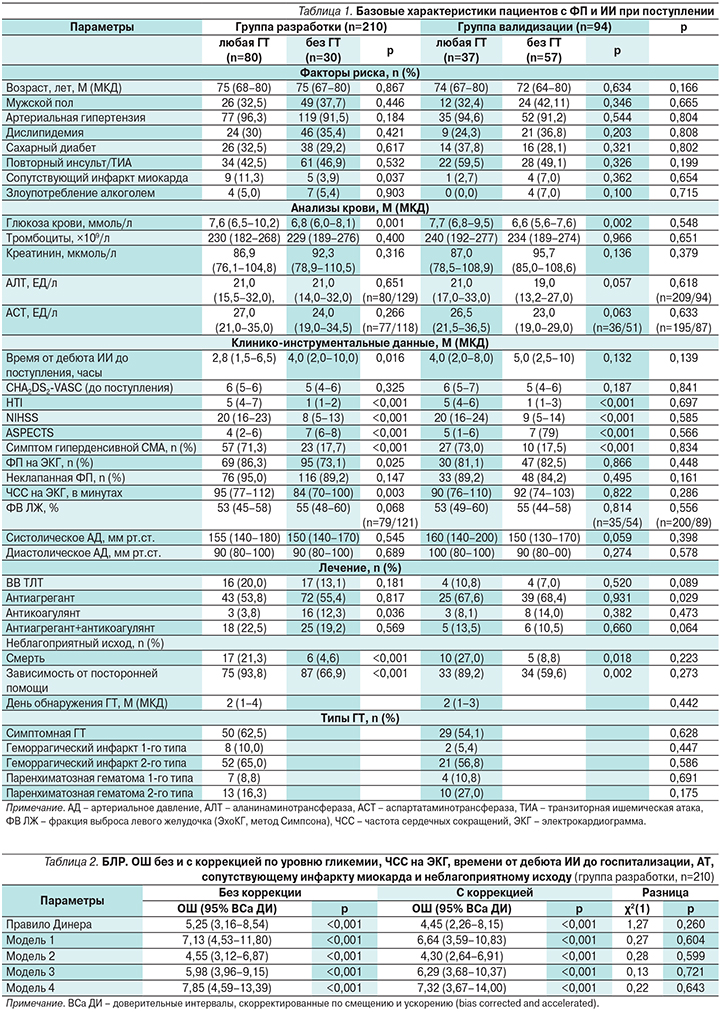
Больные из группы разработки с и без ГТ статистически значимо отличались друг от друга по предикторам ГТ (АТ, уровень гликемии, ЧСС на ЭКГ, сопутствующий инфаркт миокарда, NIHSS, ASPECTS, HTI и симптом гиперденсивной СМА), неблагоприятному исходу (смерть или зависимость от посторонней помощи, определенная как оценка >2 баллов по модифицированной шкале Рэнкина при выписке), а также срокам от дебюта ИИ до госпитализации. Однако в поливариационном анализе установлено, что влияние уровня гликемии, АТ, ЧСС на ЭКГ, сопутствующего инфаркта миокарда, неблагоприятного исхода и сроков госпитализации на отношение шансов (ОШ) всех тестируемых моделей было статистически не значимым (табл. 2).
Группировка баллов шкалы HTI и моделей сопоставления с правилом Динера по ПВ ГТ представлены в табл. 3.
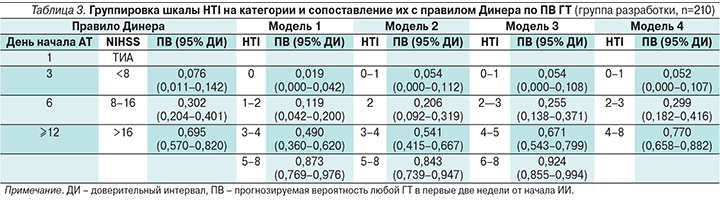
Правило Динера и все тестируемые модели являются статистически значимыми в предикции ГТ. При этом модель 3 показала наилучшие результаты, поэтому и была выбрана как окончательная (табл. 4).
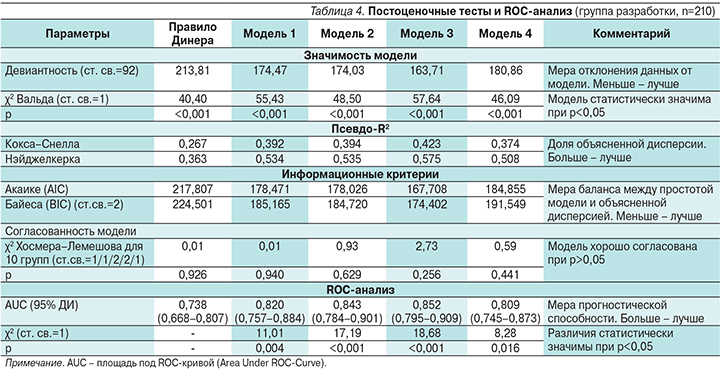
Результаты тестирования модели 3 и правила Динера на пациентах из группы валидизации хорошо согласуются с данными, полученными от больных из группы разработки (рис. 1, 2).
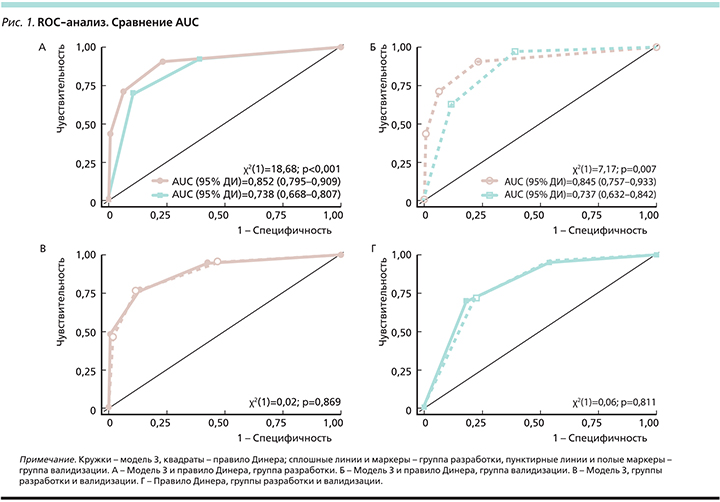
Категории HTI 0–1, 2–3 и 4–5 в модели 3 тождественны категориям NIHSS<8, 8–16 и >16 в правиле Динера по ПВ ГТ. Однако в шкале HTI имеется дополнительная категория – HTI 6–8 с ПВ ГТ>80% (рис. 2).

Необходимо отметить, что категории NIHSS 8–16 и >16 в правиле Динера неоднородны: в них присутствуют пациенты как с низкими баллами по шкале HTI, так и с высокими (рис. 3В, Г). Распределение баллов по шкале NIHSS также перекрывается между категориями HTI во всех тестируемых моделях, что подтверждает необходимость использования для более точного прогноза ГТ совокупности параметров, а не одного критерия (рис. 3А, Б).
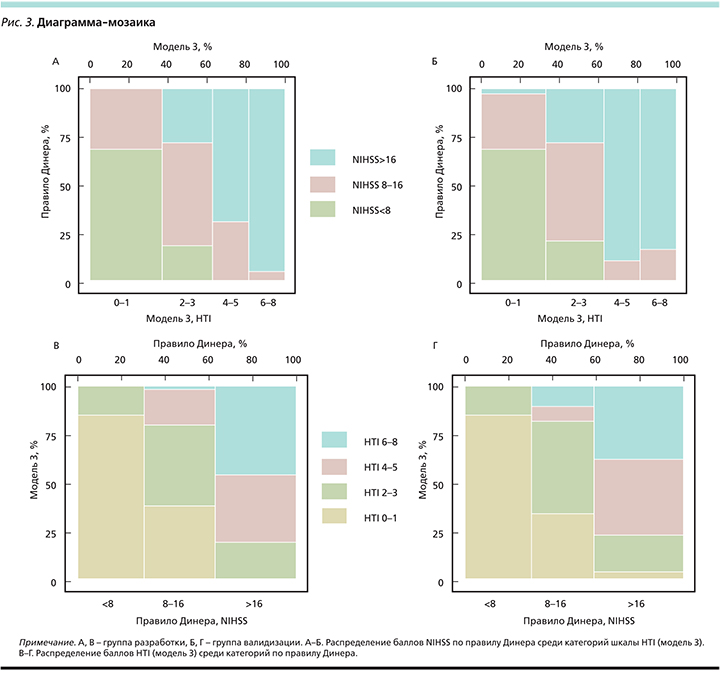
Сопоставив ПВ ГТ, рассчитанные на основе правила Динера и модели 3 шкалы HTI (табл. 3, рис. 2), справедливо ранжирование пациентов на группы низкого (меньше 50%, HTI 0–1, 2–3; NIHSS<8, 8–16) и высокого (50–80%, HTI 4–5, 6–8; NIHSS>16) рисков ГТ. Этот подход также позволяет сопоставлять возможные сроки начала АТ: низкий риск – с 3-го по 6-й день, высокий риск – после 12-го дня от начала ИИ. Пациенты с очень высоким риском (>80%) ГТ (HTI 6–8 баллов) составляют особую категорию, аналога которой в правиле Динера не существует.
Обсуждение
Обсервационные исследования показали, что без АТ риск повторного ИИ у пациентов с ФП в первую неделю от дебюта ИИ может составлять от 8 до 12% [13], поэтому раннее начало АТ может быть эффективным во вторичной профилактике ИИ. Однако применение гепаринов в течение 48 часов при ИИ, согласно мета-анализу подгрупп пациентов с ФП, не существенно снижало риск повторного ИИ, но значительно повышало частоту ГТ [14]. Основываясь на этих исследованиях, слишком раннее начало АТ у больных с ИИ с целью вторичной профилактики не показано [5]. Однако другие исследования установили низкий риск симптомной ГТ (1,5% в течение 14 дней) при применении АТ в течение первых 7 дней у избранных пациентов (отсутствие большого размера инфаркта, неконтролируемой гипертензии, ГТ на исходной нейровизуализации, тенденции к геморрагиям) [6].
Благоприятный профиль безопасности у больных с неклапанной ФП неантагонистов витамина K оральных антикоагулянтов (НОАК) – дабигатрана, ривароксабана и апиксабана – побудил к исследованиям их более раннего назначения при ИИ, результаты которых показали, что раннее применение (через 3–5 дней) ассоциировано с низкой частотой симптомной и асимптомной ГТ, а позднее (через >7–14 дней) повышает частоту повторного ИИ [2].
Полученные в данной работе результаты полностью согласуются с вышеуказанными исследованиями. Однако пациенты с вероятностью ГТ в первые 2 недели >80% составляют особую категорию, аналогов которой нет в правиле Динера. AHA/ASA рекомендуют таким пациентам индивидуальный подход и назначение АТ за пределами 14 дней [3, 5, 6]. Необходимы дальнейшие исследования для уточнения возможных сроков назначения АТ больным этой категории.
Для демонстрации шкалы HTI в прогнозировании ГТ и уточнении возможных сроков начала АТ приводится клинический случай.
Клинический случай
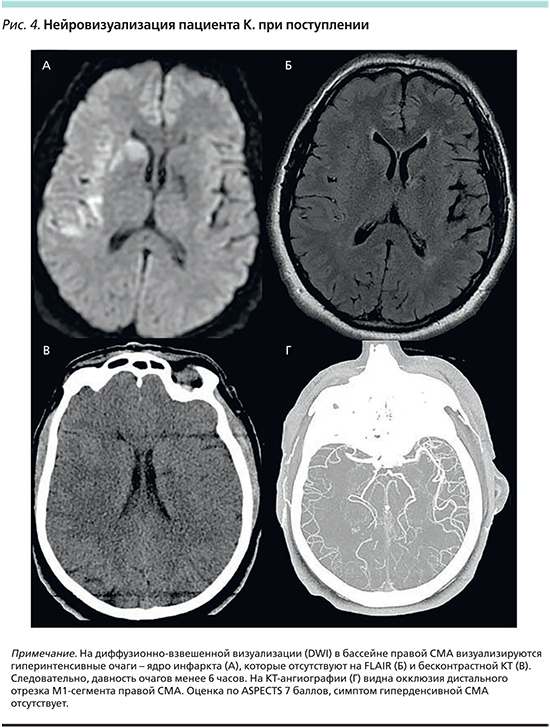
Пациент К., мужчина 53 лет, доставлен в приемный покой Республиканского головного сосудистого центра ГАУЗ МКДЦ через 1 час от начала симптомов с жалобами на слабость и онемение в левых конечностях, нечеткость речи. В анамнезе: коронарный атеросклероз (инфаркт миокарда 3 года назад, стенокардия напряжения), ФП и артериальная гипертензия. До госпитализации принимал ингибиторы ангиотензина II, β-адреноблокаторы и ацетилсалициловую кислоту. Объективные данные при поступлении: артериальное давление 140/90 мм рт.ст., пульс – 80 уд/мин, масса тела – 95 кг, NIHSS при поступлении – 8 баллов. На ЭКГ: ритм ФП, ЧСС – 80–105 в мин, рубцовые изменения задней стенки левого желудочка. Экстракраниальное дуплексное сканирование: атеросклероз брахиоцефальных артерий, стеноз справа: внутренней сонной артерии – 45–50%, слева: общей сонной артерии – 25–30%. ЭхоКГ: ФВ ЛЖ – 36%, тромботические массы в левом предсердии не визуализируются. Биохимические анализы крови, гемостаз, общий анализ крови без значимых изменений. Нейровизуализация при поступлении подтвердила диагноз острого ИИ (рис. 4).
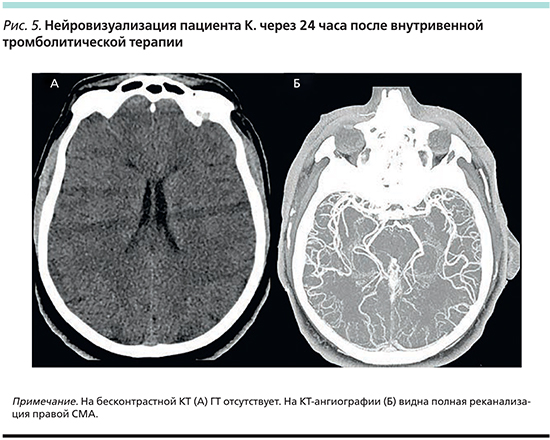
По шкале HTI у пациента 1 балл (ASPECTS=7 – 0 баллов по HTI, NIHSS=8 – 0 баллов по HTI, нет симптома гиперденсивной СМА — 0 баллов по HTI, на ЭКГ при поступлении ФП – 1 балл по HTI), следовательно, вероятность ГТ в первые 2 недели в среднем 5,4% (0–10,8%), т.е. больной из группы низкого риска ГТ. Пациенту проведена внутривенная тромболитическая терапия. Через 24 часа почти полный регресс неврологического дефицита – NIHSS 1 балл. При нейровизуализации: полная реканализация правой СМА, ГТ не наступила (рис. 5). Пациенту назначена АТ дабигатраном в дозе 150 мг 2 раза в сутки с 3-го дня от начала ИИ. На последующей КТ в динамике через 2 недели ГТ отсутствует. Пациент выписан через 3 недели на дальнейшую реабилитацию. При выписке оценка по модифицированной шкале Рэнкина 1 балл.
Выводы
Правило Динера и шкала HTI являются сопоставимыми инструментами для прогнозирования риска ГТ у больных с ИИ в бассейне СМА в первые 2 недели от начала заболевания. Однако шкала HTI дополнительно выделяет группу пациентов с очень высокой вероятностью ГТ. Пациентам с низким риском ГТ (менее 50%; HTI 0–1 и 2–3 баллов) возможно начало АТ в период с 3-го по 6-й день от дебюта ИИ, а c высоким риском (50–80%; HTI 4–5 баллов) – после 12 дней. Дополнительные исследования требуются больным с очень высоким риском (>80%, HTI 6–8 баллов) для уточнения возможных сроков начала АТ.



