Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – одно из самых распространенных хронических заболеваний органов пищеварения и по праву считается одной из важнейших медицинских проблем
XXI в. ГЭРБ рассматривается как патологическое состояние, которое развивается, когда рефлюкс желудочного содержимого в пищевод приводит к появлению симптомов, причиняющих беспокойство пациенту, и/или к развитию осложнений, наиболее распространенным из которых является рефлюкс-эзофагит (РЭ) [1, 2].
ГЭРБ отличается широким спектром симптомов и характеризуется значительной вариабельностью их частоты, интенсивности и продолжительности. Наиболее характерным, часто единственным симптомом ГЭРБ является изжога. Согласно данным систематического обзора, изжогой страдают 20–40 % популяции и в 10–20 % случаев она является симптомом ГЭРБ [1, 2].
Патогенетические особенности ГЭРБ
ГЭРБ представляет собой многофакторное кислотозависимое заболевание. Основным патогенетическим механизмом, ведущим к развитию ГЭРБ, является нарушение баланса между факторами агрессии и защиты слизистой оболочки пищевода в сторону первых, а также наличие желчных рефлюксов [3].
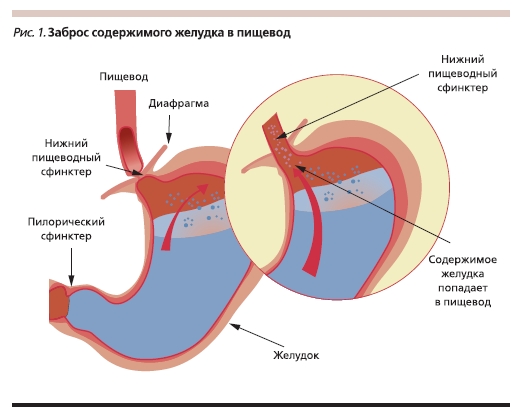
Основные причины развития ГЭРБ:
• нарушение функции нижнего пищеводного сфинктера (НПС) в виде увеличения эпизодов его расслабления (рис. 1);
• наличие грыжи пищеводного отверстия диафрагмы, которая приводит к анатомической несостоятельности НПС (рис. 2);
• повреждающее воздействие содержимого желудка (рефлюктата) на слизистую оболочку пищевода при РЭ;
• замедление клиренса пищевода: объемного (нарушение вторичной перистальтики пищевода, обеспечивающей его освобождение от рефлюктата) и химического (снижение выработки слюны и содержания бикарбонатов, присутствующих в слюне и пищеводном секрете);
• снижение резистентности слизистой оболочки пищевода;
• нарушение моторной функции желудка и двенадцатиперстной кишки (ДПК) по типу псевдостеноза
выходного отдела желудка, хронической дуоденальной непроходимости с гиперкинезией ДПК, функционального нарушения антропилородуоденальной координации в виде гипокинезии ДПК или гипокинезии желудка и преходящей гиперкинезии ДПК.
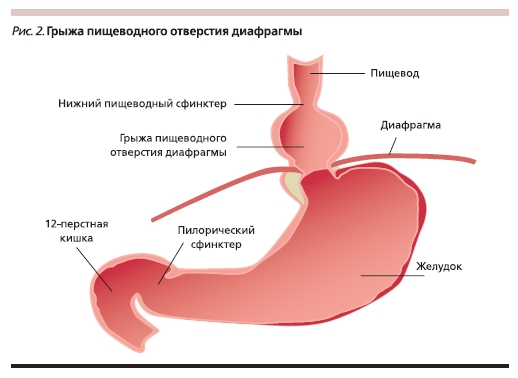
Большое значение в формировании ГЭРБ играет нарушение функции антирефлюксного барьера, которое может происходить при полной или частичной его деструктуризации, например, за счет первичного снижения давления в НПС, при грыже пищеводного отверстия диафрагмы, в результате увеличения числа эпизодов спонтанного (преходящего) расслабления НПС [4].
Преходящее (транзиторное) расслабление НПС служит ведущим механизмом желудочно-пищеводного рефлюкса как для здоровых людей (физиологическая отрыжка воздухом при торопливой еде или переедании), так и для пациентов с ГЭРБ. У последних имеет место гипотония или даже атония НПС. Причинами снижения тонуса НПС могут быть поражение блуждающего нерва (ваготомия, вагусная
нейропатия при сахарном диабете);потребление продуктов, содержащих кофеин (кофе, чай, кока-кола, энергетические напитки), а также лекарственные средства.
В настоящее время все большее число исследователей склоняются к мысли, будто важным кофактором патогенеза ГЭРБ являются нарушения моторной активности желудка – желудочные дисритмии. Особое внимание уделяется таким нарушениям моторики желудка и ДПК, как замедленная эвакуация
желудочного содержимого из проксимального отдела желудка, нарушения антродуоденальной координации и дуоденогастральный рефлюкс.
Примечательно, что при нарушении антродуоденальной координации наиболее часты следующие симптомы: изжога, отрыжка кислым или горьким, срыгивание пищи, т. е. характерные симптомы ГЭРБ, причиняющие беспокойство пациенту и приводящие к развитию осложнений этого заболевания [4].
Клинические проявления ГЭРБ
Клиническая картина ГЭРБ многолика, может манифестировать и осложняться как пищеводными (изжога, регургитация), так и внепищеводными (абдоминальными, респираторными, кардиальными, псевдокардиальными, оториноларингологическими, стоматологическими) проявлениями.
По частоте регистрации основным клиническим проявлением ГЭРБ является изжога – 81 %. В 57 % случаев это отрыжка кислым, в 42 % – боли в эпигастрии.
Изжога – это типичный, часто единственный симптом ГЭРБ. Большинством больных изжога воспринимается как мучительное чувство жжения различной интенсивности и продолжительности, локализованное за грудиной, в области глотки, шеи, реже – в эпигастрии [1]. Считается, что главным в механизме возникновения изжоги при ГЭРБ является длительное воздействие на слизистую
оболочку пищевода соляной кислоты и пепсина при нарушении запирательной функции НПС и возникновении желудочно-пищеводного рефлюкса. При этом решающим фактором развития повреждений слизистой пищевода являются частота, интенсивность и продолжительность кислотных
забросов (процент времени с рН < 4). Кроме того, симптом изжоги может быть вызван компонентами желчи в желудочном содержимом при наличии дуоденогастрального рефлюкса, который часто сопровождает патологию желчевыводящих путей, поджелудочной железы, дуоденостаз. В этом случае одновременно с изжогой больные часто предъявляют жалобы на чувство горечи во рту, особенно по утрам [4].
При рассмотрении клинической картины ГЭРБ, имеющей важное диагностическое значение, следует помнить о ее вариабельности, а также об отсутствии связи между выраженностью рефлюксных симптомов и тяжестью эзофагита, сопровождающего это заболевание.
Для развития ГЭРБ имеет значение ряд предрасполагающих факторов, к числу которых относятся
[1, 5]:
• наследственная отягощенность;
• избыточная масса тела;
• беременность, при которой имеет место повышение внутрибрюшного давления, высокое содержание
эстрогенов и прогестерона, обладающих спазмолитическим эффектом в отношении гладкой мускулатуры, в частности НПС;
• факторы питания (повышенное потребление жирной, жареной пищи, шоколада, кофе, алкоголя,
специй, фруктовых соков и т. д.);
• курение;
• применение некоторых лекарственных препаратов (седативные средства, антидепрессанты, антагонисты кальция, холинолитики, β-адреноблокаторы, теофиллин, нитраты, глюкагон, глюкокортикостероиды);
• стрессовые ситуации, сопровождающиеся как повышением агрессивных свойств желудочного сока, так и снижением резистентности слизистых оболочек верхних отделов пищеварительного тракта;
• типичные позы в процессе бытовой либо профессиональной деятельности с наклоном туловища вперед и повышением внутрибрюшного давления;
• метеоризм любого происхождения, а также большие кисты и объемные образования брюшной полости и забрюшинного пространства;
• провокация гастроэзофагеального рефлюкса возможна при быстром употреблении пищи, что сопровождается аэрофагией и нарастанием внутрижелудочного давления.
Диагностика ГЭРБ
В клинической практике при постановке диагноза ГЭРБ следует в первую очередь ориентироваться на то, беспокоят пациента симптомы рефлюкса или нет, вне зависимости от их частоты и длительности. Тем не менее количественные критерии весьма полезны при определении эффективности того или иного метода лечения ГЭРБ. В настоящее время рекомендовано придерживаться количественных критериев диагностики ГЭРБ клиники Мэйо, получивших широкое распространение в качестве
инструмента при эпидемиологических исследованиях: наличие изжоги и/или регургитации минимум 1 раз в неделю на протяжении последних 12 месяцев [6]. Эксперты, принимавшие участие в выработке Монреальского консенсуса, предложили разделить многообразные проявления ГЭРБ на эзофагеальные и экстраэзофагеальные синдромы. Экстраэзофагеальные (внепищеводные) симптомы принято делить на имеющие установленную и предположительную связь с ГЭРБ (см. таблицу). Таким образом, диагноз
ГЭРБ может быть поставлен только на основании характерных симптомов (изжоги и регургитации) или методов, демонстрирующих наличие рефлюкса содержимого желудка (рН-метрия, импедансметрия) или повреждающее влияние рефлюкса (эндоскопия, гистологическое исследование, электронная микроскопия), при наличии типичных и атипичных симптомов или осложнений [2].
Таблица. Синдромы, ассоциированные с ГЭРБ (Монреаль, 2005).
В последние годы гастроэнтерологи рекомендуют пробное лечение (терапевтический тест) в качестве диагностического теста. Оно проводится пациентам с вероятной ГЭРБ. В то же время пробное лечение не должно назначаться при атипических симптомах болезни и подозрении на опухоль пищевода (сочетание дисфагии и снижения массы тела). Наиболее желательно назначение пробной терапии
пациентам с сочетанием ГЭРБ и ишемической болезни сердца (ИБС) или ГЭРБ и бронхиальной астмы, которым затруднительно проведение суточного мониторирования пищевода или эндоскопического исследования [5].
Дифференциальный диагноз ГЭРБ проводится как с заболеваниями пищевода (пептическая язва пищевода, рак пищевода либо кардиального отдела желудка, ахалазия кардии, диффузный спазм пищевода, системная склеродермия, дивертикулы пищевода), так и с заболеваниями других органов (ИБС, язвенная болезнь желудка).
При дифференциации различных заболеваний пищевода немаловажную роль имеет детализация жалоб больных, однако решающее значение принадлежит комплексу инструментальных исследований (рентгенологическое, эндоскопическое), позволяющих визуализировать стенку и слизистую оболочку пищевода, а также оценивать морфологические характеристики слизистой оболочки. Большие трудности возникают при дифференциальной диагностике с ИБС. Диагноз последней может быть снят в пользу ГЭРБ только по результатам комплексных исследований с изучением толерантности к физической нагрузке (велоэргометрия, тредмил, холтеровское мониторирование, чреспищеводная электростимуляция и т. д.) и при наличии несомненного РЭ. В сомнительных случаях показано проведение коронарографии. До 20 % отрицательных результатов проводимых коронарографий связано именно с ГЭРБ [5].
Лечение ГЭРБ
Лечение больных ГЭРБ направлено на быстрое и полное купирование клинической симптоматики заболевания; заживление эрозий и язв слизистой оболочки пищевода; профилактику рецидивов; предотвращение или устранение осложнений; повышение качества жизни пациентов [1]. Основные принципы лечения ГЭРБ в настоящее время:
• изменение образа жизни, режима и характера питания;
• рациональная лекарственная, в т. ч.
длительная поддерживающая, терапия;
• антирефлюксное хирургическое лечение.
Изменение образа жизни полностью сохраняет свою значимость в лечении больных ГЭРБ и нередко позволяет устранять значимые факторы риска заболевания [1].
Традиционно рекомендуется ряд мер, направленных на устранение факторов, неблагоприятно влияющих на моторику пищевода или повышающих внутрибрюшное давление:
• отказ от курения;
• снижение массы тела при наличии избыточного веса;
• сон с приподнятым на 15–20 см головным концом кровати;
• отказ от ношения тесной одежды, тугих поясов, ремней и корсетов;
• избегание чрезмерной нагрузки на мышцы брюшного пресса;
• воздержание от физических упражнений, связанных с наклонами туловища, поднятием тяжестей весом более 10 кг;
• ограничение применения лекарственных препаратов, снижающих тонус НПС (нитраты, β-адреноблокаторы, антагонисты кальция, спазмолитики, антидепрессанты, теофиллин, прогестерон), а также средств, повреждающих слизистую оболочку пищевода (нестероидные противовоспалительные препараты, доксициклин, хинидин);
• устранение явлений хронического запора.
В настоящее время в арсенале врача имеется ряд современных средств патогенетической терапии ГЭРБ, позволяющих в большинстве случаев эффективно устранять клинические проявления болезни и добиваться эпителизации эрозий и язв слизистой оболочки пищевода.
Если в соответствии с международными рекомендациями Российской гастроэнтерологической ассоциации препаратами выбора лечения ГЭРБ с наличием эрозивного эзофагита служат ингибиторы протонной помпы (ИПП), то в отсутствие эрозивного поражения слизистой оболочки пищевода (неэрозивная рефлюксная болезнь), особенно при небольшом анамнезе заболевания, в настоящее
время обсуждаются различные варианты и режимы медикаментозного лечения, в частности, с помощью моно- и комбинированного лечения антацидами, прокинетиками и ИПП [7]. Основными критериями эффективности лечения являются быстрое и надежное устранение симптомов заболевания и обусловленное этим повышение качества жизни пациентов.
В 2008 г. состоялось международное собрание экспертов-гастроэнтерологов по ГЭРБ в Гштааде (Швейцария), в процессе которого обсуждались вопросы тактики ведения и лечения пациентов с этим заболеванием. Согласно достигнутому консенсусу, начальная терапия ГЭРБ должна в большей степени ориентироваться на симптоматический, нежели на патогенетический, подход. При этом, если симптомы уменьшаются при назначении антисекреторной терапии, доказывается роль кислотного рефлюкса, если же эффект лечения антисекреторными средствами отсутствует, это подтверждает участие других факторов в патогенезе ГЭРБ. Эксперты пришли также к выводу, что если развитие симптомов ГЭРБ зависит не только от секреции соляной кислоты, то ИПП не должны быть единственным препаратом ее лечения. Антациды могут быть дополнительной группой средств, используемых в качестве лечения пациентов с симптомами рефлюкса на первичном этапе или больных с продолжающимися симптомами ГЭРБ, недостаточно контролируемыми антисекреторными средствами [7, 8].
Новый алгоритм ведения больных ГЭРБ (рис. 3) основан на Гштаадском консенсусе [1, 7]. В нем в отличие от предыдущих рекомендаций выделено три уровня оказания помощи пациентам с ГЭРБ: самолечение, первичная медицинская помощь (врачтерапевт) и специализированная
медицинская помощь (гастроэнтеролог). Согласно этому алгоритму, ИПП могут применяться для купирования симптомов ГЭРБ на всех трех уровнях ее лечения.
Рисунок 3. Алгоритм лечебной тактики ГЭБР. Адаптировано из [1, 7].
Поиск эффективных способов лечения и профилактики ГЭРБ при наличии огромного числа медикаментов, таких как антациды, блокаторы Н2-рецепторов гистамина, ИПП, является ответственной задачей клиницистов. В настоящее время в лечении ГЭРБ ведущее место принадлежит
препаратам, блокирующим выработку соляной кислоты париетальными клетками слизистой оболочки желудка. Это блокаторы Н2-гистаминовых рецепторов и ИПП.
По данным исследований, базирующихся на принципах доказательной медицины, из указанных препаратов наиболее эффективны ИПП. Они блокируют как базальную, так и стимулированную желудочную секрецию в отличие от блокаторов Н2-гистаминовых рецепторов, которые подавляют преимущественно базальную секрецию [9]. После отмены ИПП полная блокада желудочной секреции сохраняется в течение 7–10 дней. Только ИПП способны в стандартном режиме обеспечивать большинству больных достаточно стойкое и продолжительное угнетение желудочной секреции, необходимое для оптимального лечения ГЭРБ, на уровне рН > 3,0–5,0 не менее 16–18 часов в
сутки [1].
Разработка и совершенствование ИПП обеспечили появление на фармацевтическом рынке ряда препаратов этой группы: омепразола, лансопразола, пантопразола, рабепразола и др. Все они являются пролекарствами и относятся к производным бензимидазола, превращаются в кислой среде
в активную форму – сульфенамид, который необратимо взаимодействует с SH-группами H+/K+-ATФазы, приводя к подавлению ее активности в париетальных клетках желудка.
Париетальная клетка представляет собой поляризованную структуру, на базолатеральной мембране которой имеется группа рецепторов, обеспечивающих последующие метаболические изменения в клетке под влиянием молекул ацетилхолина, гастрина и гистамина (рис. 4). Стимуляция рецепторных структур базолатеральной мембраны с помощью сигнальных внеклеточных молекул в конечном счете заканчивается продукцией иона водорода и окончательным функциональным ответом – секрецией соляной кислоты [10].
Внутри париетальной клетки происходят многоуровневые реакции: ацетилхолин и гастрин стимулируют образование группы вторичных сигнальных молекул, а гистамин действует через молекулу цАМФ. Продукция кислоты осуществляется протонной помпой H+/K+-АТФазой. Это энергозависимый (АТФ-зависимый) ионный насос, который переносит ион водорода в просвет железы слизистой оболочки желудка, а ион калия – в париетальную клетку. Молекулы H+/K+-АТФазы в клетках, которые находятся в несекретирующем состоянии, диффузно распределены в цитоплазме. В процессе подготовки к секреции молекулы H+/K+-АТФазы перемещаются на поверхность секреторных канальцев, встраиваются в их мембраны и начинают переносить ион водорода из клетки
в просвет железы, а ион калия – во внутриклеточное пространство за счет энергии АТФ.
ИПП действуют не на рецепторный аппарат париетальной клетки, а на внутриклеточный фермент H+/
K+-АТФазу, блокируя работу протонной помпы и, следовательно, продукцию соляной кислоты (рис. 4).
Рисунок 4. Механизм действия ИПП на париетальную клетку. Адаптировано [10].
Одним из представителей нового поколения ИПП является пантопразол (Контролок). Он метаболизируется с участием CYP2C19 и CYP3A4, но по сравнению с другими ИПП обладает меньшей аффинностью к этим ферментам [11]. В отличие от большинства продуктов, образующихся в фазе I
биотрансформации других ИПП, первоначальный метаболит пантопразола, 4-гидроксипантопразол, продуцируемый в результате воздействия системы CYP, проходит затем вторичную биотрансформацию (фаза II) посредством конъюгации с сульфатом в цитозоле. Эту реакцию, которая является относительно ненасыщаемым путем метаболизма лекарственных средств, часто расценивают как причину более низкой способности пантопразола вступать в лекарственные взаимодействия по сравнению с другими ИПП [10].
В исследованиях, проведенных с участием здоровых добровольцев и больных, продемонстрировано отсутствие значимых метаболических взаимодействий при применении пантопразола в комбинации с антацидами, феназоном, кофеином, карбамазепином, цинакальцетом, кларитромицином, циклоспорином, диазепамом, диклофенаком, β-ацетилдигоксином, этанолом, глибенкламидом, натрия левотироксином, метопрололом, напроксеном, нифедипином замедленного высвобождения, пероральными контрацептивами, фенпрокумоном, фенитоином, пироксикамом, такролимусом, теофиллином или варфарином [10].
Многие больные наряду с антисекреторными препаратами принимают и другие лекарственные средства. Наиболее серьезные последствия полипрагмазии – повышение риска развития побочных реакций и взаимодействие принятых препаратов. Так, при приеме двух препаратов потенциаль-
ный риск их взаимодействия составляет 6 %, а при приеме пяти — 50 %. Для предотвращения этих неблагоприятных последствий (вне зависимости от количества одновременно принимаемых лекарств) предпочтительно принимать препарат, потенциально слабо взаимодействующий с другими медикаментами [12].
Механизм действия пантопразола (Контролока)
Действие на pH желудка
Пероральный прием. Дозозависимое снижение базальной, ночной и 24-часовой желудочной секреции
соляной кислоты наблюдается при приеме пантопразола 20–40 мг/сут в течение 5–7 дней. Более оптимальное ингибирование секреции соляной кислоты достигается при приеме 40 мг Контролока утром, чем при приеме той же дозы вечером (19.00). Прием Контролока 40 мг/сут обеспечивает длительное антисекреторное действие (медиана внутрижелудочного pH в течение 24 часов составляет 4,2). Начиная с первой дозы пантопразол обладает высокой биодоступностью (77 %), благодаря чему он обеспечивает быстрое и выраженное подавление секреции соляной кислоты. Препарат характеризуется постоянной линейной, хорошо предсказуемой фармакокинетикой. Это дает возможность обеспечивать оптимальное лечение,соответствующее тяжести заболевания и общему состоянию больного.
После повторного приема Контролока в дозе 40 мг/сут ингибирование секреции соляной кислоты
сходно с таковым при пероральном приеме омепразола 40 мг/сут; более выражено, чем при приеме омепразола MUPS 20 мг/сут; меньше или сходно с таковым при приеме лансопразола 30 мг/сут или эзомепразола 40 мг/сут и более выражено, чем при пероральном приеме ранитидина 300 мг/сут или
омепразола 20 мг/сут.
Контролок длительно подавляет образование соляной кислоты, что дает возможность добиваться снижения ее секреции на протяжении суток. Он обладает самым длительным полупериодом угнетения секреции соляной кислоты (до 45,9 часа) по сравнению с омепразолом (до 27,5 часа) и лансопразолом (до 12,9 часа). Это обусловлено специфическим связыванием препарата с расположенным в 822-м
положении цистеином, погруженным в транспортный домен желудочного кислотного насоса.
Необходимость удвоения дозы Контролока возникает намного реже по сравнению с другими ИПП, что
снижает расходы на приобретение препарата и уменьшает число посещений врача в связи с неэффективностью лечения.
Внутривенное введение. Одинаковое уменьшение максимальной кислотопродукции и повышение желудочного pH, среднего 24-часового pH и среднего процента 24-часового цикла, при котором желудочный pH был ≥ 4 или ≥ 3, наблюдается при внутривенном и пероральном применении Контролока в одинаковой дозе. Отмечено дозозависимое угнетение секреции соляной кислоты при внутривенном введении Контролока в дозе 20–120 мг. Время до начала ингибирующего действия при внутривенном введении Контролока 80 мг составляет менее часа. Поддержание угнетающего действия на продукцию соляной кислоты при внутривенном введении Контролока 80 мг продолжается 21 час.
Внутривенное введение 16 здоровым добровольцам с резистентностью к ранитидину начальной дозы
Контролока 80 мг с последующей инфузией со скоростью 8 мг/ч повышало желудочный pH на 314 %.
Влияние на сывороточный уровень гастрина
Значительное увеличение (p < 0,05) продукции гастрина отмечено после перорального приема Контролока в дозах 40, 80 или 120 мг/сут по сравнению с отсутствием лечения. Медианный уровень гастрина в плазме крови (его значение до лечения составляло 52 нг/л) достигал максимальных
значений через 6 месяцев (108 нг/л) и оставался стабильным через 9 месяцев (92 нг/л). Значительно (p < 0,05 или 0,01) меньшее повышение сывороточного уровня гастрина наблюдалось при пероральном приеме Контролока 40 мг/сут по сравнению с приемом омепразола 40 мг/сут.
Другие эффекты
Длительный (до 5 лет) пероральный прием Контролока (в основном в дозе 40 или 80 мг/сут) незначительно или умеренно повышал плотность ECL-клеток в слизистой оболочке желудка. Отсутствовало клинически значимое влияние на функции сердечнососудистой и центральной нервной
систем при пероральном или внутривенном применении Контролока в дозе 40 или 80 мг здоровыми добровольцами [13].
Двойная оболочка таблетки Контролока, технология производства которой защищена европейским
патентом, обеспечивает предсказуемую длительность действия, высокий уровень эффективности и оптимальный профиль безопасности при каждом приеме.
В последние годы наше понимание механизмов, лежащих в основе лекарственных взаимодействий с участием ИПП, значительно повысилось. Если в прошлом основным фактором, определяющим взаимодействия этих медикаментов, считали повышение рН в желудке, то позднее стало ясно, что
важную роль часто играют реакции биотрансформации в печени и клетках кишечника.
Благодаря более глубокому пониманию механизмов, лежащих в основе лекарственных взаимодействий,
большое внимание стало уделяться такому факту: различия в метаболизме разных ИПП выражаются в
их разной способности вступать в лекарственные взаимодействия. Эти предсказуемые различия подкреплены результатами исследований фармакокинетики. При этом необходимо отметить, что особенности взаимодействия разных ИПП изучены в неодинаковой степени; так, препараты, присутствующие на рынке дольше всего, такие как омепразол и пантопразол, были исследованы наи-
более детально.
На практике различия между ИПП в отношении их клинической эффективности в эквивалентных дозах невелики. Поэтому их индивидуальная способность вступать в лекарственные взаимодействия становится важным фактором, который необходимо учитывать при принятии решения о назначении того или иного препарата.
Большинство лекарственных взаимодействий и побочных явлений, ассоциированных с ИПП, предсказуемы, и их можно предупредить с помощью периодической переоценки схемы лечения и/или выбора препаратов с более низкой способностью к взаимодействиям.
Клиническое значение лекарственных взаимодействий может иметь особое значение для лиц пожилого возраста, у которых их риск особенно высок в связи с одновременным приемом множества медикаментов, а также для пациентов, принимающих препараты с узким диапазоном терапевтического действия. В таких случаях необходимо отдавать предпочтение лекарству с низким риском и тщательно охарактеризованной способностью вступать в такие взаимодействия.
Применение Контролока (рис. 5)
При эрозивной ГЭРБ стадий А и В по Лос-Анджелесской классификации или при неэрозивной рефлюксной болезни рекомендуемая доза Контролока составляет 40 мг/сут; при ГЭРБ стадий С или D препарат назначается по 40–80 мг/сут в 1 или 2 приема. Облегчение симптомов обычно наступает в течение первых двух недель. Курс терапии составляет 4–8 недель.
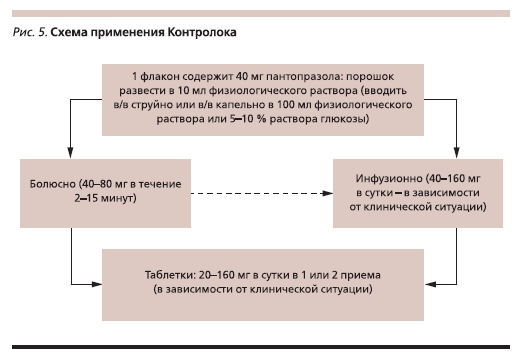
В качестве поддерживающей длительной терапии пантопразол назначают по 20 мг/сут, при необходимости (например, больным пищеводом Барретта) дозу повышают до 40–80 мг в сутки. Возможен прием препарата “по требованию” при возникновении симптомов [14].
Таким образом, ГЭРБ является широко распространенным заболеванием. Учет особенностей ее клини-
ческого течения позволяет проводить своевременную диагностику и назначать адекватную поэтапную терапию. Изменение образа жизни и применение ИПП, таких как Контролок, позволяют значительно уменьшать симптомы ГЭРБ и снижать риск развития осложнений, возникающих при этой патологии.



