Введение
В настоящее время наблюдается рост числа таких наследственных заболеваний, как генетически обусловленные первичные иммунодефициты (ПИД). Частота данных заболеваний зависит от пенетрантности мутантных генов, вида наследования, и составляет от 1:500 до 1:5 000 000 новорожденных [1–4]. Привычным является представление о ПИД как о патологии, свойственной детскому возрасту [1–4]. Однако отмечается увеличение регистрации случаев ПИД у взрослых пациентов [2, 3, 5–8, 10]. В частности, к таким заболеваниям относится и общая вариабельная иммунная недостаточность (ОВИН, англ. сommon variable immune deficiency – CVID). Этот термин обозначает группу генетических, не до конца дифференцированных ПИД, характеризующихся разнообразными иммунными нарушениями, среди которых преимущественными считают дефекты синтеза антител, обусловленные повреждениями регуляторных функций как Т-клеток, так и/или В-клеток [1–8]. Существует мнение, будто данный диагноз следует выставлять в случае исключения других первичных иммунодефицитов [3].
Первые клинические признаки ОВИН могут проявляться в любом возрасте, хотя выделяют несколько пиков возникновения клинических симптомов и диагностики ОВИН: детский возраст с началом развития симптомов в 2–7 лет, у взрослых – в 25–30 и 50–60 лет [1, 5–7]. Поэтому сложно утверждать, какой возрастной интервал в каждом отдельном случае следует рассматривать как начало манифестации ОВИН. Клиническая картина заболевания с неспецифическим симптомокомплексом затрудняет диагностику и влечет за собой несвоевременность и неадекватность терапии. Во многих источниках упоминается, что первыми симптомами ОВИН являются затяжные воспалительные заболевания носоглотки, встречающиеся как у детей, так и у взрослых. В современных условиях взрослые, особенно лица молодого возраста, редко обращаются за врачебной помощью до появления рецидивирующих синуситов и отитов. Зачастую данные воспалительные процессы трудно поддаются традиционной антибиотикотерапии и приобретают хроническое течение из-за резистентности микроорганизмов или присоединения грибковых патогенов. В то же время начальными проявлениями ОВИН могут быть артриты, тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия, мальабсоробция или колиты бактериальной этиологии, дисбактериозы и упорные лямблиозы, сочетающиеся с поражениями респираторного тракта, лимфопролиферативные и другие онкологические заболевания [1, 3–5, 7–9]. Как было показано ранее, диагностика ОВИН в России у взрослых чрезвычайно запаздывает, что приводит к ухудшению состояния пациентов из-за отсутствия адекватной терапии внутривенными иммуноглобулиновыми препаратами (ВВИГ) [7–10].
Цель исследования: описание трудностей диагностики ОВИН в амбулаторно-поликлинических условиях на примере двух клинических случаев у взрослых.
Клинический случай 1
Пациентка С. 31 года при обращении в мае 2017 г. предъявляла жалобы на выраженную слабость. В анамнезе частые заболевания верхних дыхательных путей, которые наблюдались с детства, с 18 лет – гаймориты, в 27 лет – левосторонний гнойный синусит. В 28 лет (2014) на сроке 12 недель 1-й беременности больная перенесла односторонний гнойный отит, получала антибиотики. Во время кормления ребенка и в период 2-й беременности также страдала частыми респираторными заболеваниями, осложненными бактериальными инфекциями, по поводу которых получала антибактериальную терапию. На сроке 26–28 недель в стационаре был поставлен диагноз левосторонней плевропневмонии с большим выпотом. Учтя беременность и тяжесть заболевания, пациентку перевели в клинику ПСПбГМУ им. И. П. Павлова, где впервые было установлено снижение уровней всех основных классов иммуноглобулинов (IgА, IgМ, IgG) (табл. 1).
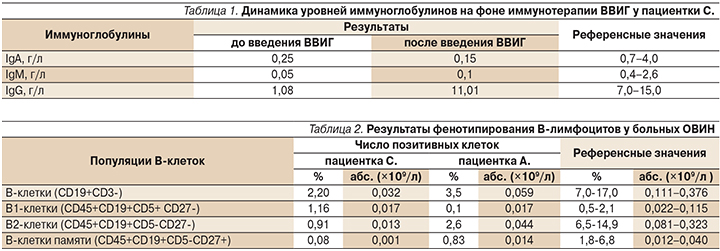
При фенотипировании клеток периферической крови методом проточной цитометрии выявили низкий уровень Т-хелперов (28,9% при норме 33–52%), высокий – цитотоксических Т-лимфоцитов (56,3% при норме 19–35%) и значительное снижение числа В2-клеток и В-клеток памяти (табл. 2).
Это свидетельствует о существенном нарушении регуляторной функции Т-лимфоцитов в отношении дифференцировки В-лимфоцитов в антителпродуцирующие клетки и их способности к синтезу разных классов иммуноглобулинов, что типично для данного вида ПИД.
Больной трехкратно была проведена заместительная терапия внутривенными иммуноглобулиновыми препаратами (5%, 650 мл): два введения – до и одно – после родоразрешения. Через 10 дней после 3-го введения ВВИГ уровень IgG составил 11,01 г/л (см. табл. 1).
Верификация диагноза свидетельствовала о необходимости ежемесячного введения 5%-ного раствора ВВИГ внутривенно капельно в стандартной дозе для поддержания уровня IgG не ниже 5 г/л с контролем через неделю после каждого введения препарата и перед следующим введением.
Необходимо отметить, что представленный случай не является исключением, когда при наличии у взрослого человека клинической картины, свидетельствующей о ПИД, диагноз верифицирован несвоевременно. Подобная ситуация еще раз подтверждает тезис о недостаточном знании врачами разных специальностей признаков иммунодефицитного состояния для своевременного назначения больному исследования состояния иммунной системы [8–10, 12].
О возможных дефектах, прежде всего связанных с нарушением дифференцировки и выживаемости В-клеток, свидетельствует низкое содержание В2-клеток и В-клеток памяти в периферической крови. Это, возможно, служит признаком нарушения передачи сигнала с В-клеточного рецептора и/или передачи сигнала цитокинами и механизмом CD40-CD40L, инициирующими дифференцировку В-клеток в антителопродуценты [1, 3, 4, 12]. Важная роль принадлежит, как считают, генетическим нарушениям, обусловленным мутациями генов, кодирующих цитокины и рецепторы cемейства ФНО (фактор некроза опухоли), сигналы с которых влияют на развитие и выживаемость В-лимфоцитов [13, 14]. Нарушения физиологии В-клеток и гуморального иммунитета включают процессы с участием фактора активации В-клеток (BAFF). BAFF связывается тремя различными рецепторами (BAFFR, TACI и BCMA), главным образом представленными на B-клетках, а также на активированных T-клетках. BAFF является главным регулятором выживаемости периферических В-клеток, участвует в различных процессах, таких как переключение синтеза иммуноглобулинов с одного изотипа на другой или костимуляции В-клеток. Обнаружено, что при дефекте гена BAFF резко снижается число В-лимфоцитов в периферической крови за счет нарушения дифференцировки В-клеток на стадиях их заселения в маргинальные зоны лимфатических узлов [1, 3, 4, 12]. Возможно, у данной пациентки нарушен механизм взаимодействия BAFF c рецепторами на В-лимфоцитах.
Клинический случай 2
Пациентка А. 30 лет обратилась по направлению «Общества больных с ПИД» с жалобами на выраженную слабость, постоянные головные и мышечные боли в последние 7 лет, заложенность носа, кашель. Из анамнеза установлено, что в течение жизни пациентка часто болела респираторными заболеваниями, сопровождающимися увеличением и болезненностью лимфоузлов. В возрасте 20 лет (2006) был поставлен диагноз инфекционного мононуклеоза, но атипичные мононуклеары в периферической крови обнаружены не были. Через 2 года (2008) обратилась в клинику ПСПбГМУ им. И.П. Павлова, где был поставлен диагноз: лимфома Беркита III с поражением подчелюстных, переднешейных лимфоузлов, левой слюнной железы, обеих молочных и бартолиниевых желез. Получала лечение по протоколу (мабтера, доксирубицин, циклофосфан, урометаксим, преднизолон). В том же году достигнута полная ремиссия. Во время терапии беспокоили затяжные риниты, осложнявшиеся гайморитами. В процессе лечения развились агранулоцитоз и тромбоцитопения II степени. После 2-го курса терапии, проведенного с профилактической целью (цитозар, дексаметазон, метатрексат), была выполнена миелоэксфузия и аутотрансплантация костного мозга. В последующие два года получала поддерживающую терапию мабтерой. После окончания лечения появились мышечные боли в области верхней челюсти, а также в верхних и нижних конечностях. Состояние ухудшилось в 2013 г., беспокоили постоянные мышечные и головные боли. Самостоятельно принимала анаферон, интерферон и прегабалин.
При обследовании в НИИ эпидемиологии и микробиологии им. Пастера в сентябре 2017 г. антитела к герпес-вирусам, цитомегаловирусу (ЦМВ) и вирусу Эпштейна–Барр (ВЭБ) не выявили. Проведенное иммунологическое исследование позволило обнаружить снижение числа В-клеток за счет В1-клеток, В2-клеток и В-клеток памяти (см. табл. 2), а также снижение уровней всех основных классов иммуноглобулинов: IgG – 1,93 г/л, IgM – 0,07 г/л, IgA – 0,07 г/л (референсные значения: 7,0–16,0; 0,4–2,3 и 0,7–4,0 г/л соответственно). В октябре 2017 г. в НИИ медицинской микологии СЗГМУ им. И.И. Мечникова при повторном обследовании сохранялось снижение относительного и абсолютного числа В-лимфоцитов (2,6% – 0,038×109/л при норме от 6,0 до 18,0% и 0,110–0,400×109/л) и уровней иммуноглобулинов (табл. 3).
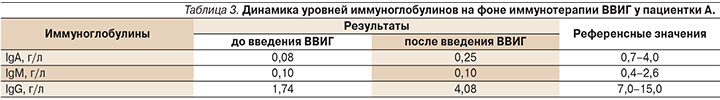
Пациентке поставлен диагноз ОВИН на основании клинико-анамнестических данных (частые респираторные заболевания, лимфадениты с последующим развитием лимфопролиферативного процесса) и данных иммунологического обследования (снижение числа разных субпопуляций В-клеток и гипогаммаглобулинемия). После проведенного лечения внутривенными иммуноглобулинами в стандартной дозе уровни иммуноглобулинов не достигли референсных значений, что также подтверждает диагноз и необходимость регулярной терапии ВВИГ (табл. 3).
Несмотря на затяжные воспалительные заболевания, пациентке никогда не проводили иммунологического обследования до постановки диагноза лимфомы. Между тем в литературе имеются сведения, что первичным проявлением ОВИН могут быть и лимфопролиферативные заболевания [1, 3, 4, 7, 11]. Отмечают, что патогенез данного ПИД может быть обусловлен различными генетическими дефектами.
В экспериментальных исследованиях на трансгенных мышах показано, что бесконтрольная продукция BAFF может приводить к гиперплазии В-клеточных зон лимфоидных органов и спонтанному развитию аутоиммунных процессов [12]. Другой патогенетической причиной лимфопролиферативных заболеваний у больных ОВИН, считают генетический дефект, связанный с ограничением репертуара Т- и В-клеточных антигенраспознающих рецепторов [11]. При этом у больных может быть интерстициальная лимфоидная пролиферация в легких, обусловленная, как считают авторы, повышенным образованием CD8+-цитотоксических Т-клеток с рецепторами, распознающими антиген ЦМВ. Это вызывает поликлональную лимфоидную пролиферацию и воспалительное повреждение, возможно, и в других органах и тканях. Данное предположение трудно подтвердить, однако в единичных источниках имеются описания, соответствущие данным представлениям [11]. К этому следует добавить, что отсутствие специфических антител к вирусам герпеса косвенно может свидетельствовать о сдвиге иммунного ответа в сторону гиперактивной цитотоксической реакции и ингибиции синтеза любых антител, в том числе и специфических к ВЭБ. В представленном клиническом случае дальнейшая терапия могла усугубить состояние иммунной системы, поскольку носила явно иммуносупрессивный характер, в т.ч. и длительная терапия мабтерой. Мабтера относится к группе моноклональных антител к CD20 и нарушает дифференцировку В-клеток в плазматические клетки. Несмотря на то что окончательно происхождение ОВИН не установлено, пациентка нуждается в терапии ВВИГ, которые и были ей назначены ежемесячно под контролем содержания иммуноглобулинов в сыворотке крови.
Заключение
Общая вариабельная иммунологическая недостаточность (ОВИН) – генетический дефект, который маскируется разными клиническими симптомами. Классическими являются частые заболевания дыхательных путей, сначала верхних, а затем нижних отделов с присоединяющимися бактериальными инфекциями. Однако вероятны и другие, более тяжелые, клинические признаки ОВИН, такие как лимфопролиферативные и аутоиммунные заболевания. Верификация диагноза часто бывает поздней, поскольку отсутствует своевременный комплексный анализ анамнестических данных и клинических признаков частых заболеваний у взрослых людей молодого возраста. Клинические анализы крови в этих случаях не дают всей значимой информации.
Наличие хронических, часто рецидивирующих воспалительных заболеваний, не поддающихся традиционным методам лечения, должно стать основанием для иммунологического исследования как у детей, так и у взрослых. Прежде всего необходим скрининг уровней трех основных классов иммуноглобулинов IgА, IgМ, IgG. При стойких изменениях этих показателей необходимо направление пациента к клиническому иммунологу, который принимает решение о назначении адекватной терапии внутривенными иммуноглобулинами с целью предотвращения развития тяжелых хронических гнойно-воспалительных процессов и других осложнений, а также профилактики инвалидизации пациентов с ОВИН.


