Введение
Воспаление – это типовой патологический процесс, распространенный в практической медицине, который развивается в ответ на местное повреждение и характеризуется альтерацией, расстройством микроциркуляции и пролиферацией, в конечном счете направленными на локализацию, уничтожение и удаление повреждающего агента, а также на восстановление поврежденных им тканей. Повреждающими агентами, вызывающими воспаление, весьма часто выступают биологические факторы (в основном инфекционные). К классическим проявлениям воспалительного процесса, вызванного инфекционным агентом, относятся боль, гиперемия, отек и нарушение локальных функций, свойственных многим заболеваниям. Для подавления этих симптомов воспалительного процесса врачи и пациенты прибегают к использованию широкого арсенала лекарственных средств, обладающих различными фармакодинамическими и фармакокинетическими свойствами. Поэтому выбор лекарственного средства требует более тщательного анализа совокупности его фармакологических свойств и характеристик. Такой подход к практической медицине повысит эффективность терапии на всех стадиях острого воспаления и обеспечит фокусное воздействие на ключевые патофизиологические маркеры хронического воспаления.
Кроме того, для повышения эффективности и безопасности местной фармакотерапии инфекционно-воспалительных процессов необходимо учитывать взаимодействие лекарственных средств с различными звеньями местного иммунитета. Это касается иммуностимулирующего влияния препаратов или, наоборот, иммуносупрессирующего. Нарушение функции механизмов местного иммунитета может приводить в дальнейшем к серьезным осложнениям.
Стадии острого воспаления — их клинические проявления
Выделяют три стадии воспалительного процесса: альтерация (повреждение клеток и тканей), расстройства микроциркуляции с экссудацией и эмиграцией лейкоцитов, пролиферация (местное размножение клеток и восстановление целостности ткани). Ключевые признаки этих стадий представлены далее в табл. 1. Эти признаки характерны для наиболее распространенных инфекционно-воспалительных процессов, в частности, в оториноларингологии и гинекологии.
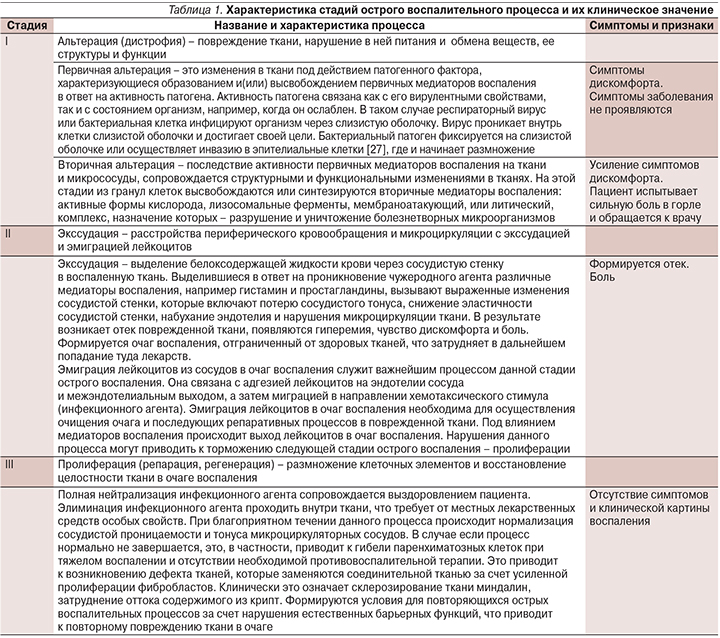
Значение фармакодинамических — фармакокинетических свойств некоторых лекарственных средств при различных стадиях острого воспалительного процесса в оториноларингологии
При лечении инфекционно-воспалительного процесса особое место занимают препараты местного действия. Как правило, это бывают комбинированные препараты, содержащие несколько действующих веществ, которые относятся к разным фармакологическим группам. Однако также встречаются препараты с одним действующим веществом. Для лечения инфекционно-воспалительного процесса в носоглотке используются антисептики, местные антимикробные препараты, анестетики, нестероидные противовоспалительные средства (НПВС), лизаты бактерий и препараты, содержащие лизоцим [1].
В табл. 2 представлены основные патофизиологические проблемы, актуализация которых позволит выделить преимущества отдельных фармакологических групп на разных стадиях острого воспаления.

Таким образом, современная терапия инфекционного воспалительного процесса направлена в первую очередь на блокирование 1-й и 2-й стадий воспаления, ускорение наступления 3-й стадии острого воспаления. Приоритет в этом случае следует отдавать местным противовоспалительным препаратам, а именно НПВС с селективным механизмом действия, имеющим наилучшую совокупность фармакодинамических и фармакокинетических свойств, при этом обладая высоким профилем безопасности.
Помимо контроля медиаторов воспаления важно осуществлять местный медикаментозный контроль персистенции инфекционного агента. Она играет важнейшую роль в развитии затяжного течения острого воспаления и возможной хронизации процесса. Поэтому своевременная элиминация инфекционного агента служит важнейшей задачей при лечении инфекционного воспаления. К сожалению, типичные антисептики для решения данной задачи недостаточно эффективны, несмотря на свой широкий антимикробный спектр. Это связано с особенностью их фармакокинетических свойств – плохой всасываемостью в ткани, где как раз и необходимо создавать нужные тканевые концентрации. Это важнейшее свойство, которым должен обладать препарат, т.к. сам патоген, как правило, находится в центре очага воспаления, который к тому же изолирован из-за нарушения микроциркуляции (при остром воспалении), или клетками хронического воспаления (эпителиоидные клетки, макрофаги). Абсорбция на поверхности слизистой оболочки, характерная для антисептических и местных антимикробных препаратов, создает там терапевтические концентрации препаратов, что может подавлять некоторые естественные барьерные функции, например баланс нормальных микробных ассоциаций, ограничивающих распространение высоковирулентных патогенов. Эта барьерная функция свойственна как хорошо изученным Lactobacillus spp., так и некоторым другим представителям грамположительной флоры. Например, Streptococcus mitis, представитель нормальной микрофлоры, стимулирует местную иммунную систему к выработке иммуноглобулин A-подобных веществ, нейтрализующих Streptococcus pneumoniae, наиболее распространенного респираторного возбудителя [1, 2]. Аналогичные защитные свойства демонстрирует и Staphylococcus epidermidis в нормальных концентрациях, в которых он не проявляет вирулентных свойств, а наоборот, препятствует формированию биопленок со стороны более опасного Staphylococcus aureus. К тому же он подавляет активность вируса гриппа А. Таким образом, нарушение баланса нормальных микробных ассоциаций может негативно влиять на местный иммунный статус пациента, осложняя течение инфекционного процесса [3, 4].
Оптимальной совокупностью фармакодинамических и фармакокинетических свойств обладает бензидамина гидрохлорид (бензидамин) [5]. С одной стороны, блокируя синтез и дальнейшее выделение медиаторов воспаления, этот препарат тормозит развитие осложнений на всех стадиях воспаления. С другой стороны, за счет последовательного воздействия на воспаление бензидамин облегчает собственное поступление в очаг воспаления, где формирует необходимую концентрацию, достаточную для развития бактерицидного эффекта и предупреждения дальнейших хронических инфекционно-воспалительных осложнений.
Способность бензидамина подавлять продукцию интерлейкина-1 и других цитокинов в зоне воспаления снижает экспрессию молекул адгезии на эндотелиоцитах и ослабляет другие провоспалительные цитокин-индуцированные эффекты, что существенно усиливает его противовоспалительное действие [5]. Клинически это может означать сокращение длительности острого воспалительного процесса и наступление фазы восстановления.
Свойства бензидамина, проявляющиеся при остром воспалении:
- Особенности метаболизма и выделения: высокая проницаемость в воспаленные ткани, отсутствие связи с белками крови, неактивные метаболиты, низкая способность к межлекарственному взаимодействию и системным побочным эффектам [5].
- Концентрации в тканях, соответствующие терапевтическим: тканевые концентрации бензидамина во влагалище на фоне фармакотерапии соответствуют концентрации, необходимой для противовоспалительной активности [5, 6].
- Антимикробное действие: широкие антибактериальный и противогрибковый спектры, включая воздействие как на планктонные клетки микроорганизмов, так и на микроорганизмы под зрелыми биопленками [5].
- Противовоспалительное действие (данные получены на животных, клинические данные): влияние на конечный метаболизм арахидоновой кислоты, а также простагландины, влияние на уровни цитокинов [5].
- Особое значение имеет двойной обезболивающий механизм действия бензидамина. Частично молекула демонстрирует местные анестезирующие свойства за счет входящего фрагмента местного анестетика, а также имеет противовоспалительное действие, умеренно подавляя синтез простагландинов и провоспалительных цитокинов [5].
Свойства бензидамина, проявляющиеся при хроническом воспалении:
- Сочетание противовоспалительного и антимикробного действий обеспечивает эффективную элиминацию инфекционного агента непосредственно в очаге воспаления, а не только на поверхности слизистой оболочки.
- Способность подавлять синтез ИЛ-1 и ФНО-α препятствует излишнему вовлечению в воспалительный процесс моноцитов/макрофагов и других клеток хронического воспаления. Важно отметить, что моноциты/макрофаги не только являются самыми эффективными фагоцитами, но и выполняют секреторную функцию, состоящую в синтезе и выделении ферментов (кислые гидролазы и нейтральные протеиназы), компонентов комплемента, ингибиторов ферментов, компонентов межклеточного матрикса, биологически активных липидов (простагландинов и лейкотриенов), т.е. соединений, способствующих поддержанию процесса воспаления.
- Стимулятором воспаления могут выступать не только живые микробные клетки, требующие антимикробного действия местных препаратов, но и фрагменты их клеточной стенки, которые являются провоцирующим фактором для провоспалительных систем организма (Toll-likeрецепторы; например, TLR-4 взаимодействует с липополисахаридом микроорганизмов).
- При замещении нейтрофилов, характерных для острого воспаления, мононуклеарными клетками (лимфоциты–моноциты) происходит переход воспалительного процесса в хроническое течение. Соответственно, высокие местные уровни ФНО-α, ИЛ-1 способствуют переходу острого процесса в хронический, а также при наличии хронического воспалительного процесса – появлению дополнительных осложнений за счет превращения макрофагов в эпителиоидные клетки, а также их слиянию в гигантские многоядерные клетки, присутствие которых характерно для многих очагов хронического воспаления.
- Фрагменты клеточной стенки уже нейтрализованного микроорганизма могут приводить к привлечению мононуклеарных клеток в очаг воспаления, активации макрофагов и лимфоцитов в очагах хронического воспаления, к развитию процессов антигенной презентации и активации лимфоцитов, где ключевую роль играет ИЛ-1. Соответственно, большое значение имеет снижение уровня местного ИЛ-1 для прерывания хронического воспалительного процесса.
Патогенетическое обоснование применения бензидамина при хроническом воспалении в оториноларингологии
- Препарат обладает широким спектром антимикробного действия, воздействуя на 110 штаммов бактериальных и грибковых микроорганизмов [7]. В том числе препарат влияет на планктонные клетки широкого спектра микроорганизмов, а также на сформированные ими как растущие, так и зрелые биопленки [8]. За счет своих физико-химических свойств бензидамин способен проникать в ткани миндалин и крипты, оказывая действие непосредственно в очаге воспаления в отличие от «классических» антисептиков.
- Бензидамин, относящийся к НПВС селективного действия, в отличие от классических НПВС обладает высоким профилем безопасности, в связи с чем он не имеет системных побочных эффектов, факторов межлекарственного взаимодействия (метаболиты в крови не активны, не связываются с белками крови), а также у него отсутствуют ограничения по длительности применения более 3 дней.
- За счет ингибирования синтеза провоспалительных цитокинов (ФНО-α и ИЛ-1) препарат способствует снижению инфильтрации миндалин лейкоцитами. Медиаторы воспаления вызывают синтез молекул адгезии на поверхности эндотелиальных клеток в зоне воспаления, что вызывает прикрепление лейкоцитов к сосудистой стенке с их последующим выходом в очаг воспаления. Активированные лейкоциты способствуют повреждению окружающих нормальных тканей, которые замещаются соединительной тканью.
- Снижая продукцию цитокинов, бензидамин тормозит чрезмерный выход лейкоцитов в очаг воспаления, тем самым уменьшая развитие отека и других признаков воспаления, что создает ограничения микроциркуляции и адекватную трофику тканей. Клинически это означает восстановление нормального оттока из устья или просветов лакун, стенозированных ранее. При запущенном хроническом процессе в результате рубцевания устья лакун часто становятся непроходимыми, лакуны не опоражняются и растягиваются накапливающимся содержимым, превращаясь в закрытые очаги инфекции, поддерживающие воспалительный процесс.
Патогенетическое обоснование применения бензидамина при остром воспалительном процессе в гинекологии
Вульвовагинит и бактериальный вагиноз – это распространенные инфекционно-воспалительные заболевания в гинекологической практике. В лечении таких пациенток ведущее место занимают препараты местного действия, обеспечивающие повышение эффективности терапии при высоком профиле безопасности.
При воспалительных заболеваниях вульвы и влагалища отмечается повышение синтеза ФНО-α и ИЛ-1, в т.ч. у беременных пациенток [8–11]. Повышенный цитокиновый фон, высокая активность Gardnerella vaginalis на фоне дополнительной супрессии нормальной микрофлоры влагалища антисептиками могут провоцировать быструю гибель нормальных клеток слизистой оболочки в зоне воспаления в результате процесса пироптоза [12, 13].
На фоне повышения местной продукции ИЛ-1 оставшиеся колонии лактобактерий дополнительно супрессируются и перестают образовывать перекись водорода (H2O2), таким образом изменяется рН среды влагалища, ограничивается возможность лактобактерий тормозить рост G. vaginalis и прочих микроорганизмов [–17]. Данный процесс представлен схематично на рисунке.
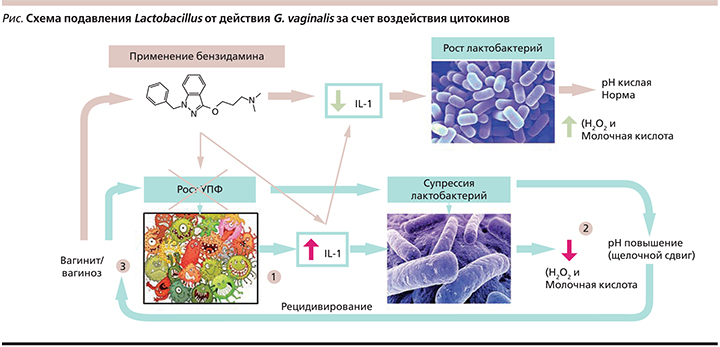
Таким образом, на основании современного представления о роли элементов воспаления в развитии бактериального вагиноза ключевым фактором местной медикаментозной терапии становится наличие у лекарственного средства селективного противовоспалительного действия в сочетании с антимикробным эффектом.
Исходя из представленных на отечественном фармацевтическом рынке действующих веществ и их комбинаций в готовых лекарственных формах, особое внимание занимает бензидамин, обладающий следующими свойствами:
- Бензидамин обладает широким антимикробным спектром [7], при этом концентрации в готовой лекарственной форме препарата превышают МПК (минимальная подавляющая концентрация) для возбудителей в 2–5 раз. Важно отметить, что стойкое антимикробное действие наступает через 2,5 минуты после контакта бензидамина с патогеном во влагалище, а контроль роста показывает его отсутствие через 30 минут после контакта с микроорганизмом, т.е. когда препарата уже нет во влагалище [18].
- Бензидамин в отличие от классических НПВС обладает высоким профилем безопасности. За счет этого он не имеет системных побочных эффектов, факторов межлекарственного взаимодействия (метаболиты в крови неактивны, не связываются с белками крови) и разрешен к применению с 0 лет и беременными (гинекологические лекарственные формы).
- За счет блокады синтеза провоспалительных цитокинов ИЛ-1 и ФНО-α [5] препарат снижает местные проявления воспаления, тормозит образование инфламмосом, которые и формируют хроническое воспаление, сопровождающееся пироптозом – процессом, стимулированным патогеном и запущенным ИЛ-1. Тем самым соблюдается основное условие восстановления организма – успешное завершение острой стадии воспаления.
- За счет селективного подавления синтеза ИЛ-1 бензидамин выключает ключевое супрессивное звено, действующее на синтез Н2О2 лактобактериями. При этом бензидамин имеет уникальное свойство изменять свою антимикробную активность при изменении рН. Со снижением уровня ИЛ-1 и концентрации патогенов на фоне антимикробного действия бензидамина лактобактерии из неактивного состояния начинают восстанавливать свои функции, что приводит к изменению рН в сторону кислой среды (около 5 рН). На фоне нормализации рН и отсутствия патогенной микрофлоры бензидамин снижает свою антимикробную активность, никак не ограничивая рост лактобактерий, но при этом в случае появления патогенной флоры, которая повышает рН, его антимикробная активность обратно увеличивается [17]. Кроме того, отмечено, что минимальная ингибирующая концентрация бензидамина по отношению к некоторым лактобактериям составляет около 20 тыс. мкг/мл, что в 20 раз превышает терапевтическую концентрацию гинекологического раствора [8].
- Важнейшим фактором эффективной антимикробной терапии служит приверженность пациента. Наличие беспокоящих пациента симптомов зачастую заставляет его отказаться от назначенного лечения и сделать ложный вывод о его неэффективности. Применение бензидамина в комбинации со свечами показало, что пациентки не отказывались от лечения и полностью следовали назначениям врача. В группе монотерапии свечами отмечался высокий процент пациентов, отказавшихся от лечения или не прошедших курс полностью. Это объясняется способностью бензидамина снижать выраженность всех симптомов дискомфорта уже через 20 минут после первого применения по сравнению со свечами, дающими удовлетворенность пациенткам только к 1–2-м суткам лечения. Данные продемонстрированы в ряде отечественных и зарубежных исследований, в т.ч. и в послеродовом периоде [19–21].
Таким образом, бензидамин применяют для быстрого снятия симптомов бактериального вагинита (3–5-дневный курс), что повышает приверженность лечению.
Влияние препаратов для местного применения на лейкоциты человека при инфекционно-воспалительных заболеваниях
Важнейшим свойством подобных препаратов помимо широкого антимикробного и противовоспалительного действий служит их влияние на клетки врожденного и адаптивного иммунитета в зоне воспаления. Однако в имеющейся литературе информации по вопросу влияния местных антимикробных препаратов на эти клетки мы не обнаружили.
Среди клеток, обеспечивающих защиту организма в зоне воспаления, большое значение имеют лимфоциты и нейтрофилы. Нейтрофилы являются классическими фагоцитами, а лимфоциты – главные клетки иммунной системы. Повреждение этих клеток в зоне воспаления лекарственными препаратами может существенно ослабить резистентность тканей к внедрению инфекционных агентов. Для изучения влияния местных антисептических препаратов на клетки врожденного и адаптивного иммунитета была проведена экспериментальная работа, в которой изучалось воздействие бензидамина и бензилдиметил аммония хлорида моногидрата в виде готового лекарственного препарата на жизнеспособность лимфоцитов периферической крови человека методом исключения трипанового синего при крат-ковременной инкубации. Результаты представлены в табл. 3.

В контроле гибель лимфоцитов составила не более 2,5%, аналогичные показатели были получены и для низких концентраций бензидамина. В высокой концентрации (неразведенный рабочий раствор) бензидамин вызывал гибель 5% мононуклеарных клеток. А для бензилдиметил аммония хлорида моногидрата этот показатель составил 25%, или четвертую часть всех лимфоцитов.
Таким образом, бензидамин в рабочей концентрации не оказывал токсического влияния на лимфоциты периферической крови в отличие от бензилдиметил аммония хлорида моногидрата, вызвавшего гибель 25% лимфоцитов.
Во второй серии экспериментов, изучалось воздействие бензидамина в виде готового лекарственного препарата (0,15%) на нейтрофилы здоровых людей и пациентов с воспалительным процессом в брюшной стенке. В эксперименте использовались те же контрольные исследования. Определяли функциональное состояние кислородзависимого механизма бактерицидности нейтрофилов (тест с нитросиним тетразолием – НСТ-тест). Исследования с нейтрофилами крови здоровых людей показали, что исходное число НСТ-позитивных нейтрофилов в крови у здоровых людей составляло 6,05±0,51%. Такой уровень НСТ-позитивных нейтрофилов характерен для подострого процесса или хронического воспалительного процесса. После добавления к исходному уровню НСТ-позитивных нейтрофилов бензилдиметил аммония хлорида моногидрата 0,01% их число увеличилось до 14,21±1,72%. А при добавлении бензидамина отмечено их снижение с 6,05±0,51% до уровня 1,74±0,45%.
Увеличение числа НСТ-положительных нейтрофилов в контроле 2 может быть объяснено увеличением активности NADPH-оксидазной системы и активной генерации супероксиданион-радикала (O2), активной формы кислорода (АФК), которые в свою очередь связаны с повреждением не только патогенов, но и здоровой ткани. Под влиянием бензидамина происходил обратный эффект: число НСТположительных нейтрофилов снижалось, что указывает на торможение NADPH-оксидазной системы нейтрофилов у здоровых доноров и предотвращение поражения здоровых тканей (липидов, белков и нуклеотидов ткани). Снижение числа НСТ-положительных нейтрофилов крайне важно при хроническом воспалительном процессе. Постоянная генерация АФК приводит к нарушениям структуры и качеству нормальной ткани, что затрудняет микроциркуляцию и нормальную функцию местного иммунитета. В конечном итоге это приводит к осложненному и постоянно персистирующему процессу.
Для оценки влияния препарата бензидамин на НСТ-положительные нейтрофилы при остром воспалительном процессе была использована кровь пациентов с абсцессом в брюшной полости. В контроле число НСТ-положительных нейтрофилов составляло 41,78±2,00%. Под влиянием бензилдиметил аммония хлорида моногидрата количество нейтрофилов, активированных воспалением, снизилось до 19,43±1,09%, под влиянием бензидамина количество нейтрофилов, активированных воспалением, снизилось идентично – до 20,22±0,97%.
Однако, несмотря на идентичность количественного снижения уровня нейтрофилов под влиянием бензилдиметил аммония хлорида моногидрата и бензидамина, качественная характеристика этого процесса у двух препаратов была разной. Под действием бензилдиметил аммония хлорида моногидрата сокращение нейтрофилов связано исключительно с ингибированием NADPH-оксидазной системы, что снижало их активность, но не влияло на уровень АФК, а также не стимулировало процесс дегрануляции, т.е. высвобождения необходимых антимикробных ферментов нейтрофилов, разрушающих инфекционные агенты. К этим ферментам относятся миелопероксидаза, лактоферрин, антимикробные катионные пептиды (дефенсины, кателицидины) и др.
Бензидамин же, наоборот, значимо не влиял на NADPH-оксидазную систему, а стимулировал нейтрофилы к дегрануляции и усилению естественного антимикробного действия нейтрофилов, важнейших клеток иммунной системы. Такой вывод подтверждается на основании изучения микропрепаратов нейтрофилов, предварительно инкубированных с бензидамином и содержащих массу клеточного детрита. Этот внеклеточный материал как раз и представляет собой остатки нейтрофилов после их дегрануляции.
Выводы
Высокая эффективность препаратов местного действия для лечения местных инфекционно-воспалительных заболеваний может быть достигнута при их соответствии следующим требованиям:
- Сочетание антисептических и противовоспалительных свойств.
- Максимальная устойчивость к влиянию механизмов резистентности микроорганизмов.
- Способность проникать в очаг воспаления в необходимых концентрациях.
- Способность активировать звенья местного иммунитета.
По совокупности известных свойств бензидамина данный препарат воздействует на все стадии острого инфекционно-воспалительного процесса, обладает иммуногенными свойствами за счет одновременной стимуляции местного иммунитета, при этом повреждая лимфоциты, а также имеет высокую способность проникать в ткани, охваченные различными воспалительными процессами.


