Введение
В настоящее время антиангиогенная терапия прочно вошла в схемы лечения больных метастатическим раком толстой кишки (МРТК). Именно при данной нозологии бевацизумаб (моноклональное антитело к VEGF) первым из антиангиогенных препаратов вошел в клиническую практику. По результатам рандомизированного исследования III фазы (AVF2107), добавление бевацизумаба к режиму IFL (иринотекан, лейковорин, фторурацил) значимо улучшало выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) больных МРТК в первой линии терапии. Медиана ВБП составила 10,6 против 6,2 месяца в группе IFL, ОВ – 23 и 15,3 месяца соответственно. При этом частота объективных эффектов значимо между группами не различалась: 44,8 и 34,8% [1]. В дальнейшем проведен ряд исследований, подтвердивших эффективность препарата в комбинации с химиотерапией.
Мета-анализ исследований, посвященный применению бевацизумаба при МРТК, показал снижение риска прогрессирования болезни на 34% (относительный риск [ОР]=0,66 (95% доверительный интервал [ДИ] – 0,55–0,77; р<0,0001), риска смерти – на 16% (ОР=0,84 (95% ДИ – 0,77–0,92, р=0,0001) при назначении бевацизумаба с химиотерапией [2].
В 2015 г. в РФ зарегистрирован биоаналог бевацизумаба, произведенный фармацевтической фирмой «Биокад». В соответствии с Правилами регистрации биоаналогов достаточно было доказать фармакокинетическую и клиническую эквивалентность оригинальному моноклональному антителу на одной нозологии и регистрация биоаналога расширялась на все нозологии, при которых зарегистрирован оригинальный препарат. В исследовании по изучению эквивалентности двух моноклональных антител включены пациенты только с метастатическим раком легкого. Всего, критериям включения соответствовало 138 больных [3]. Таким образом, у онкологов мало данных по эффективности биоаналога бевацизумаба при МРТК.
Цель: изучения эффективности и переносимости комбинации химиотерапии и биоаналога бевацизумаба фирмы «Биокад» больными МРТК.
Методы
Нами проведен ретроспективный анализ проспективно ведущейся базы пациентов с МРТК отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. С учетом небольшого опыта лечения биоаналогом в нашем отделении решено провести описание серии клинических наблюдений. Статистическая гипотеза не предполагалась. Статистический анализ представлен методами описательной статистики. В качестве основного критерия эффективности взята ВБП, которая рассчитывалась с момента начала терапии соответствующей линии с включением бевацизумаба до даты прогрессирования или смерти от любой причины или даты последнего наблюдения. Ситуации, когда у пациента не было зарегистрировано прогрессирования заболевания или смерти на момент даты последнего наблюдения рассматривались как цензурированные события. ОВ рассчитывалась с момента начала терапии соответствующей линии терапии с включением бевацизумаба до даты смерти от любой причины или даты последнего наблюдения. Ситуации, когда у пациента не была зарегистрирована смерть на момент даты последнего наблюдения, рассматривались как цензурированные события. Выживаемость рассчитывалась по методу Каплана–Майера.
Результаты
В базе отделения идентифицированы 13 больных МРТК, которым в 2017–2018 гг. проведена терапия с включением биоаналога бевацизумаба. Характеристика пациентов представлена в табл. 1.
Из табл. 1 следуют некоторые особенности нашей популяции пациентов: 84,6% проведена адъювантная терапия в анамнезе, у 15,4% выявлена мутация в гене BRAF, локализация первичной опухоли в правых отделах толстой кишки – у 46,2% больных. Чаще биоаналог бевацизумаба добавлялся к химиотерапии первой линии и преимущественно к оксалиплатин-содержащими режимам.
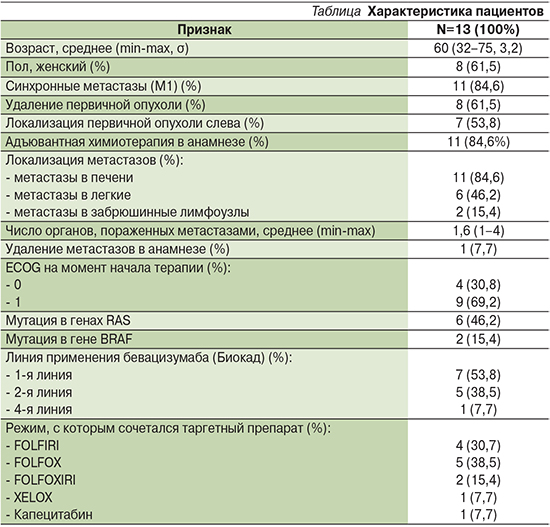
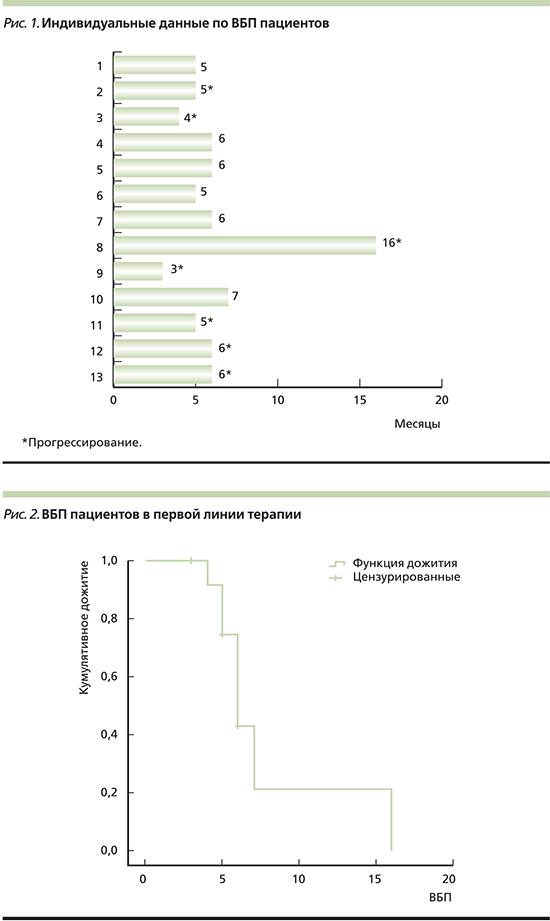
С учетом небольшого числа пациентов применение биоаналога в различных линиях лечения на рис. 1 представлены индивидуальные данные ВБП. ВБП больных в первой линии терапии представлена на рис. 2, при этом медиана ВБП составила 6 месяцев (95% ДИ – 5–7). Медиана наблюдения за пациентами составила всего 6 месяцев, поэтому медиана продолжительности жизни пациентов еще не достигнута.
Токсичность, ассоциированная с применением бевацизумаба, была ограничена только артериальной гипертензией. Последняя зарегистрирована у четырех пациентов, из них только у одного – 3-й степени. Других характерных для терапии антиангиогенными препаратами осложнений, включая кровотечения, тромбозы, протеинурию и т.п., мы не наблюдали.
Обсуждение
Мы можем сказать о положительном опыте применения биоаналога фирмы «Биокад» в сочетании с химиотерапией в отношении переносимости лечения. Тем не менее при оценке индивидуальных показателей выживаемости и ВБП в первой линии необходимо помнить не только о небольшом количестве пациентов, но и о преобладании в нашей популяции больных с такими неблагоприятными прогностическими факторами, как адъювантная терапия в анамнезе, мутация в гене BRAF, локализация первичной опухоли в правых отделах толстой кишки. Принимая во внимание особенности нашей популяций больных, результаты терапии комбинацией химиотерапии и биоаналога бевацизумаба соотносятся с результатами лечения больных комбинацией химиотерапии с оригинальным моноклональным антителом.
Химиотерапевтам необходимо помнить о некоторых особенностях назначения антиангиогенной терапии в первой линии лечения больных МРТК. Возможно назначение бевацизумаба с любым химиотерапевтическим режимом, применяемым при раке толстой кишки (FOLFOX, XELOX, FLOX, FOLFIRI, FOLFOXIRI, XELIRI, IFL, иринотекан в монорежиме и фторпиримидины в монорежиме). При этом, по результатам рандомизированного исследования AIO0604, не выявлено преимуществ назначения бевацизумаба с иринотекан- или оксалиплатин-содержащими режимами как по частоте объективных эффектов, так и в отношении показателей выживаемости [4].
По сравнению с анти-EGFR-антителами бевацизумаб не работает в монорежиме, это хорошо иллюстрируют результаты лечения больных во второй линии терапии в исследовании E3200, в котором монотерапия бевацизумабом привела к развитию объективных ответов у 3%, медиана ВБП составила всего 2,7 месяца [5]. Это полностью соотносится с теорией, согласно которой противоопухолевое воздействие антиангиогенной терапии происходит за счет нормализации сосудистого русла в опухоли и улучшения проникновения химиопрепаратов к опухолевым клеткам [6].
В отсутствие прогрессирования после 16–24 недель первой линии терапии пациентов переводят на поддерживающую терапию комбинацией фторпиримидинов и бевацизумаба, если бевацизумаб назначался и на индукционном этапе. В то же время необходимо помнить, что все рандомизированные исследования, посвященные данной клинической ситуации, содержали один большой недостаток – отсутствие контрольной группы пациентов, которым проводилась терапия фторпиримидинами в монорежиме. При этом в исследовании PRODIGE9 доказано отсутствие улучшения как медианы ВБП, так и ОВ при поддерживающей монотерапии бевацизумабом по сравнению с наблюдением: 9,2 месяца против 8,9 и 21,7 месяца против 22 соответственно [7].
Если мы говорим о первой линии терапии, следует напомнить, что добавление бевацизумаба к химиотерапии эффективно независимо от наличия мутации в генах KRAS и NRAS [8] и приводит к наибольшим показателям выживаемости при локализации первичной опухоли в правых отделах толстой кишки в отличие от комбинации химиотерапии с анти-EGFR антителами. Последние работают только при диком типе генов и наиболее эффективны при локализации первичной опухоли в левых отделах толстой кишки [9].
Если пациентам в первой линии назначался бевацизумаб, то наиболее эффективной опцией во второй линии будет смена химиотерапевтического режима и продолжение антиангиогенной терапии, нежели переход на комбинацию химиопрепаратов с анти-EGFR-антителами. К такому выводу пришли авторы исследования Prodige 18-UNICANCER GI, в котором пациенты после прогрессирования на комбинации бевацизумаба с любым режимом химиотерапии в первой линии в дальнейшем получали альтернативный режим химиотерапии с продолжением терапии бевацизумабом или с цетуксимабом. В исследование были включены 130 больных с диким типом гена KRAS. Медианы выживаемости без прогрессирования и продолжительности жизни были выше в группе пациентов, продолжавших терапию бевацизумабом, по сравнению с пациентами, кому назначали во второй линии цетуксимаб: 7,1 против 5,6 месяца (ОР=1,43; р=0,06) и 15,9 против 10,6 месяца (ОР = 1,44; р=0,08) [9].
Заключение
Делясь нашим опытом, мы понимаем его ограниченность: при недостаточной медиане наблюдения и применении биоаналога бевацизумаба с различными режимами и в различных линиях невозможно высказаться о реальной выживаемости больных. Невозможно сравнить эффективность и токсичность биоаналога бевацизумаба и оригинального моноклонального антитела.
Все это привело нас к мысли о необходимости проведения более масштабного популяционного исследования по сравнению эффективности биоаналога бевацизумаба и оригинального моноклонального антитела в рутинной клинической практике в РФ, предварительные данные которого будут представлены на Российском онкологическом конгрессе в ноябре 2018 г.


