Введение
Урогенитальный хламидиоз (УХ) относится к наиболее распространенным инфекциям, передаваемых половым путем (ИППП), поражающим мужчин, женщин и детей, включая новорожденных, негативно влияет на репродуктивное здоровье, служит частой причиной бесплодия и имеет важное медицинское и социально-экономическое значение. По оценке Всемирной организации здравоохранения, в мире ежегодно регистрируется около 100 млн новых случаев УХ. При этом частота УХ недооценивается в связи с мало- и бессимптомностью течения, а также в связи со сложностью выявления этой инфекции, тем самым создается резервуар для ее дальнейшего распространения [1]. Лечение УХ, который, как правило, выявляется в хронической стадии и поэтому практически всегда является осложненным, недостаточно эффективным. К хронической инфекции может приводить неадекватная терапия свежей (существующей до 2 месяцев) инфекции.
Диагностика свежего УХ не представляет трудностей и проводится молекулярно-биологическими методами: полимеразной цепной реакцией (ПЦР), амплификацией молекул рибосомальной РНК (NASBA), занимающими лидирующее место среди прямых методов выявления возбудителя вследствие высокой чувствительности и специфичности (80–100%). Сложность в диагностике обусловленных УХ хронических осложненных мочеполовых поражений связана как с топическими особенностями таких поражений, так и с выявлением Chlamydia trachomatis. При этом интерпретация результатов лабораторных исследований требует от врача максимального внимания, грамотного и осмысленного подхода к их оценке [2].
Диагностика хронического УХ сложна в связи с его бессимптомным течением, а также высокой частотой ложноотрицательных результатов молекулярно-биологических тестов, в т.ч. вследствие недоступной локализации возбудителя при восходящей инфекции. Однако отрицательный результат такой диагностики не должен расцениваться врачом как свидетельствующий об отсутствии хламидийной инфекции. И в таких случаях предпочтение отдается косвенным серологическим тестам. Исследования на определение специфических антител к родоспецифическому липополисахаридному (ЛПС) антигену хламидий (Ch. рsittaci, Ch. рneumoniae, Ch. trachomatis) позволяют установить инфицированность этими разновидностями хламидий: они появляются в крови раньше, чем к белковому антигену, и снижаются быстрее [3]. В то же время этот тест не дает информации о том, каким видом хламидий вызвано настоящее заболевание.
Видоспецифическое серологическое исследование проводится с определением титра антител классов IgG и IgA к C. trachomatis. Обнаружение антител классов IgG и IgA одновременно в крови обследуемого свидетельствует об активной фазе инфекционного процесса [4]. Наличие антител класса IgG свидетельствует о ранее перенесенной или протекающей в данный момент инфекции. Выявление антихламидийных антител класса IgA – более информативный тест для диагностики свежего воспалительного процесса [5, 6].
Определение антител класса IgG к белку теплового шока Ch. trachomatis (БТШ-60) характеризует персистирующее течение хламидиоза. Появление антител к HSP-60 Ch. trachomatis приводит к тому, что иммунный ответ на другие антигены, в частности на наружный мембранный антиген (major outer membrane protein, МОМР) и ЛПС, снижается, но продолжается синтез антител к БТШ-60 хламидий. Возможно, иммунный ответ на БТШ-60 хламидий устраняет толерантность организма к собственным БТШ, что приводит к развитию аутоиммунных реакций [7].
Секреторные IgA к Ch. trachomatis служат результатом местного иммунного ответа на уровне слизистых оболочек, они появляются сначала в семенной плазме или вагинальном отделяемом и являются маркером местного воспалительного процесса [8]. Семенная плазма является предпочтительным образцом для диагностики бессимптомной хламидийной инфекции у мужчин. Эти исследования приобретают особое значение при отрицательных результатах обследования на хламидии методами молекулярной биологии [9] и имеют важное значение для выявления хламидийного простатита [10].
Целью настоящего исследования стала оценка использования комплекса серологических исследований для определения противохламидийных антител у больных хроническим простатитом.
Методы
За период с 2015 по 2018 г. в Щелковском кожно-венерологическом диспансере (Московская область) нами были обследованы 39 пациентов с диагнозом «хронический простатит».
Клиническое обследование включило сбор анамнеза, осмотр мочеполовых органов (включая пальцевое исследование предстательной железы, семенных пузырьков, куперовых желез и т.д.). Инструментальное обследование – сухую тотальную уретроскопию, а также ультразвуковое исследование предстательной железы и семенных пузырьков проводили в отделении дерматологии и дерматоонкологии МОНИКИ.
Все пациенты подверглись молекулярно-биологическому (полимеразная цепная реакция [ПЦР] в реальном времени) исследованию материала из уретры на уретрогенные ИППП. Комплексное серологическое исследование проведено в клиническом диагностическом Центре института эпидемиологии и микробиологии им. Г.Н. Габричевского с использованием метода иммуноферментного анализа (ИФА) в четырех тест-системах фирмы Medac (Германия): к родоспецифическому ЛПС хламидий, основному белку наружной мембраны МОМР Ch. trachomatis, БТШ-60 Ch. trachomatis, секреторного IgA в семенной плазме. Всего проведено 273 исследования в 4 тест-системах ИФА.
Положительным результатом считались титры антител к родоспецифическому ЛПС хламидий: IgM ≥1:50, IgG ≥1:100, IgA ≥1:50; к МОМР Ch. trachomatis: IgG ≥1:50, IgA ≥1:50; к БТШ-60 Ch. trachomatis IgG ≥1:50; секреторного IgA в семенной плазме ОП >Cut off, где ОП – оптическая плотность, полученная при тестировании исследуемого образца, cut off – граничное значение (средняя ОП отрицательных контролей +0,05). Использование четырех тест-систем считали обоснованным, поскольку каждая имела свою диагностическую значимость.
Результаты
Как видно из табл. 1, у 13 (33,3%) пациентов хламидийная инфекция не была выявлена и методом ПЦР, и ИФА, у 26 (66,7%) она была диагностирована методом ПЦР или серологически, при этом у 6 (23,1%) пациентов Ch. trachomatis методом ПЦР были выявлены, у 20 (76,9%) не были выявлены. Сыворотки 20 пациентов с отрицательным результатом ПЦР были исследованы в тест-системе ИФА с определением специфических ЛПС антител к роду хламидий, позволяющей определить инфицированность хламидиями. При этом 5 (25%) больных оказались серонегативными, у 1 (5%) были выявлены антитела классов IgM; антитела классов IgG и/или IgA определены у 14 (70%) пациентов.

Выявление антител классов IgM и IgA свидетельствовало об активной хламидийной инфекции, IgG, IgA – о хронической активной инфекции и только IgG – о перенесенной ранее инфекции (табл. 2, 3).
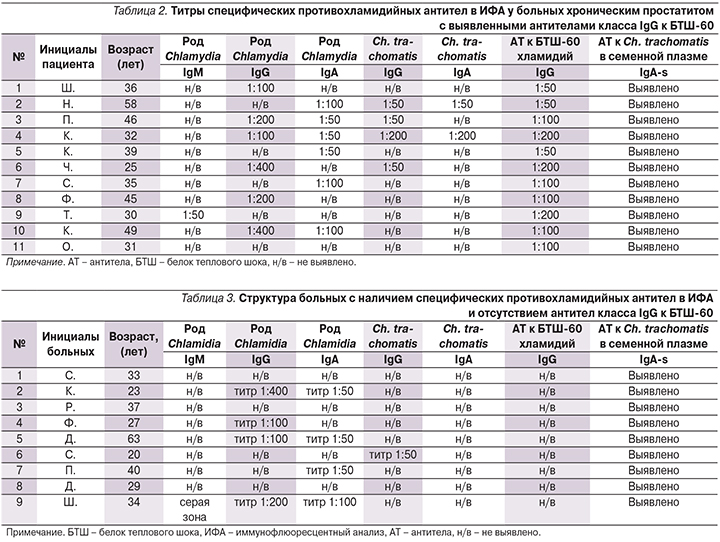
Проведение видовой диагностики 20 пациентов с определением антител IgG, IgA к Ch. trachomatis позволило выявить лишь 2 (10%) пациентов с антителами классов IgG и IgA (IgG 1:50 и IgA 1:50; и IgG 1:200 и IgA 1:200), 3 (15%) пациентов с IgG (IgG у всех четырех в титре 1:50), у 15 (75%) пациентов специфические антитела не выявлены (серонегативные пациенты). При этом к роду хламидий лишь 5 (25%) пациентов были серонегативными, у остальных определены антитела в разных сочетаниях.
Обследование 20 пациентов на антитела класса IgG к БТШ-60 выявило их наличие в 11 (55%) случаях (титр варьировался от 1:50 до 1:200), в 9 (45%) они отсутствовали (табл. 2, 3). Секреторные IgA к Ch. trachomatis в семенной плазме присутствовали у каждого из 20 пациентов, причем их обнаружение у 11 (55%) с наличием антител к БТШ-60 указывало на персистирующую хламидийную инфекцию с местным воспалительным процессом в предстательной железе. У 9 (45%) пациентов антитела класса IgG к БТШ-60 Ch. trachomatis не были выявлены, но при этом у каждого из них определены секреторные IgA к Ch. trachomatis, что свидетельствовало о местном воспалительном процессе, специфические же антитела IgG к Ch. trachomatis выявлены у одного пациента в титре 1:50, у 8 они отсутствовали.
Обсуждение
Таким образом, при обследовании 20 пациентов с отрицательным результатом ПЦР УХ был выявлен при использовании метода ИФА, причем у 11 он был диагностирован при использовании двух серологических исследований – IgG к БТШ-60 Ch. trachomatis и секреторных IgA в семенной плазме (табл. 2). Если бы диагностика проводилась с использованием только серологических исследований, позволяющих определять IgG, IgA к Ch. trachomatis, то специфические антитела были бы выявлены у 4 (36,4%) больных, у 7 (63,6%) оставшихся серонегативными пациентов хламидийная инфекция была бы отвергнута. Кроме того, у 2 серопозитивных пациентов (IgG 1:50 и IgA 1:50, у другого IgG 1:200 и IgA 1:200) определялись антитела классов как IgG, так и IgA к Ch. trachomatis, что позволяло предположить активно протекающую инфекцию. Еще у двух выявлены только антитела класса IgG, причем в низких титрах – 1:50, антитела класса IgА не были выявлены. Это часто расценивается врачами как результат перенесенной инфекции, и хламидийная этиология заболевания отвергается. Поэтому при наличии в анамнезе УХ обследования нужно проводить с использованием большего спектра направленных на выявление УХ серологических реакций.
Важным в выявлении персистирующей хламидийной инфекции у 11 пациентов стало определение наряду с антителами класса IgG к БТШ-60 Ch. trachomatis секреторных IgA к Ch. trachomatis в семенной плазме. При этом у четырех пациентов отсутствовали сывороточные антитела классов IgG и IgA к Ch. trachomatis. Полученные данные не противоречат таковым зарубежных авторов о корреляции повышения уровня IgA Ch. trachomatis в семенной плазме с повышением титра антител БТШ-60 Ch. trachomatis в сыворотке крови [11]. Иммунный ответ на БТШ-60 очень важен для развития хронического негонококкового уретрита. Предполагается, что хронический НГУ – это не закономерное продолжение персистенции хламидий в уретре, а аутоиммунное заболевание, спровоцированное первичным присутствием этой инфекции, и для его дальнейшего развития не требуется наличия самого микробного агента [12].
Результаты проведенных нами исследований не только подтверждают предположение о важной роли Ch. trachomatis в развитии хронического простатита, но и о необходимости для исключения хламидийной природы простатита использования целого спектра серологических исследований, включая определение IgA семенной плазмы и IgG БТШ-60 сыворотки крови. Повышение уровня секреторных IgA к C. trachomatis в семенной плазме при хроническом простатите свидетельствует о том, что первый и самый важный иммунный ответ на хламидийную инфекцию является местным. Высокая информативность определения секреторных IgA к Ch. trachomatis в семенной плазме и антител классов IgG и IgA к Ch. trachomatis показана в ряде зарубежных исследований [9]. Так, по мнению K.A. Redgrove et al., иммунные клетки могут не только инициировать хроническое воспаление, приводящее к пролиферации эпителиальных клеток, ремоделированию тканей и рубцов, но и быть причиной развития аутоиммунных реакций [13]. Применение ИФА для выявления антител к хламидиям с дифференцировкой специфических иммуноглобулинов A, M и G важен для определения стадии и характера течения хламидийной инфекции.
Титры антител при хламидиозах относительно невысоки. В промежутке между 1-й и 3-й неделями после проявления первых симптомов болезни последовательно возникают родоспецифические IgМ-АТ, IgA-АТ, IgG-АТ, а в ряде случаев в этот период их удается определить одновременно. IgM являются ранним маркером инфекции и определяются уже через 5 дней после начала заболевания, пик их приходится на 1–2 недели, и они полностью исчезают через 2–3 месяца независимо от проведенного лечения. Секреторные IgA вначале выявляются в семенной плазме и влагалищном отделяемом, но при этом отсутствует корреляция с содержанием сывороточных IgA, которые появляются через 10–14 дней после начала заболевания – обычно параллельно появлению IgG, только на более низком уровне, и свидетельствуют о прогрессировании заболевания. Уровень IgA обычно снижается к 2–4-му месяцам в результате успешного лечения. При реинфекциях их уровень вновь возрастает. Если уровень IgA-антител не падает после проведенного лечения, то это указывает на неэффективность лечения и формирование хронической формы инфекции. IgA служат маркером как свежей, так и манифестированной хронической формы инфекции. Определение IgA более информативно в качестве маркера активной стадии хламидийной инфекции или в мониторинге эффективности лечения, т.к. эти антитела короткоживущие (5–8 дней) и имеют небольшой период полураспада. В то же время или с небольшой задержкой могут быть определены IgG-АТ. IgG – доминирующий класс иммуноглобулинов в сыворотке крови, составляющий до 90% всех антител IgG, определяются через 15–20 дней после начала заболевания, а период их полураспада – 23 дня. После перенесенной инфекции они могут определяться в низких концентрациях в течение многих лет. При реинфекции или реактивации наблюдается заметное увеличение уровня IgG-антител (бустер-эффект), который у нелеченых пациентов сохраняется неизменным. Высокие уровни антихламидийных IgG-антител диагностически важны при хронической инфекции и реактивном артрите (болезни Рейтера).
Специфичность ИФА – 92–99%, чувствительность – 98%. Иммунные реакции организма возможны, когда хламидии находятся в форме элементарных телец. При неблагоприятных условиях жизненный цикл хламидий может замедляться (до нескольких месяцев) или останавливаться, например, на стадии инициальных телец, когда образуются т.н. аберрантные ретикулярные тельца, что приводит к персистирующей инфекции. Эти формы продуцируют минимальные количества хламидийных структурных антигенов, но продолжают синтезировать и освобождать БТШ. Целесообразна постановка ИФА не только на наличие IgA, IgM, IgG, но и для определения IgG- к БТШ-60 хламидий [14, 15].
Таким образом, серологическое обследование 20 пациентов с отрицательным результатом ПЦР-диагностики позволило нам выявить полиморфизм серологических ответов и подтвердить утверждение об отсутствии одного метода диагностики, позволяющего определить хламидийную этиологию хронического простатита. Только комплексное обследование больных с использованием прямых методов определения возбудителей (ПЦР) и непрямых (серологических) исследований (ИФА) позволяет улучшить качество диагностических поисков для этой категории больных.
Заключение
Определение секреторных IgA к Ch. trachomatis в семенной плазме позволило выявить хламидийную природу хронического простатита у 20 (51,3%) из 39 пациентов. Это служит доказательством того, что степень инфицированности урогенитального тракта у мужчин не может быть установлена только с помощью прямых методов выявления возбудителя. Выявление у 11 (55%) из 20 больных хроническим простатитом антител класса IgG к БТШ-60 Ch. trachomatis указывает на высокую частоту при этом заболевании персистирующей хламидийной инфекции. Для исключения хламидийной природы хронического простатита определение только антител классов IgG и IgA к Ch. trachomatis может быть недостаточным ввиду возможности серонегативного ответа. Поэтому эти исследования должны дополняться определением секреторных IgA к Ch. trachomatis семенной плазмы и сывороточных антител класса IgG к БТШ-60. Определение уровня последних важно для исключения персистирующей хламидийной инфекции.


