Введение
Ишемический инсульт – вторая по частоте причина смертности и инвалидизации во всем мире, главное – занимает первое место по инвалидизации. Инсульт – преобладающая причина инвалидизации (3,2 на 1000 населения). Наиболее частыми последствиями инсульта являются двигательные расстройства в виде параличей и парезов, чаще всего односторонних гемипарезов различной степени выраженности [1, 2].
В основе восстановления после инсульта лежат три основных процесса: изменения в очаге острого повреждения, нейропластичность и поведенческая компенсация [3]. Изменения в самом очаге состоят в разрешении отека ткани, воспалительного процесса, рассасывании некротизированных масс. Поведенческая компенсация подразумевает формирование когнитивной стратегии по максимальной компенсации дефицитарного состояния. Чрезвычайно важным механизмом восстановления нарушенных функций является постинсультная нейропластичность: совокупность различных процессов ремоделирования синаптических связей, направленных на оптимизацию функционирования нейрональных сетей. За счет нейропластичности, формирования новых синапсов, изменения активности тормозных нейронов, а также нейроногенеза функцию поврежденных участков коры головного мозга могут брать на себя рядом расположенные участки, а порой даже клетки противоположного полушария головного мозга. Реабилитационные программы и лекарственная терапия в подостром и восстановительном периодах инсульта направлены в первую очередь на стимуляцию процессов нейропластичности. Это направление терапии называют нейромодуляцией, т.е. воздействием, способствующим более полной и ранней реализации генетически предопределенного потенциала нейропластичности. Оно включает разные реабилитационные практики: кинезиотерапию, транскраниальную магнитную стимуляцию, лечение спастичности и применение фармакологических агентов с целью восполнения медиаторного дефицита или активации процессов нейрорепарации [4].
Низкомолекулярные пептиды свободно проникают через гематоэнцефалический барьер и оказывают многостороннее действие на центральную нервную систему (ЦНС), что определяет высокую эффективность и выраженную направленность действия при условии их очень малой концентрации в организме. Одним из наиболее известных препаратов нейротрофического ряда является Церебролизин – пептидный гидролизат вытяжки из головного мозга свиней [5].
В доклинических исследованиях показано, что Церебролизин стимулирует процессы нейропластичности путем усиления нейрогенеза, олигодендрогенеза и аксонального ремоделирования в периинфарктной области за счет эффекта акустического сигнала (hedgehog effect) [6–8]. Таким образом, одним из механизмов, обеспечивающих улучшение исходов инсульта у человека при лечении Церебролизином, может являться стимуляция нейропластичности [9].
Это предположение изучено в клиническом исследовании CARS [10].
В рандомизированном двойном слепом плацебо-контролируемом исследовании зарегистрирован статистически значимый положительный эффект Церебролизина в отношении восстановления двигательной функции верхних конечностей (шкала ARAT), способности к ходьбе (шкала GV), неврологических функций (шкала NIHSS), уровня повседневной активности (индекс Бартел, модифицированная шкала Рэнкина), степени нарушения речи (шкала GKS), уровня депрессии (шкала GDS). В целом отмечено, что Церебролизин оказывает положительный эффект на функциональное состояние и общий исход во время ранней реабилитации пациентов после инсульта.
В ранее проведенном нами пилотном исследовании 3С (Stimulation for evaluation of the neuroprotective drug efficiency in patients after ischemic stroke) NCT01388738 (в печати) методом навигационной стимуляции мозга (NBS) [11] был обнаружен эффект Церебролизина на моторный центр парализованных конечностей в виде изменений порога возбуждения нейронов в зоне интереса на магнитную стимуляцию и увеличения площади коры, реагирующей на стимуляцию. Приведенные факты стали основанием для планирования нового исследования с применением Церебролизина в качестве потенциального модулятора нейрорепарации.
Цель исследования: оценка влияния препарата Церебролизин® в сочетании со стандартной терапией на динамику восстановления пареза верхней конечности у пациентов с острым ишемическим инсультом в бассейне средней мозговой артерии. Эффективность будет оцениваться путем анализа динамики функционального состояния нервной системы с помощью специальных шкал и опросников, а также по данным морфометрии очага поражения (МРТ) и изучения процессов нейропластичности (с помощью навигационной транскраниальной магнитной стимуляции головного мозга).
Задачи исследования:
- определить и сравнить степень восстановления функции кисти по результатам теста для руки Френчай (Frenchay Arm Test) в группе применения препарата Церебролизин® в сочетании со стандартной терапией и в контрольной группе;
- определить и сравнить динамику топологии двигательных центров кистей в коре обоих полушарий, порога моторного ответа, амплитуды и латентности вызванных моторных ответов по результатам навигационной транскраниальной стимуляции головного мозга (NBS) обоих полушарий с расположением активного электрода электромиографа (ЭМГ) на m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis в группе применения препарата Церебролизин® в сочетании со стандартной терапией и в контрольной группе.
Материал и методы
Дизайн исследования
Рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности применения препарата Церебролизин® при остром ишемическом инсульте. Наименование исследования: «Рандомизированное двойное слепое плацебо-контролируемое исследование влияния препарата Церебролизин® («ЭВЕР Нейро Фарма ГмбХ», Австрия) на уровень пареза верхней конечности при использовании в комплексной терапии острого ишемического инсульта». COMRIS-ARM «COMplex Repair in Ischemic Stroke-Arm» (NCT02581371).
После прохождения процедур скрининга, включая магниторезонансную томографию (МРТ) головного мозга, и подтверждения соответствия критериям для участия в исследовании, пациент методом конвертов рандомизируется в одну из групп: стандартной терапии в сочетании с применением инфузий Церебролизина по предусмотренной протоколом схеме, либо стандартной терапии в сочетании с применением инфузий плацебо (натрия хлорид 0,9%) по предусмотренной протоколом схеме.
На скрининге (визит 0), а также после первого курса терапии (визит 2), перед вторым курсом (визит 3), после второго курса (визит 4) и на завершающем визите (через 180±7 дней, визит 5) проводится клиническое обследование, включая использование шкалы NIHSS, модифицированной шкалы Рэнкина, индекса Бартел, теста для руки Френчай (выполнение теста для руки Френчай во всех точках будет записываться на видео для последующей оценки одним заслепленным исследователем). Также в запланированные дни будут проводиться лабораторные исследования. Перед вторым курсом терапии, после второго курса терапии, а также спустя полгода (на визите 5) будет проводиться навигационная транскраниальная магнитная стимуляция головного мозга (NBS eXimia Nexstim) с использованием выполненной на скрининге МРТ для построения 3D-индивидуальной модели головного мозга. Также МРТ головного мозга для оценки динамики размеров инфаркта мозга будет выполнена на завершающем визите (через полгода, визит 5).
Ни пациент, ни лечащий врач не будут знать, в какую группу распределен пациент. Оценка видеозаписей теста для руки Френчай, так же как определение объема поражения по данным МРТ, будет осуществляться заслепленными исследователями.
После выписки из клинического центра № 2 и до выполнения процедур заключительного визита обследование пациента в рамках настоящего исследования не планируется (в это время, а также после завершения участия в исследовании пациент будет наблюдаться лечащим врачом и получать помощь по стандартам, принятым в Российской Федерации, амбулаторно).
Критерии соответствия
Критерии включения:
- Наличие подписанного пациентом информированного согласия.
- Мужчины и женщины в возрасте от 45 до 75 лет включительно.
- Подтвержденный (клинически и по данным МРТ головного мозга) диагноз острого ишемического инсульта в бассейне средней мозговой артерии.
- Тяжесть инсульта от 5 до 24 баллов по шкале NIHSS.
- Гемипарез с преимущественным поражением верхней конечности (не более 2 баллов при оценке функции пораженной кисти с помощью теста для руки Френчай и не более 2 баллов при оценке пораженной нижней конечности по 6-му пункту шкалы NIHSS).
- Время от начала заболевания до предполагаемого времени введения препарата не более 72 часов.
- Готовность пациентов обоего пола и их половых партнеров с сохраненной репродуктивной функцией использовать надежные методы контрацепции начиная с момента включения в исследование и до завершения участия в данном клиническом исследовании.
Критерии невключения:
- Возраст моложе 45 или старше 75 лет.
- Известная непереносимость (в т.ч. аллергические реакции) Церебролизина, вспомогательных компонентов исследуемого препарата.
- Тромболитическая терапия.
- Признаки геморрагического инсульта.
- Нарушение сознания (≥2 баллов при оценке по 1а-пункту NIHSS).
- Наличие признаков, позволяющих прогнозировать разрешение неврологической симптоматики в течение 24 часов от появления первых симптомов.
- Инсульты или транзиторные ишемические атаки в анамнезе.
- Балл по модифицированной шкале Рэнкина до инсульта более 0.
- Сопутствующая терапия нейропротекторными или ноотропными препаратами.
- Впервые возникшие судороги или эпилепсия.
- Планируемая каротидная эндартерэктомия или иная операции для вторичной профилактики инсульта.
- Неврологические заболевания или патология нервно-мышечного аппарата, или любое другое заболевание, которое может влиять на трактовку результатов исследования.
- Системная терапия биологическими препаратами, включая интерферон, его индукторы и/или цитокины/антицитокины (например, анти-ФНО-α, анти-CD4, интерлейкин-10, интерлейкин-1 и др.) в течение месяца до скрининга.
- Тяжелые сопутствующие заболевания, в т.ч. онкологические, которые, по мнению исследователя, могут влиять на оцениваемые параметры.
- Неконтролируемая артериальная гипертензия (систолическое давление ≥220 мм рт.ст. и/или диастолическое давление ≥120 мм рт.ст. при повторных измерениях на визите скрининга).
- Неконтролируемая стенокардия, застойная сердечная недостаточность или тяжелая аритмия.
- Наличие хронической инфекции (гепатит В, С или вирус иммунодефицита человека) в активной форме.
- Выраженное нарушение функции почек или печени (уровень общего билирубина не более чем в 1,5 раза выше верхней границы нормы [ВГН], уровень креатинина сыворотки не более чем в 2,5 раза выше ВГН, уровни аланинаминотрансферазы, аспартатаминотрансферазы и гамма-глутамилтрансферазы не более чем в 2,5 раза выше ВГН).
- Заболевания системы кроветворения.
- Психические заболевания, тяжелые депрессивные состояния или суицидальные попытки в анамнезе.
- Указание в анамнезе на наркоманию, алкоголизм и злоупотребление лекарственными препаратами.
- Противопоказания к проведению МРТ: металлические тела, осколки, ферромагнитные импланты (кардиостимуляторы, автоматические дозаторы лекарственных средств, имплантированные инсулиновые помпы, искусственный задний проход с магнитным затвором, искусственные клапаны сердца с металлическими элементами), стальные импланты (зажимы/клипсы на сосудах, искусственные суставы, аппараты металлоостеосинтеза), слуховые аппараты.
- Участие в любом другом клиническом исследовании в течение 30 дней до скрининга или одновременное участие в других клинических исследованиях.
- Беременность, кормление грудью или планируемая беременность.
- Женщины и мужчины с сохраненным репродуктивным потенциалом, отказывающиеся применять эффективные методы контрацепции на протяжении всего исследования.
- Прогнозируемая продолжительность жизни менее 1 года.
- Любые заболевания или обстоятельства, которые, по мнению исследователя, могут помешать субъекту участвовать в исследовании или в связи с которыми участие в исследовании может представлять опасность для субъекта.
Критерии исключения (исследователь должен досрочно исключить пациента из исследования в следующих случаях):
- Отказ субъекта от дальнейшего участия в исследовании без объявления причин.
- Несоблюдение субъектом правил участия в исследовании.
- Причины, возникшие в ходе исследования и угрожающие безопасности субъекта, в т.ч. связанные с приемом исследуемого препарата нежелательные явления.
- Субъекты, у которых во время исследования наступила беременность.
- Применение пациентом в период исследования любых дополнительных нейропротекторных, а также ноотропных препаратов, препаратов группы корректоров нарушений мозгового кровообращения.
- Иные причины, возникшие в ходе исследования и препятствующие проведению исследования согласно протоколу.
- Повторный инсульт в течение исследования.
- Субъекты, потерянные для наблюдения, также относятся к преждевременно выбывшим из исследования.
Условия проведения
Первый этап исследования (в т.ч. первый курс терапии) проводится в клиническом центре № 1 (Свердловская областная клиническая больница № 1 [СОКБ № 1], Екатеринбург), второй этап исследования (в т.ч. NBS и второй курс терапии) проводится в клиническом центре № 2 (Клинический институт мозга [КИМ], Екатеринбург), куда больной переводится для продолжения лечения на этапе реабилитации.
Продолжительность исследования
Каждый пациент участвует в исследовании в течение 176–190 дней (приблизительно полгода). Предполагаемая продолжительность всего исследования – 2 года.
Описание медицинского вмешательства
Схема предусматривает два курса терапии: 50 мл Церебролизина, разведенных в 50 мл физ. р-ра, по одной инфузии Церебролизина/плацебо (100 мл физ. р-ра) в сутки в течение 10 дней, затем 7-дневный перерыв, затем повторный курс ежедневных инфузий Церебролизина/плацебо в течение 10 дней.
Участники обеих групп могут получать любые назначенные врачом лекарственные средства, необходимые для лечения основного (ишемический инсульт) и сопутствующих заболеваний/контрацепции, за исключением препаратов, которые, по мнению исследователя, могут затруднять интерпретацию полученных в ходе исследования данных.
Во время настоящего исследования запрещен прием любых дополнительных нейропротекторных, а также ноотропных препаратов, препаратов группы корректоров нарушений мозгового кровообращения, антидепрессантов, транквилизаторов, нейролептиков, седативных препаратов или стимуляторов ЦНС.
Основной исход исследования
Первичная конечная точка: динамика оценки функции кисти по результатам теста для руки Френчай (Frenchay Arm Test) – сравнение данных на визитах 5 и 0.
Дополнительные исходы исследования
Вторичные конечные точки:
- динамика оценки функции кисти по результатам теста для руки Френчай (сравнение данных на визитах 2–4 с данными на визите 0);
- динамика изменения баллов по шкале NIHSS (сравнение данных на визитах 2–4 и 5 с данными на визите 0);
- динамика изменения баллов по модифицированной шкале Рэнкина (сравнение данных на визитах 2– 4 и 5 с данными на визите 0);
- динамика изменения индекса Бартел (сравнение данных на визитах 2– 4 и 5 с данными на визите 0);
- динамика уменьшения объема инфаркта головного мозга по данным 3D-МРТ;
- динамика топологии двигательных центров кистей в коре обоих полушарий по результатам NBS обоих полушарий с расположением активного электрода ЭМГ на m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis (сравнение данных, полученных на визитах 4 и 5 с данными на визите 3);
- динамика порога моторного ответа по результатам NBS обоих полушарий с расположением активного электрода ЭМГ на m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis;
- динамика амплитуды вызванных моторных ответов по результатам NBS обоих полушарий с расположением активного электрода ЭМГ на m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis;
- динамика латентности вызванных моторных ответов по результатам NBS обоих полушарий с расположением активного электрода ЭМГ на m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis.
Анализ в подгруппах
Не планируется.
Методы регистрации исходов
Исследование будет выполняться с использованием системы транскраниальной магнитной стимуляции головного мозга NBS eXimia Nextim (Nextim Ltd., Хельсинки, Финляндия). Алгоритм работы навигационных систем для неинвазивной стимуляции включает:
- Проведение МРТ головного мозга пациента в режиме Т1.
- Построение 3D-индивидуальной модели головного мозга пациента (NBS eXimia Nextim) на основе проведенной МРТ.
- Соотнесение анатомических образований с ориентирами на МРТ (наиболее доступные – козелок уха и переносица).
- Проведение транскраниальной магнитной стимуляции с привязкой магнитного поля к конкретным МРТ-образованиям мозга пациента.
- Регистрация вызванных моторных ответов (электромиография, ЭМГ) и определение их порога.
С целью картирования областей, отвечающих за сокращение m. abductor pollicis brevis, m. adductor pollicis и m. flexor pollicis brevis, стимуляции подлежат первичная моторная кора (М1 – вдоль постцентральной извилины непосредственно кпереди от центральной борозды), соматосенсорная кора (S1 – вдоль постцентральной извилины, непосредственно кзади от центральной борозды), премоторная кора и дополнительная моторная кора, чтобы определить области, ответственные за сокращение указанных мышц. За корковое моторное представительство мышцы принимается зона, наименьшая стимуляция которой дает максимальный вызванный моторный ответ. В этой зоне находят оптимальную ориентацию койла путем его вращения (±45°, ±90°, ±135° и 180°) и регистрации времени моторного ответа (ВМО) при стимуляции в каждой позиции. Ориентация койла, при которой регистрируется максимальный вызванный моторный ответ, используется для определения порога возбуждения покоя.
Порог возбуждения покоя (ПВП) находится по методике, предложенной Awiszus. Стимуляцию начинают с напряженности электрического поля 80–100 В/м. Подается 10 стимулов с интервалом в 5 секунд, после каждого из которых регистрируются ВМО. Учитываются ВМО амплитудой более 50 мкВ. Если их более 4, напряженность электрического поля уменьшают на 1%, если менее 4 – увеличивают на 1% и вновь проводят регистрацию ВМО на 10 импульсов с интервалом в 5 секунд. За ПВП принимается сила стимула в % от выходной мощности стимулятора (и соответствующая ей напряженность электрического поля), при которой в ответ на 10 стимулов регистрируется 4 ВМО амплитудой более 50 мкВ.
После определения ПВП для каждой мышцы точно определяется локализация зоны коркового моторного представительства данной мышцы, продолжая NBS с шагом койла в 2 мм и выполняя в каждой точке стимуляцию с силой, на 20% превышающей ПВП (120% ПВП). Если стимуляция силой в 200% ПВП не приводит к ВМО, констатируется отсутствие ответа. Исследование выполняется со стимуляцией последовательно обоих полушарий (очередность стимуляции не принципиальна). Исследование всех пациентов проводит один и тот же специалист для исключения погрешностей, связанных с разной методикой проведения и интерпретацией результатов разными исследователями.
Представление результатов исследования
Данные всех визитов заносятся в формализованную индивидуальную регистрационную карту. Использованные метрики балльных шкал и графический протокол NBS топографии архивируются в электронном и печатном видах (см. таблицу и рисунок).
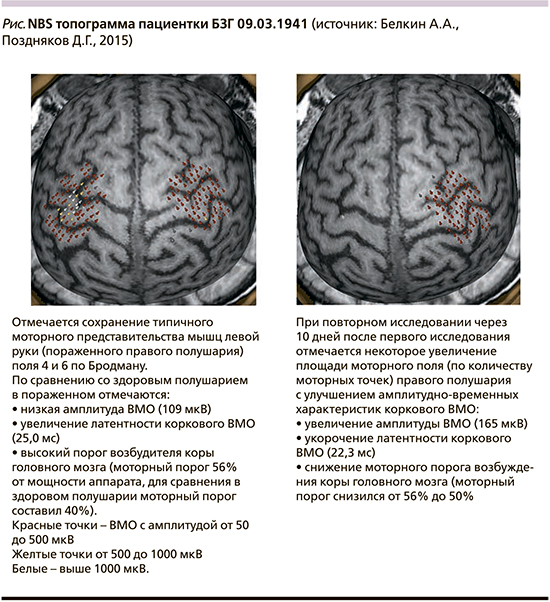
Этическая экспертиза
Протокол исследования утвержден решением этического № 36 Комитета областной клинической больницы № 1 от 12.04.2014.
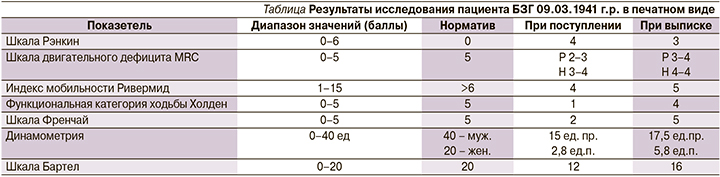
Статистический анализ
В исследование планируется включить 30 пациентов, по 15 в группу лечения и в группу контроля. Исследование является пилотным, формальный расчет размера выборки не проводился.
В ходе исследования проверяется односторонняя гипотеза о большей эффективности терапии в опытной группе лечения исследуемым препаратом по сравнению с плацебо-контролем. Уровень статистической значимости принят равным 0,05.
Для описания количественных переменных, распределенных по нормальному закону, запланировано использование следующих характеристик: среднее значение, стандартное отклонение, 95% доверительный интервал. Описание количественных данных, распределенных по закону отличного от нормального, предполагается в виде медианы и квартилей. Для описания качественных переменных запланировано использование частот, процентов и долей.
На этапе планирования исследования определена возможность использования ряда статистических методов, применимость которых будет оценена после завершения сбора данных, поскольку заранее не известны характер распределения данных, однородность выборки и др. Для нормально распределенных данных планируется использовать следующие критерии: двухвыборочный критерий Стьюдента, критерий Уэлча, дисперсионный анализ. Для данных, законы распределения которых отличны от нормального, планируется использовать следующие критерии: критерий Манна–Уитни, критерий Вилкоксона, критерий Краскела–Уоллисса. Проверка нормальности данных осуществляется с помощью критерия Шапиро–Уилка. Однородность данных планируется проверять с использованием критерия Фридмана.
Обработка категориальных данных будет проведена с использованием таблиц частот, таблиц сопряженности, точного критерия Фишера, критерия равенства частот, критерия Пирсона. Для описания категориальных данных запланировано использование процентов или долей. Анализ линейной взаимосвязи между переменными будет проводиться с помощью корреляционного анализа по Пирсону (для параметрических данных) и Спирмену (для непараметрических данных). Статистическая обработка полученных результатов будет выполнена с помощью пакета прикладных программ Stata 13 и/или R.
Заключение
Дизайн исследования COMRIS открывает новое направление в изучении модулирующих свойств фармакологических средств в структуре терапии острой церебральной недостаточности от ранних часов до позднего восстановительного периода. Планируемое исследование позволит уточнить способность Церебролизина как одного из наиболее активного используемого в нейрореабилитации препарата, оказывать усиливающее воздействие на репаративные процессы восстановления функций моторных центров парализованных конечностей после в раннем восстановительном периоде ишемического инсульта в структуре комплексной реабилитации.



