Пристальное внимание к процессам, происходящим в остром и восстановительном периодах инсульта, интенсивное развитие технологий нейрореабилитации, развитие принципов доказательной медицины – все это приводит к пониманию необходимости системного анализа нейропластичности, лежащей в основе как восстановления, так и компенсации (полной или частичной) утраченных неврологических функций.
Обратимся к терминологии, описывающей физиологические и патофизиологические процессы со стороны нервной ткани, возникающие в здоровом организме и в ответ на повреждение мозга:
Нейропластичность – совокупность различных процессов ремоделирования синаптических связей, направленных на оптимизацию функционирования нейрональных сетей [1], играет решающую роль в процессе фило- и онтогенеза, а также в поддержании функционирования уже сформированных нейрональных сетей и после повреждения структур нервной системы, в ходе восстановления утраченных функций. В широком понимании нейропластичность представляет собой способность нервной системы отвечать на внутренние и приходящие извне организма стимулы путем реорганизации своей структуры, функций и связей на разных уровнях – от молекулярно-клеточного до системного и поведенческого, которая реализуется в ходе развития организма в ответ на окружающие воздействия, при процессах обучения, в ответ на болезнь, ту или иную терапию [2].
Нейротрофика, нейрорепарация – естественный процесс, подразумевающий постоянство правильной экспрессии ДНК и сохранение нормального фенотипа клетки. Особенности восстановления клеток после повреждения включают внутриклеточную (восстановление структур клетки) и клеточную регенерацию (путем деления и дифференцировки клеток). В течение длительного времени считалось, что нейроны не способны к регенерации [3]. Более поздние исследования доказали, что возможна как внутриклеточная регенерация нейронов, так и дифференцировка новых клеток из предшественников (нейрогенез). Регенерацию поврежденных тканей (т.е. их восстановление) подразделяют на репаративную и патологическую. Репаративная регенерация (репарация) — восстановление поврежденных тканей, при котором процесс регенерации протекает нормально, хотя и быстрее физиологической регенерации. Патологическая регенерация — восстановление поврежденных тканей, при котором ход регенерации нарушен.
Нейропротекция – комплекс механизмов, противодействующих повреждающим факторам. Так, нейропротекция мозга после ишемического поражения может быть определена как стратегия или комбинация стратегий, которые противостоят, прерывают и уменьшают последствия биохимических и молекулярных сдвигов, которые, если им не противодействовать, значительно и необратимо увеличат размер ишемического повреждения [4].
Нейрогенез – формирование из стволовых клеток новых клеток нервной ткани (нейронов, астроцитов и олигодендроцитов). Вопреки утверждению, будто новые нейроны не способны образовываться в головном мозге млекопитающих, недавно было доказано, что нейроногенез все-таки происходит в области обонятельной луковицы, зубчатой борозды и даже в неокортексе. Эти новые нейроны, возможно, играют определенную роль в процессе обучения и запоминания, реализуемом посредством модуляции нейросинаптических связей, возникновения новых контактов и формирования нейрональных сетей [5].
Данные фундаментальные биологические процессы не имеют четко выраженных границ, их механизмы сходны и взаимосвязаны. Тем не менее все эти защитные механизмы могут быть запущены естественным путем или активированы фармакологически.
Какие же патологические изменения в нервной системе активизируют естественные защитные механизмы или требуют коррекции извне? Наиболее понятны механизмы развития «патобиохимического ишемического каскада», обусловленные запуском анаэробного пути метаболизма глюкозы, накоплением в клетках молочной кислоты, развитием лактат-ацидоза, внутриклеточным накоплением ионов кальция. В результате поломки ионных насосов и накопления в клетках натрия, хлора и воды развивается цитотоксический отек. Избыточный выброс в синаптическую щель возбуждающих нейротрансмиттеров глутамата и аспартата приводит к развитию глутаматной эксайтотоксичности. В конечном итоге активируются механизмы апоптоза и протеолиза [6].
Ангио-, нейро-, синаптогенез, активация неповрежденных участков мозга – нейропластическая компенсаторная реакция в ответ на повреждение мозга. До сих пор недостаточно изучена роль нейроваскулярного комплекса после повреждения мозга. Три взаимосвязанных процесса в нейрорепарации – ангио-, нейрогенез и синаптическая пластичность – имеют место в нормальном мозге взрослых, но могут быть вызваны и его повреждением. Стимуляция ангиогенеза приводит к появлению новых сосудов, что улучшает коллатеральную циркуляцию вокруг повреждения. Нейрогенез контролируется внутренними генетическими механизмами и факторами роста, кроме того, важны факторы микроокружения – микрососуды, глия. Присутствие микроваскулярной эндотелиальной клетки обеспечивает секрецию факторов роста и хемокинов, которые обеспечивают жизнеспособность вновь образованных нейронов и участвуют в процессах миграции нейрональных прогениторных клеток [7].
Концепция «нейроваскулярной единицы» [8] позволяет рассматривать функцию эндотелиальных клеток, клеток мозга и внеклеточного матрикса как единое целое. Существует гипотеза о возникновении системных нарушений при повреждении лишь одного из компонентов нейроваскулярной единицы.
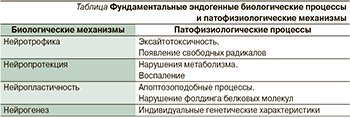
Ниже предлагается таблица, отражающая сведения о возможных восстановительных и патофизиологических процессах в структурах нервной системы [9]. К механизмам, приводящим к развитию заболеваний центральной нервной системы, относят эксайтотоксичность, появление свободных радикалов, нарушения метаболизма, фолдинга белковых молекул, воспаление, апоптозподобные процессы. Так, при инсульте наблюдаются эксайтотоксичность, оксидативный стресс, воспаление и апоптозоподобная гибель клеток. Нейродегенеративные заболевания сопровождаются эксайтотоксичностью, воспалением, апоптозоподобной смертью и нарушениями фолдинга белков [9].
В определенной степени одни и те же процессы могут опосредовать защитную или повреждающую функцию:
Активация NMDA-рецепторов оказывает положительное влияние на процессы нейропротекции и нейропластичности (при физиологически нормальной активации) и отрицательное (при гиперактивации) путем усиления эксайтотоксичности, что лежит в основе инсульта, травматических повреждений, нейродегенеративных заболеваний [10].
Воспаление в целом оказывает негативное влияние, однако может также положительно воздействовать на процессы нейропротекции и нейропластичности посредством выделения нейротрофических факторов [11–13].
Апоптоз – естественный физиологический процесс, в то время как апоптозоподобная гибель – всегда патологический. Контроль апоптозоподобных процессов происходит как при помощи эндогенных механизмов, так и медикаментозно [14].
Таким образом, наилучшей стратегией терапевтической нейропротекции является применение плейотропных препаратов, модулирующих (но не подавляющих) патологические нарушения. Такие препараты должны подавлять эксайтотоксичность, развивающуюся при стимуляции внесинаптических NMDA-рецепторов, уменьшать отрицательные и потенцировать положительные эффекты воспаления, а также предотвращать развитие апоптозоподобных процессов.
Важную роль в процессах восстановления играют нейротрофические факторы. Последние реализуют свое действие путем связывания со специфическими рецепторами – как правило, с двумя и более. Некоторые из них обладают высоким сродством к нейротрофическим факторам, тогда как другие низкоаффинны. Связывание с каждым из них запускает внутриклеточный каскад биохимических реакций, в конечном итоге приводящий к активации факторов транскрипции. К факторам транскрипции относятся ДНК-ассоциированные белки, контролирующие экспрессию генов. По мнению М. Millan и J. Arenillas [15], при стимуляции клетки происходят биохимические модификации структуры данных молекул, вследствие чего они приобретают способность проникать в клеточное ядро, связываться с различными кофакторами и т.д.
Наиболее сильное трофическое влияние на все основные процессы жизнедеятельности нейронов оказывают нейротрофины – регуляторные белки нервной ткани, которые синтезируются в ее клетках (нейронах и глии). Нейротрофины действуют локально в месте высвобождения, интенсивно индуцируют ветвление дендритов (арборизацию) и рост аксонов (спрутинг) в направлении клеток-мишеней. Синаптический спрутинг, обеспечивающий «реусиление» существующих нейрональных токов [16] и образование новых полисинаптических связей [17], обусловливает пластичность нейрональной ткани и формирует механизмы, участвующие в восстановлении нарушенных неврологических функций.
 NGF стал первым идентифицированным нейротрофным фактором и родоначальником особой, наиболее специфической по своей биологической активности группы факторов, получившей название нейротрофинов. Наиболее изучены в настоящее время нейротрофины, близкие друг к другу по структуре: фактор роста нервов (NGF), фактор роста, выделенный из головного мозга (BDNF), нейротрофин-3 (NT-3), а также NT-6 и NT4/5 (у разных видов NT4 или NT5) [18].
NGF стал первым идентифицированным нейротрофным фактором и родоначальником особой, наиболее специфической по своей биологической активности группы факторов, получившей название нейротрофинов. Наиболее изучены в настоящее время нейротрофины, близкие друг к другу по структуре: фактор роста нервов (NGF), фактор роста, выделенный из головного мозга (BDNF), нейротрофин-3 (NT-3), а также NT-6 и NT4/5 (у разных видов NT4 или NT5) [18].
В развивающемся организме они синтезируются клеткой-мишенью (например, мышечным веретеном), диффундируют по направлению к нейрону, связываются с молекулами рецепторов на его поверхности, что приводит к активному росту аксона. В результате аксон достигает клетки-мишени, устанавливая с ней синаптический контакт.
Ведущее значение в развитии процессов ишемического повреждения ткани мозга имеет недостаточность трофического обеспечения [19, 20]. Естественной защитной реакцией мозга в первые минуты ишемии служит синтез трофических факторов и рецепторов к ним. При быстрой и активной экспрессии генов, кодирующих нейротрофины (факторы роста), ишемия мозга может длительно не приводить к инфарктным изменениям [21]. В случае же формирования ишемического повреждения высокий уровень трофических факторов обеспечивает регресс неврологического дефицита даже при сохранении морфологического дефекта, вызвавшего его [22]. L.A. Labiche и J.C. Grotta показали в мета-анализе [23], что, несмотря на недостаточную стойкость достигнутой нейропротекции при использовании некоторых нейротрофических препаратов, в нескольких исследованиях обеспечен значимый эффект (включая исследования эритропоэтина, церебролизина, цитиколина).
Таким образом, препараты нейтрофического действия особенно перспективны в осуществлении вторичной нейропротекции. К последним, несомненно, относятся Церебролизин и Кортексин, представляющие собой полипептиды и композиты, полученные из головного мозга скота.
В частности, клинические эффекты Церебролизина в значительной степени обусловлены его нейротрофической и нейрорепарационной активностью, схожей с действием фактора роста нервов [24].
Вероятно, займет свою клиническую нишу и препарат нейрорепаративного действия Целлекс. Он представляет собой тканеспецифический белково-пептидный комплекс, полученный из фетальной ткани сельскохозяйственных животных. Как свидетельствуют результаты проведенных исследований, в состав Целлекса входят тканеспецифические сигнальные белки и пептиды, в частности факторы роста и дифференцировки нервных клеток. В условиях эксперимента установлен значительный эффект репаративной регенерации в отношении ишемизированной нервной ткани. Г.А. Романова и соавт. (2011) в экспериментальном исследовании с моделированным двусторонним фокальным инфарктом префронтальной коры больших полушарий показали, что применение Целлекса как до развития ишемического инсульта, так и после его приводило к уменьшению области инфаркта и улучшению функционального состояния животных по результатам серии тестов [25]. Представляет интерес сделанное авторами наблюдение, согласно которому более выраженный эффект оказывало введение препарата не до развития экспериментальной ишемии, а после завершившегося тромбоза. Очевидно, что в основе обнаруженных эффектов Целлекса может лежать его способность оказывать прямое нейрорепаративное и нейротрофическое действие, снижать активацию провоспалительных реакций, вызванных ишемией, стимулировать синтез нейротрофинов и предотвращать гибель нейронов после фокального коркового инфаркта.
Экспериментальные результаты получили в настоящее время первые клинические подтверждения [26]. Среди завершивших исследование 166 пациентов, получавших 4-недельную терапию Целлексом, отмечены достоверно лучшие исходы с регрессом двигательных, зрительных, речевых и чувствительных расстройств. На основании полученных данных авторы рекомендуют Целлекс в дозах 0,1 и 0,2 мг/мл к применению в остром и раннем восстановительных периодах острого нарушения мозгового кровообращения.
Таким образом, суммируя современные данные, касающиеся нейрорепаративной, нейротрофической терапии, можно сделать следующий вывод: наиболее оптимальным подходом к ее применению является назначение препаратов с плейотропным эффектом, которые модулируют, а не угнетают патофизиологические процессы нейродегенерации/нейрорепарации. Такие препараты способны уменьшать т.н. плохие эффекты нейровоспаления, усиливая при этом его «хорошие» эффекты, регулировать эксайтотоксичность, вызванную экстрасинаптическими NMDA-рецепторами, блокировать апоптозподобные механизмы.
Высокоперспективным в этом отношении можно считать новый нейротрофический препарат Целлекс. Предполагаемый механизм действия препарата расширяет возможности его терапевтического применения: время его назначения больному ишемическим инсультом не ограничивается первыми часами или минутами с момента развития заболевания, а пролонгируется на значительно больший период времени [26].



