Введение
Инсульт – одно из наиболее инвалидизирующих заболеваний [1] и основная причина возникновения стойких двигательных расстройств. Более чем у 60% больных развивается спастический гемипарез [2, 4]. Моторный дефицит (слабость мышц или парез), повышение мышечного тонуса, чувствительные расстройства, вторичные изменения в мышцах, суставах и окружающих тканях дезадаптируют пациентов, нарушают функцию конечностей, в т.ч. вызывают изменение ходьбы, неустойчивость и падения [3].
Спастичность, или повышение мышечного тонуса, которая наряду с мышечной слабостью и утратой нормальных движений представляет собой одно из самых распространенных и тяжелых последствий инсульта, приводит к укорочению мышц, изменению их структуры и функции, что в свою очередь нарушает ходьбу [5], существенно ограничивает функциональную независимость и снижает качество жизни [6].
Распространенность спастичности нижней конечности и сроки ее возникновения значительно варьируют по данным разных исследований [7].
В разные сроки возникновения тактика ее коррекции разная. Так, если спастичность в нижней конечности возникает в ранние сроки после инсульта, то она, как правило, нужна для вертикализации пациента, создания опоры на ногу. В более поздние сроки аномально повышенный тонус в мышцах нижних конечностей формирует патологические паттерны и вызывает изменение походки, нарушает баланс, увеличивает риск падений.
В настоящее время выделяют 7 наиболее часто встречаемых паттернов спастичности нижней конечности, в формировании которых участвуют разные мышцы: 1) приведение бедра; 2) сгибание колена; 3) разгибание колена; 4) эквиноварусная стопа; 5) подошвенное сгибание стопы; 6) сгибание пальцев; 7) переразогнутый (стриарный) палец. Зачастую у одного пациента встречается несколько патологических паттернов одновременно, что существенно меняет походку за счет аномального или компенсаторного вовлечения мышц, не участвующих в норме в той или иной фазе акта ходьбы, что значительно затрудняет восстановление конечности. Повышение мышечного тонуса служит наиболее инвалидизирующим симптомом, существенно нарушающим устойчивость и баланс, скорость и акт ходьбы в целом, делая пациента зависимым от окружающих, формируя ограничительное поведение. Своевременная коррекция повышенного мышечного тонуса крайне важна для социально-бытовой интеграции пациента в семью и общество, повышения его независимости.
Существуют медикаментозные и немедикаментозные методы снижения избыточного мышечного тонуса. Среди медикаментозных средств наиболее широко используются пероральные миорелаксанты, обладающие рядом крайне нежелательных побочных эффектов, как то общей слабостью, снижением артериального давления, возникновением головокружения и др., что может увеличивать риск падений, переломов и других неблагоприятных последствий, при этом не оказывая необходимого избирательного воздействия на мышцы конечности. Физиотерапевтические методы, широко использующиеся в реабилитации, оказывают хоть и локальный, но очень кратковременный эффект. В настоящее время одним из наиболее эффективных методов коррекции фокальной спастичности является ботулинотерапия. Имеется достаточно данных по безопасности и эффективности применения ботулинотерапии в коррекции мышечного тонуса у пациентов с постинсультной спастичностью верхней конечности [8–11]. Число же исследований эффективности и безопасности применения ботулотоксина типа А (БТА) в коррекции повышенного мышечного тонуса в нижней конечности не столь велико. Однако проведенные в последние годы исследования демонстрируют положительный эффект препаратов БТА в отношении снижения избыточного мышечного тонуса и улучшения процесса ходьбы.
Ходьба представляет собой сложный циклический локомоторный акт, функциональной единицей которого является цикл шага – время от начала контакта с опорой ноги до следующего аналогичного контакта с поверхностью той же ноги. Цикл шага состоит из двух периодов: опоры (фаза начального контакта, фаза принятия веса, ранняя/поздняя фаза середины шага, окончание фазы опоры, фаза предпереноса) и переноса (начало, середина и окончание переноса). Основные характеристики цикла шага представлены в табл. 1.
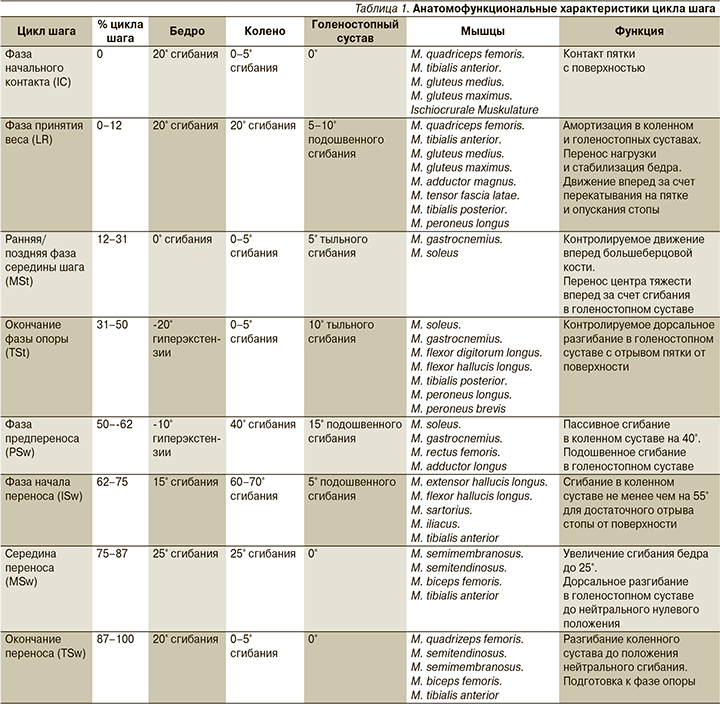
Нарушение этого сложного механизма приводит к формированию патологических установок и паттернов.
Патофизиология спастичности
Согласно современным представлениям, спастичность определяют как нарушение сенсомоторного контроля в результате повреждения верхнего мотонейрона, проявляющееся в перемежающейся или длительной непроизвольной активации мышц (EU-SPASM 2006). Патогенез ее крайне сложен и не до конца изучен. К механизмам, участвующим в формировании спастичности, относят снижение реципрокного торможения, дезорганизацию постсинаптического ингибирования, гипервозбудимость спинальных интернейронов, повышение возбудимости рецепторов, формирование новых синапсов вследствие аксонального спраутинга и др. [12]. Возникает также нарушение центральной регуляции мышечного тонуса, в формировании которого принимают активное участие пирамидная и экстрапирамидная системы (ретикулоспинальный тракт, вестибулоспинальный и др.) [13], что проявляется дисбалансом тормозящих и активирующих влияний, исходящих из разных уровней ЦНС [14]. Кроме того меняются и биомеханические свойства мышц, поскольку иммобилизация паретичной конечности способствует уменьшению длины мышечных волокон, снижению растяжимости мягких тканей. Это приводит к уменьшению числа саркомеров в мышце, изменениям в экстрацеллюлярном матриксе и способствует развитию соединительной ткани [15], что в итоге вызывает дисбаланс мышц агонистов и антагонистов и формирование контрактрактильных изменений [16].
Реабилитационные методы лечения спастичности
Всем пациентам с клинически значимым нарушением функции нижней конечности и избыточным мышечным тонусом рекомендуется проведение реабилитации, методы и цели которой в значительной мере варьируют в зависимости от степени выраженности и распространенности спастичности, а также от общего функционального статуса пациента. Существуют различные методы, показавшие свою эффективность в снижении повышенного мышечного тонуса и в отношении восстановления функции нижней конечности. Среди них различные методики кинезиотерапии, нервно-мышечная электростимуляция (НМЭС), ботулинотерапия и др. [17].
Использующиеся в кинезиотерапии упражнения на растяжение – наиболее распространенный нефармакологический подход коррекции спастичности. Базовым принципом является ежедневное выполнение упражнений на растяжение мышц самостоятельно или с помощью других лиц для увеличения или сохранения длины мышц, профилактики вторичных изменений в них.
В табл. 2 представлены основные физические упражнения для пациентов со спастичностью нижних конечностей [18].

Реабилитация пациентов со спастичностью нижней конечности – сложный процесс, требующий строго индивидуального подхода, правильной оценки существующего неврологического дефицита, в первую очередь анализа нарушения ходьбы и вовлеченных в этот процесс мышц. Поэтому составление программ требует мультидисциплинарности, т.е. участия нескольких специалистов: врача ЛФК, физиотерапевта, невролога, нейрофизиолога, специалистов физической реабилитационной медицины и других; и комплексности – сочетание нескольких методов: фармакологических и нефармакологических. К нефармакологическим относят как традиционные (массаж, различные методики кинезиотерапии, нервно-мышечная электростимуляция, функциональная стимуляция, иглорефлексотерапия, гидротерапия или иные методы), так и инновационные (транскраниальная магнитная стимуляция – ТКМС, роботизированные методы – «Локомат», различные виды экзоскелетов, виртуальная реальность, разработки космической медицины: костюмы «Атлант» и «Гравистат» и др.). Фармакологические методы включают применение медикаментов, снижающих мышечный тонус (пероральные миорелаксанты), фокальных миорелаксантов (ботулинотерапия). Существуют также хирургические способы коррекции аномально повышенного мышечного тонуса (ризотомия, баклофеновая помпа, методы нейромодуляции и др.). Среди большого числа существующих в настоящее время методов только небольшая их часть обладает достаточной доказательной базой в отношении их эффективности.
Так, например, среди традиционных методов кинезиотерапии одним из широко используемых у больных после инсульта считается метод проприоцептивной нервно-мышечной фасилитации (ПНФ/PNF). В его основе лежит стимуляция проприорецепторов мышц и сухожилий, которая улучшает их растяжимость, способствует наращиванию мышечной силы, восстановлению нарушенных функций, в результате чего улучшаются баланс и ходьба [19, 20]. В последние годы проведено несколько исследований, показавших эффект ПНФ в отношении снижения мышечного тонуса у пациентов с постинсультной спастичностью [21] и улучшения функции нижней конечности [22].
Повсеместно использующиеся для растяжения мышц с целью облегчения выполнения функциональных задач шины/лонгеты (например, использование ортеза голеностопного сустава для коррекции подошвенного сгибания стопы вследствие гипертонуса мышц-сгибателей стопы) не имеют высокого уровня доказательности [23].
Метод нервно-мышечной электростимуляции, также широко применяющийся в практическом здравоохранении, лишь в ограниченном количестве исследований показал кратковременное снижение тонуса в мышцах-антагонистах конечностей при воздействии на мышцы-агонисты [24]. В ряде работ показано, что применение НМЭС более эффективно после проведения инъекций БТА, т.к. способствует лучшей диффузии препарата, повышает его захват в мышце, результатом чего может быть большее расслабление мышцы [25]. Функциональная электростимуляция мышц нижней конечности включается в реабилитационные схемы на более поздних этапах [26].
Используются также упражнения по укреплению мышц (в частности, мышц-агонистов для уменьшения последствий спастичности в мышцах-антагонистах) [27], аэробные тренировки для поддержания общего тонуса и увеличения выносливости [28], а также функциональные тренировки для выполнения специализированных задач [29]. Выбор традиционных методов физиотерапии и лечебной физкультуры в значительной степени зависят от опыта и умения врача, функционального статуса пациента и существующих возможностей учреждения.
Многие пациенты не могут выполнять высокоинтенсивные и часто повторяющиеся тренировки, необходимые для получения максимального эффекта [30]. Одной из причин является нехватка соответствующих специалистов, способных обеспечить подобную интенсивность лечения. Частично эту проблему может решить высокотехнологичное реабилитационное оборудование, помогающее пациентам выполнять точные движения и обеспечивать эффективность тренировок [31]. Роботизированные реабилитационные системы – область, позволяющая решить проблему автоматизированных тренировок. В последнее десятилетие роботизированная реабилитация стала предметом активного интереса исследователей и врачей-реабилитологов. Применение роботизированных систем позволяет физически разгружать врача, а также анализировать в процессе тренировки данные многочисленных датчиков и оценивать реабилитационный статус пациента [32]. В последние годы разработаны различные типы реабилитационных роботов для работы с нижней конечностью с целью улучшения моторной функции у пациентов после инсульта. В целом реабилитационные роботизированные системы для нижней конечности можно разделить на две категории: экзоскелетные роботы и роботы-энд-эффекторы [33]. Например, Локомат (Lokomat) [34], BLEEX [35] и LOPES [36] – типичные экзоскелетные роботы, в то время как Rutgers Ankle [37] и Haptic Walker [38] представляют собой роботы-энд-эффекторы. В соответствии с применяемым реабилитационным принципом экзоскелетные роботы можно разделить на роботы с беговой дорожкой или с ортезами для нижней конечности, в то время как роботы-энд-эффекторы делятся на аппараты с использованием подножки или платформы.
В настоящее время прямое превосходство робототехники над традиционными физиотерапевтическими подходами не доказано, однако применение роботов типа «Локомат» в сочетании с традиционной физиотерапией более эффективно, чем применение только кинезиотерапии [39].
Ботулинический токсин типа А в лечении спастичности нижней конечности
В последние десятилетия активно развивается новое направление фармакологического лечения спастичности – ботулинотерапия. Ботулотоксин является «золотым» стандартом в лечении фокальной и мультифокальной спастичности. За эти годы проведено достаточное количество исследований, накоплена внушительная доказательная база (уровень I A) по его безопасности и эффективности для спастичности нижней конечности после инсульта в отношении снижения мышечного тонуса и улучшения скорости ходьбы. Открыто центральное действие ботулотоксина, основанное на снижении избыточного потока афферентации от мышц, находящихся в состоянии повышенного тонуса к мотонейронам спинного мозга, что модулирует деятельность центральной нервной системы и «обманывает» головной мозг, давая ему «ложную» информацию о ситуации на периферии, в мышце, тем самым создавая условия для моторного восстановления [40].
На сегодняшний день в РФ для лечения спастичности нижней конечности разрешены зарегистрированные на территории страны препараты: Оnabotulinumtoxin (Ботокс) и Аbobotulinumtoxin (Диспорт), имеющие уровень доказательности А в отношении снижения тонуса в нижней конечности [41], а также препарат Лантокс. В последние годы появились исследования по эффективности и безопасности применения в лечении спастичности нижней конечности еще одного препарата, зарегистрированного в России с 2008 г., Incobotulinumtoxin A (Ксеомина). Последний представляет собой ботулинический нейротоксин типа А, продуцируемый штаммом бактерии Clostridium botulinum, освобожденным от комплексообразующих белков (инструкция по применению), обладающий высокой специфической биологической активностью [42] и хранящийся при комнатной температуре [43]. Он селективно воздействует на периферические холинергические нервные окончания, ингибируя выделение ацетилхолина в синаптическую щель. Конечным эффектом является расслабление инъецированной мышцы (инструкция по применению). Известны также и другие механизмы действия ботулотоксина.
Применение Incobotulinumtoxin A для лечения спастичности нижней конечности
За последние 5 лет в мире проведено несколько исследований с целью определения эффективности и безопасности применения Incobotulinumtoxin A для лечения спастичности нижней конечности.
Проспективное открытое исследование А. Santamato (2013), одним из первых продемонстрировало значимое снижение мышечного тонуса в течение 3 месяцев после иньекции Incobotulinumtoxin A в дозе до 180 ЕД в мышцы голени (медиальную и латеральную головки икроножной мышцы и камбаловидную мышцу) у больных после инсульта. Инъекции проводились с использованием методов ультразвукового и ЭМГ (электромиографического)-контроля [44]. После инъекции пациенты выполняли упражнения по растяжению инъецируемых мышц) в течение 5 дней. Помимо снижения мышечного тонуса было зарегистрировано увеличение угла пассивного тыльного сгибания стопы и уменьшение числа мышечных спазмов по шкале SFS. Высокий уровень удовлетворенности врачей и пациентов и низкий процент побочных эффектов отмечены и исследователями, и пациентами.
В том же, 2013 г., A. Santamato et al. [45] опубликовали результаты еще одного открытого проспективного нерандомизированного исследования, показавшего эффективность и безопасность применения высоких доз Incobotulinumtoxin A (до 750–840 ЕД) при одномоментных инъекциях в мышцы верхней и нижней конечностей у больных со спастическим гемипарезом (для мышц верхней конечности – до 540 ЕД, для мышц нижней конечности – 250–340 ЕД), с последующим проведением реабилитации в течение 10 дней. Было отмечено снижение мышечного тонуса и ассоциированной со спастичностью боли, улучшение функциональной независимости по шкале DAS (Disability Assessment Scale) преимущественно для верхней конечности: улучшение позы конечности (у 48%), облегчение проведения гигиены (у 16%) и одевания (у 12%); уменьшение боли (у 24%), а также о хорошей общей переносимости высоких доз препарата.
Результаты следующего исследования A. Santamato et al. опубликованные в 2017 г [46], стали логическим продолжением предыдущих. Была показана эффективность и безопасность Incobotulinumtoxin A при проведении многократных повторных инъекций в высоких дозах при мультифокальной спастичности верхней и нижней конечностей у пациентов после инсульта (общая доза достигала 840 ЕД: для верхней конечности – 430–560 ЕД, для нижней – 260–460 ЕД) с последующим проведением реабилитации в течение 10 дней. Результаты исследования опубликованы совсем недавно [46]. Дополнительные положительные результаты в виде уменьшения боли и повышение уровня функциональной независимости, высокая удовлетворенность результатами лечения, отсутствие побочных эффектов весьма важны для когорты пациентов, нуждающихся в повторяющихся курсах лечения и использовании доз, превышающих рекомендованные стандартами, существующими в каждой стране. Безопасное и длительное (37–63 иньекционных цикла) применение больших доз Incobotulinumtoxin A (400–1200 ЕД) для лечения спастичности верхней и нижней конечностей различной этиологии показано и в проспективном открытом исследовании D. Dressler et al. [47].
Крайне интересными и многообещающими явились результаты самого масштабного проспективного открытого нерандомизированного многоцентрового дозотитрационного трехфазного исследования TOWER (2017г), проведенного в нескольких странах мира, по безопасности и эффективности применения иньекций Incobotulinumtoxin A в дозе до 800 ЕД пациентами с мультифокальной спастичностью верхней и нижней конечностей [48]. В течение всего периода наблюдения (48 недель) с интервалом 12–16 недель было проведено 3 цикла инъекций с фиксированными максимальными дозами препарата: 400 ЕД, 600 и 800 ЕД. В каждом цикле оценивался паттерн спастичности, выбирались таргетные мышцы, определялись индивидуальные цели лечения.
Полученные результаты позволили сделат вывод об эффективности Incobotulinumtoxin A, что выразилось в снижении мышечного тонуса, увеличении объема пассивных движений в целевых мышцах конечностей, достижении индивидуальных целей и удовлетворенности результатами лечения пациентами и врачами. Безопасность использования высоких доз препарата подтверждена отсутствием серьезных побочных эффектов, нейтрализующих антител и развитием вторичной резистентности при увеличении дозы и повторных инъекциях, а также нормальными лабораторными показателями у всех пациентов на протяжении всего исследования. Все вышеизложенное позволило заключить, что наличие мультифокальной спастичности позволяет при необходимости безопасно использовать высокие дозы Incobotulinumtoxin А, увеличивая число инъецируемых мышц и паттернов, что хорошо переносится пациентами и приводит к улучшению качества их жизни.
Таким образом, проведенные исследования продемонстрировали хороший профиль безопасности и эффективности использования иньекций Incobotulinumtoxin A пациентами со спастичностью нижней конечности, а также высоких доз препарата при симультанном применении Incobotulinumtoxin A в верхнюю и нижнюю конечности.
Заключение
Реабилитация пациентов со спастическим парезом нижней конечности является трудной задачей как в отношении подбора оптимальных комбинаций реабилитационных методов, так и сроков ее проведения. Коррекция повышенного мышечного тонуса с помощью ботулинотерапии в целях улучшения походки и баланса, повышения безопасности хотьбы и предупреждения падений является необходимой частью реабилитации. Ряд проведенных в последнее время исследований позволяет обоснованно внедрять в реабилитационные схемы инъекции ботулотоксина, используя его в необходимых дозах, не опасаясь побочных эффектов. Хотя на сегодняшний день существует еще много нерешенных вопросов в отношении как выбора и оценки мышц, вовлекаемых в патологический паттерн, так и оптимальных доз ботулотоксина. Для ответов на них нужно время и проведение дальнейших исследований.



