Системная красная волчанка (СКВ) относится к числу наиболее распространенных и тяжелых системных заболеваний соединительной ткани, при котором легкие поражаются в среднем у каждого четвертого пациента [1]. Наиболее часто у больных СКВ встречается поражение плевры, реже – интерстициальные поражения легких в рамках хронического интерстициального поражения легких или люпус-пневмонита [2]. Люпус-пневмонит чаще встречается у больных молодого возраста, наиболее часто – в дебюте СКВ.
При активном течении СКВ возникает иммунодефицитное состояние, при котором резко возрастает риск возникновения инфекционных заболеваний, в т.ч. туберкулеза [3, 4]. Клинические проявления, данные инструментального обследования не всегда специфичны для СКВ, что может затруднять дифференциальную диагностику поражения легких.
Представленный клинических случай демонстрирует сложность постановки диагноза пациентке с поражением легких в варианте интерстициальных изменений, а также с поражением плевры и с тромбоэмболией мелких ветвей легочной артерии; важность выделения ведущего заболевания в связи с принципиально разными подходами к терапии при люпус-пневмоните и туберкулезе легких.
Клинический пример
Пациентка М.О. 23 лет, студентка 5-го курса медицинского вуза, живет в Санкт-Петербурге, предъявляет жалобы на одышку преимущественно инспираторного характера при умеренной физической нагрузке, мнестические нарушения. При объективном исследовании обращает на себя внимание резко ослабленное дыхание ниже углов лопаток; наличие линейного участка гиперпигментации внизу спины справа 5,0×1,0 см; шрам на брюшной стенке после спленэктомии.
С 12 лет (2006) страдает сахарным диабетом 1 типа, на настоящий момент присутствуют осложнения заболевания в форме диабетической ретино-, невро-, нефропатии (микроальбуминурия уровня А2), хронической болезни почек 0-й ст. (скорость клубочковой фильтрации – СКФ 99 мл/мин), кардиомиопатии; получает инсулин, контроль уровня глюкозы в крови достигнут. У больной отягощена наследственность по сахарному диабету (у брата сахарный диабет 1 типа). С 17 лет (с 2012 г.) стала отмечать нарушения менструального цикла в виде метроррагий. При проведении ультразвукового исследования (УЗИ) органов малого таза выявлены мультифолликулярные изменения обоих яичников, поставлен диагноз «синдром Штейна–Левенталя (синдром поликистозных яичников)», назначена терапия этинилэстрадиолом+дезогестрелом, которую больная получала в течение 6 месяцев.
В июле 2013 г. (в возрасте 19 лет) экстренно госпитализирована в отделение гематологии Александровской больницы Санкт-Петербурга в связи с геморрагическим синдромом. При обследовании: концентрация гемоглобина (Hb) – 45 г/л (при норме 115–145 г/л), число тромбоцитов – 7×109/л (при норме 180–380×109/л), поставлен диагноз «иммунная тромбоцитопатия». На фоне терапии глюкокортикостероидами (ГКС) и препаратами железа отмечена нормализация самочувствия, лабораторных показателей (Hb – 112 г/л, тромбоциты – 320×109/л, сохранялась повышенная СОЭ – 56 мм/ч (при норме 4–15 мм/ч). В сентябре 2013 г. выполнена стернальная пункция, в заключении: иммунная тромбоцитопения с поражением мегакариоцитов. В октябре 2013 г. в Александровской больнице выполнена спленэктомия в связи с сохраняющейся тромбоцитопенией (диагноз иммунной тромбоцитопатии подтвержден при выполнении исследования биоптата селезенки). В постоперационном периоде остро возникла одышка. Проведена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки, в заключении: тромбоэмболия ветвей легочной артерии (ТЭЛА) с поражением нижнедолевых ветвей правой и левой легочных артерий, сегментарных ветвей, инфаркт-пневмония нижних долей обоих легких, малый двусторонний гидроторакс. Диагноз был подтвержден ангиопульмонографией (тромбоэмболия низкого риска нижней ветви легочной артерии). На эхокардиограмме (ЭхоКГ) – без особенностей. Больной были назначены антикоагулянты, после выписки принимала варфарин в течение 2 месяцев.
При плановом проведении флюорографии в сентябре 2017 г. в верхней доле слева выявлено несколько фокусов неправильной формы без четких контуров, в одном из них – зона разрежения (деструкция?), справа отмечались усиление и деформация легочного рисунка, облитерирование синусов с обеих сторон. На снимке от августа 2016 г. – без особенностей. При выполнении компьютерной томографии (КТ) легких от 29.09.2017 в С1–2, С6 слева и в С6 и С10 справа определены инфильтраты с нечеткими контурами с полостями деструкции, в окружающих тканях – мелкие очаги. Активно жалоб не предъявляла. В связи с изменениями на снимке 03.10.2017 была госпитализирована для обследования и лечения в Городскую туберкулезную больницу № 2 (Санкт-Петербург) с диагнозом «диссеминированный туберкулез легких в фазе инфильтрации и распада». В анализах крови при поступлении обращают на себя внимание повышение СОЭ до 51 мм/ч и С-реактивного белка (СРБ) до 7,8 мг/л (при норме 0–5,0 мг/л), протеинурия (белок – 0,24 г в разовой порции мочи, при норме до 0,14 г/л); печеночные пробы без особенностей. При выполнении УЗИ органов брюшной полости выявлена гепатомегалия (левая доля – 9,3×6,2 см при норме 9,0×6,0).
Состояние при поступлении расценивалось как удовлетворительное, с 06.10.2017 начата противотуберкулезная терапия изониазидом, рифампицином в стандартных дозировках, с 11.10.2017 к схеме лечения добавлен левофлоксацин. Однократно 12.10.2017 выполнялось исследование промывных вод методом полимеразной цепной реакции (ПЦР) на GeneXpert MBT/Rif (Cepheid, США), обнаружена очень низкая концентрация микобактерий туберкулеза (103 КОЕ/мл), обнаружен ген устойчивости к рифампицину, в связи с чем с 18.10.2017 отменены изониазид и рифампицин, к терапии добавлен циклосерин. Лечение переносила удовлетворительно.
19.10.2017 возникли эпизод увеличения шейного лимфатического узла справа, лихорадка. Прокон-сультирована хирургом, поставлен диагноз «аденофлегмона», в тот же день произведено вскрытие аденофлегмоны и ее дренирование, при микроскопии кислотоустойчивые микобактерии обнаружены не были. С 20.10.2017 к схеме лечения добавлен препарат пара-аминосалициловой кислоты (ПАСК). С 25.10.2017 больная принимает следующие препараты: пиразинамид, линезолид, ПАСК, бедаквилин, моксифлоксацин.
С 01.11.2017 отмечено повышение температуры тела до 38,5–39,0°С с резистентностью к антипиретикам, увеличение шейного лимфатического узла справа. В анализах от 03.11.2017 обращает на себя внимание повышение активности трансаминаз (аланинаминотрансферазы [АЛТ] – 126 при норме 7–41 МЕ/л, аспартатаминотрансферазы [АСТ] – 91 при норме 10–38 МЕ/л), увеличение концентрации СРБ до 28 мг/л, снижение уровня общего белка до 60 мг/л, в клиническом анализе крови отмечается снижение СОЭ до 32 мм/ч; 05.112017 у больной резко ухудшилось состояние: появились гипогликемия, общая слабость, одышка, в связи с чем она была переведена в отделение реанимации и интенсивной терапии (ОРИТ). Произведена коррекция уровня гликемии, на фоне чего произошла нормализация общего самочувствия, однако 06.11.2017 остро развилась дыхательная недостаточность, нарушилось сознание (кома I), в связи с чем пациентка была переведена на искусственную вентиляцию легких. На рентгенограмме органов грудной клетки от 07.11.2017 определено утолщение костальной плевры справа, сглаживание реберно-диафрагмального синуса, появление выпота c обеих сторон, больше справа, нарастание инфильтративных изменений в легких, больше справа. При обследовании обращали на себя внимание лейкоцитоз до 10,35×109/л (при норме 4,0–8,8×109/л) с палочкоядерным сдвигом лейкоцитарной формулы (ПЯЛ до 46%, при норме 1–6%), СОЭ до 56 мм/ч, снижение концентрации гемоглобина до 97 мг/л (нормоцитарная анемия), повышение активности трансаминаз (АЛТ – 274, АСТ – 446 ЕД/л), увеличение концентрации СРБ до 189,6 мг/л. На УЗИ органов брюшной полости от 08.11.2017 выявлена гепатомегалия (левая доля – 11,9×9,2 см), асцит (350 мл жидкости внизу живота), жидкость в плевральном синусе справа (100 мл). Выполнено исследование ликвора: реакция Панди – положительная, реакция Нонне–Апельта – отрицательная, глюкоза – 4,9 (в венозной крови – 15,8 ммоль/л при норме 3,5–6,1 ммоль/л), хлориды – 110 (при норме 95–110 ммоль/л); посев ликвора – данных за микобактерии туберкулеза не получено. В ОРИТ проведены массивная дезинтоксикационная, неспе- цифическая антибиотикотерапия (моксифлоксацин, амоксиклав, кларитромицин), антикоагулянтная, антиагрегантная терапия, лечение ГКС (25 мг дексаметазона в сутки внутривенно, капельно), противотуберкулезная терапия (бедаквилин, пиразинамид) с положительной клинико-лабораторной динамикой.
Проведено обследование для исключения системного заболевания соединительной ткани (09.11.2017): антинуклеарный фактор – АНФ (на НЕр-2-клетках) 1:10240 (при норме менее 1:160), нуклеолярное свечение ядер, SS-A – 192, SS-B – 219, антитела к двуспиральной ДНК не обнаружены, компонент комплемента С3 и С4 снижен (0,31 и 0,02 г/л соответственно, при норме 0,75–1,65 и 0,13–0,54 г/л соответственно), антитела к кардиолипину не обнаружены.
В ОРИТ больная была осмотрена врачами-ревматологами, рекомендовано дообследование (исключение аспергиллеза, сепсиса, исключение коагулопатии, панель аутоантител). Выставлен предварительный диагноз (хроническое аутоиммунное заболевание), сделано предположение о наличии лекарственной СКВ на фоне противотуберкулезной терапии. Данных за болезнь Шегрена, системный васкулит не получено. Рекомендовано продолжить лечение туберкулеза, постепенно снизить дозировку дексаметазона до полной отмены.
На МСКТ органов грудной клетки от 13.11.2017 (рис. 1): уменьшение размеров инфильтратов легких, жидкость в правой плевральной полости, увеличение бифуркационных лимфатических узлов по сравнению с 29.09.2017, при описании специалистом рекомендовано проведение дифференциальной диагностики с целью исключения системного заболевания соединительной ткани, васкулита.
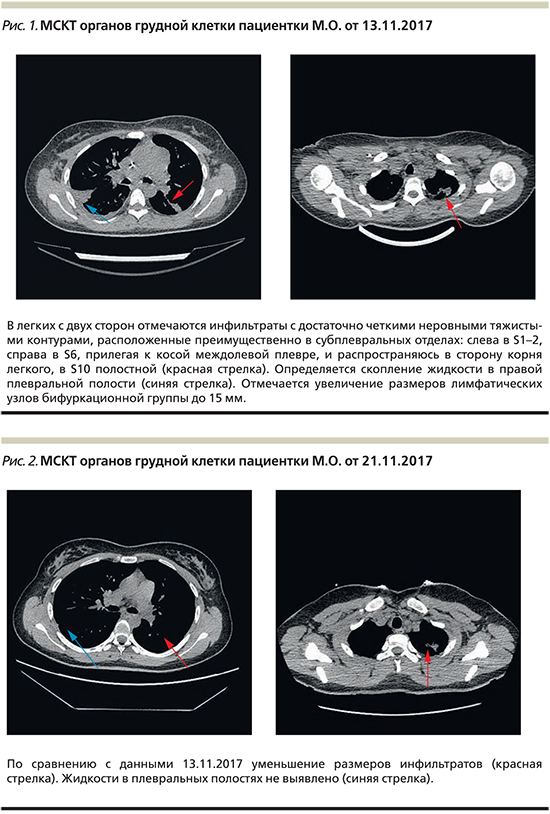
На фоне стабилизации состояния 13.11.2017 больная была экстубирована. В анализах крови – исчезновение лейкоцитарного сдвига, снижение СОЭ, СРБ до 23 мг/л, снижение активности трансаминаз (АЛТ – 126, АСТ – 91 ЕД/л). Из жалоб на первое место выходит одышка преимущественно инспираторного характера, возникающая при умеренной физической нагрузке, отмечаются мнестические нарушения.
На МСКТ органов грудной клетки от 21.11.2017 (рис. 2) по сравнению с КТ от 13.11.2017 уменьшение размеров инфильтратов легких, уменьшение количества жидкости в плевральной полости; после внутривенного усиления – картина ТЭЛА с наличием инфарктов в легких (дефекты контрастирования нижнедолевой ветви правой легочной артерии с распространением изменений на сегментарные и субсегментарные ветви А9 и А10, окклюзия нижнедолевой ветви левой легочной артерии с признаками реканализации). Вероятно, именно развитие ТЭЛА послужило причиной развития острой дыхательной недостаточности.
За время госпитализации неоднократно брались промывные воды из бронхов на микроскопию и посев – микобактерии обнаружены не были. Пациентка выписана 01.12.2017 по собственному желанию в связи с семейными обстоятельствами, продолжает принимать противотуберкулезную терапию по схеме варфарин 2,5 таблетки (с поддержанием МНО [международное нормализованное соотношение] на уровне 2,0–3,0).
В анализах крови от 01.12.2017: АНФ 1:5120, мелкогранулярное свечение ядер, антитела к экстрагируемому ядерному антигену положительные, антинейтрофильные антитела не обнаружены, антитела к двуспиральной ДНК не обнаружены, SS-A+, SS-B+, RNP-70+, Sm+, компонент комплемента С3 и С4 – в пределах нормы; антитела к фосфолипидам: антитела к кардиолипину не обнаружены, волчаночный антикоагулянт положительный, антитела к β2-гликопротеину – 37,14 ЕД/мл (при норме до 20,0).
При проведении дообследования исключен аспергиллез (отрицательный анализ на антиген Aspergillus, микроскопия и посев промывной жидкости из бронхов на грибы – мицелия гриба не обнаружено; консультирована микологом). Больная консультирована гематологом, проведена генодиагностика тромбофилий (фактор свертывания 2 и 5, ген MTHFR), не было выявлено клинически значимых генотипов. При выполнении магнитно-резонанасной томографии (МРТ) головного мозга с внутривенным контрастным усилением от 21.12.2017 данных за поражение сосудов головного мозга не обнаружено.
Были пересмотрены результаты КТ органов грудной клетки с помощью постпроцессинговой обработки и цветного картирования: участки инфильтрации в S6 и S10 связаны с преимущественно сосудистым компонентом (вариант васкулита), вероятно, на фоне системного заболевания соединительной ткани. Участки инфильтрации в S1–2 связаны с вторичным процессом (вероятно, инфекционной природы).
25.12.2017 проведен консилиум с целью постановки диагноза, решения вопроса о дальнейшей тактике лечения. Диагноз туберкулеза не вызывает сомнений с учетом определения в промывных водах методом ПЦР микобактерии туберкулеза, определения инфильтратов с очагами распада в характерных для заболевания сегментах легких (S1–2), а также данных за вторичное поражение в указанных сегментах, полученных при цветном картировании снимков КТ.
В итоге в качестве основного поставлен диагноз «диссеминированный туберкулез легких в фазе инфильтрации и распада (mbt отрицат., GeneXpert положит., резистентность к рифампицину)». В качестве сопутствующих диагнозов: 1. «СКВ, хроническое течение с поражением серозных оболочек (плеврит, асцит), поражением легких (инфильтративные изменения), тромбоцитопенией, иммунологическим синдромом (АНФ+, ENA+, гипокомплементемия, антифосфолипидные антитела), вторичным антифосфолипидным синдромом (повторная ТЭЛА от 2013 г., 2017 г.), активность 1». 2. «Сахарный диабет 1 типа, компенсированный инсулинотерапией, осложненный диабетической ретино-, невро-, нефропатией в стадии микроальбуминурии А2, хронической болезнью почек 0-й ст. (СКФ – 99 мл/мин), кардиомиопатией». 3. «Очаговая склеродермия вне обострения».
4. «Синдром поликистозных яичников. 5. Спленэктомия от 2013 г. (по поводу аутоиммунной тромбоцитопении)».
Больной было рекомендовано продолжение противотуберкулезной терапии. В рамках терапии СКВ не рекомендовано использование цитостатиков или ГКС до разрешения основного заболевания. Назначен препарат гидроксихлорохина в стандартной дозировке в качестве базисной терапии СКВ. Рекомендовано продолжить терапию варфарином (с поддержанием МНО в пределах 2,0–3,0) неопределенно длительное время, продолжить терапию сахарного диабета. Не рекомендовано применение комбинированных пероральных контрацептивов в связи с повышением риска тромботических осложнений.
При удовлетворительном ответе на противотуберкулезную терапию и разрешении инфильтративных изменений в легких будет возможным усиление иммуносупрессивной терапии для снижения клинико-иммунологической активности СКВ. С учетом хронического течения СКВ и невысокой активности данного заболевания прогноз пациентки представляется удовлетворительным.
Обсуждение
Плеврит является одним из наиболее частых экстрапульмональных проявлений при туберкулезе [5]. Туберкулезный плеврит чаще всего характеризуется односторонним поражением, склонностью к осумковыванию. Поражение брюшины при туберкулезе встречается достаточно редко, возникает при гематогенном распространении инфекционного процесса из очагов в легких на фоне иммунодефицитного состояния (наиболее часто у больных ВИЧ, у больных хронической почечной недостаточностью на гемодиализе) и обычно сопровождается поражением мезентериальных лимфатических узлов [6]. Поражение плевры при СКВ – наиболее частое проявление поражения органов грудной клетки, характеризуется чаще двусторонним поражением, быстрым ответом на малую дозу ГКС и/или антималярийных препаратов (гидроксихлорохин, хлорохин) [5, 7]. Вовлечение брюшины в патологический процесс может возникать в рамках поражения серозных оболочек при СКВ, хотя встречается достаточно редко [8].
У больной не было обнаружено увеличения мезентериальных узлов, выявлялся двусторонний плеврит с быстрым разрешением на фоне терапии (в т.ч. ГКС), причем данные изменения были обнаружены практически одновременно (УЗИ брюшной полости выполнялось 08.11.2017, рентгенологическое исследование органов органов грудной клетки 07.11.2017), что дает основание предполагать аутовоспалительную природу серозита в рамках СКВ.
Необходимо отметить, что нередко у больных туберкулезом в крови идентифицируются серологические маркеры СКВ и антифосфолипидного синдрома (в т.ч. АНФ, антитела к экстрагируемому ядерному антигену, антифосфолипидные антитела) [9]. Однако тромбоцитопения, обнаруженная у больной в 2013 г., могла быть клиническим симптомом дебюта СКВ, хотя обследования на аутоантитела не проводилось до 2017 г.
Поэтому предположение о вторичной природе СКВ, вызванной приемом противотуберкулезной терапии (чаще всего возникает на фоне приема изониазида), пришлось отвергнуть. Также у больной в крови определены антитела к Sm-антигену и снижение концентрации компонентов системы комплемента, что происходит в редких случаях лекарственной волчанки [10, 11].
Поражение легких в рамках СКВ было подтверждено при проведении цветного картирования КТ-снимков легких [12]. На фоне проведения противотуберкулезной терапии и лечения дексаметазоном отмечена положительная клиническая динамика и динамика по снимкам КТ (уменьшение инфильтрации). Однако ответ на терапию не может в данном случае быть диагностически значимым в связи с тем, что терапия была комбинированной (как противовоспалительная/иммуносупрессивная, так и антибактериальная). Поражение центральной нервной системы в рамках СКВ не было подтверждено данными инструментального исследования (МРТ с контрастированием сосудов – не получено данных за васкулит головного мозга). Вероятно, мнестические нарушения оказались следствием нахождения в критическом состоянии, сопровождавшемся комой. Таким образом, диагноз СКВ устанавливается как на основании классификационных критериев SLICC (Systemic Lupus International Collaborating Clinics) от 2012 г. (наличие иммунной тромбоцитопении, серозиты, +АНФ, +Sm, +антитела к фосфолипидам [АФА – антифосфолипидные антитела: антитела к β2-гликопротеину-1, волчаночный антикоагулянт], снижение компонентов комплемента), так и ACR (American College of Rheumatology) от 1997 г. [13].
Диагноз вторичного (возникшего на фоне СКВ) антифосфолипидного синдрома (АФС) выставляется на основании классификационных критериев от 2006 г. (Сидней) с учетом наличия повторной ТЭЛА мелких ветвей и наличия диагностически значимых титров АФА [14]. АФА могут определяться в крови больных туберкулезом без признаков системного заболевания соединительной ткани и исчезать после выздоровления, однако в данном случае первым клиническим проявлением АФС была ТЭЛА, возникшая до заболевания туберкулезом и рецидивировавшая повторно в 2017 г. В дальнейшем стоит уточнить стойкость титра АФА: для соответствия критериям АФС необходимо проведение двукратного анализа на антитела с разницей не менее 3 месяцев, и в случае повторно высоких титров АФА – диагноз вторичного АФС не будет вызывать сомнений [15].
Заключение
Поражение легких при СКВ у больного туберкулезом может вызывать диагностические трудности. Единственным методом визуализации и дифференциальной диагностики васкулита сосудов легких служит постпроцессинговая обработка и цветное картирование снимков КТ. С учетом различия в тактике лечения больных с СКВ в зависимости от наличия конкурирующих заболеваний следует подходить с осторожностью к назначению цитостатиков в спорных ситуациях.


