Введение
Дегенеративные заболевания суставов занимают значимое место среди причин временной и стойкой утраты трудоспособности, ранней инвалидизации населения, снижения качества жизни (КЖ), потребности в госпитализации [1, 2].
В настоящее время остеоартрит (ОА) рассматривается как гетерогенная группа хронических дегенеративно-воспалительных заболеваний со сходными прогрессирующими морфологическими изменениями суставного комплекса (хряща, субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц), которые приводят к снижению функциональной активности больного и дестабилизации коморбидных состояний [3].
ОА обычно характеризуется полиартикулярным поражением суставов, однако наиболее типичной локализацией являются коленные (гонартроз) и тазобедренные (коксартроз) суставы [4]. По данным недавнего эпидемиологического исследования, в Российской Федерации поражение коленных суставов встречается в 92% случаев, тазобедренных – в 42%, суставов кистей – в 38% [5]. Встречаясь у 11–23% населения земного шара коксартроз, по статистике 2011 г., в России зарегистрирован у 3,7 млн больных [6], занимая второе место после гонартроза по частоте, но лидирует по срокам временной и стойкой нетрудоспособности [7].
Особенно значимо нарушение функции сустава определяется в группах пациентов с III–IV стадиями гонартроза и коксартроза, что сопровождается стойкой утратой физической активности, трудоспособности и в большинстве случаев развитием стойкого болевого синдрома, требующего постоянного применения анальгетиков и нестероидных противовоспалительных средств (НПВС) [8, 9] с риском развития осложнений. «Золотым» стандартом лечения пациентов данной группы является эндопротезирование, которое значительно улучшает КЖ пациентов [10]. Ежегодно в мире выполняется свыше 40 тыс. эндопротезирований коленных суставов, а потребность в протезировании тазобедренных суставов достигает 300 тыс. в год [11].
В настоящее время разработаны рекомендации ESC/ESA (European Society of Cardiology/European Society of Anaesthesiology) по предоперационному обследованию и ведению пациентов с отдельными заболеваниями при выполнении внесердечных хирургических вмешательств [12], но в них нет четких рекомендаций в отношении пациентов с заболеваниями суставов по выбору предоперационной терапии, ее объему и длительности. При оценке тяжести суставной патологии и выборе оперативного лечения оценивается состояние наиболее пораженного сустава, между тем статус других (коморбидных) суставов имеет также большое значение для активного реабилитационного процесса в послеоперационный период, т.к. они подвергаются повышенной нагрузке и создают определенный вклад в дестабилизацию психологического состояния пациентов.
Целью исследования стал анализ особенностей поражения основных и коморбидных суставов и возможности их коррекции под влиянием диацереина у пациентов, включенных в список ожидания для эндопротезирования коленных и тазобедренных суставов.
Методы
В сравнительном исследовании участвовали пациенты с гонартрозом и коксартрозом 3–4-й стадий, включенные в лист ожидания для проведения эндопротезирования, подписавшие информированное согласие на проведение исследования. Методом конверта пациенты были распределены в 2 группы вмешательства: 1-я – 25 человек с гонартрозом и 2-я группа – 25 человек с коксартрозом, получавших дополнительную терапию диацереином и нимесулидом. Группы сравнения составили 15 пациентов с коксартрозом и 15 больных гонартрозом, которым специального предоперационного лечения не проводили. Диагноз «остеоартрит» устанавливали на основании традиционных признаков с учетом рекомендаций Института ревматологии РАМН, Российской ассоциации ревматологов, Американской коллегии ревматологов [13–16].
Мы ограничили возраст пациентов для включения в исследование промежутком от 50 до 65 лет, обязательным было также отсутствие предшествовавших оперативных вмешательств на суставах и позвоночнике, перенесенных остеопоротических переломов и признаков тяжелого остеопороза по данным денситометрии. Кроме того, обязательным считалось стабильное течение артериальной гипертензии (при ее наличии) на фоне адекватно подобранной антигипертензивной терапии, которая не менялась на протяжении 3-месячного наблюдения за пациентами.
Из исследования исключали пациентов с коксартрозом и гонартрозом I–II стадий по Kellgren [17] с наличием сложных нарушений ритма и проводимости, выраженными заболеваниями почек, декомпенсированными и компенсированными эндокринными расстройствами и наличием заболеваний, препятствующих проведению оперативного вмешательства.
Пациентам 1-й и 2-й групп дополнительно назначали диацереин (Артрокер Микро Лабс Лимитед (Индия) по 50 мг/сут 2 недели, затем по 100 мг/сут 3 месяца. Для купирования болевого синдрома рекомендовали использовать нимесулид (Нимулид PANACEA BIOTEC [Индия]) в дозе 100–200 мг/сут в режиме «по требованию». Нимесулид был выбран в качестве наиболее удобного из НПВС в связи с его быстрым эффектом, удобным дозированием и достаточно высоким профилем безопасности [18, 19].
Анализировали КЖ по визуальной аналоговой шкале (ВАШ), оценивали динамическое изменение альго-функционального индекса Лекена (Lequesne) для гонартроза и коксартроза [20], индекса WOMAC (Western Ontario end McMaster Universitiens) [21], представляющего собой опросный лист, содержащий 24 вопроса, отражающих выраженность болезни (5 вопросов), скованность (2 вопроса), функциональную способность (17 вопросов). Оценивали как суммарные показатели, так и отдельные составляющие этих индексов, выраженность болевого синдрома, потребность в применении НПВС, состояние реактивной и личностной тревожности по анкете Спилбергера в модификации Ханина [22]. Приведенные выше исследования проводили в отношении суставов, в которых планировалось оперативное вмешательство, и коморбидных суставов. Под термином «коморбидный сустав» понимали симметричный коленный или тазобедренный сустав, в котором оперативное лечение на данный период не планировалось.
Статистический анализ выполнен с использованием пакета прикладных программ Statistica v.6.1 (StatSoft Inc., США). Применяли методы параметрической и непараметрической статистики, корреляционный анализ. Данные представлены в виде средних величин и стандартного отклонения (М±SD). Различия считали значимыми при р<0,05.
Результаты исследования
С учетом ограниченного выбора пациентов по возрастному цензу группы вмешательства и сравнения были идентичными в начале наблюдения по основным параметрам здоровья и основным изучаемым показателям.
В процессе наблюдения мы не выявили значимых изменений оцениваемых показателей у больных в группах сравнения, однако показатель реактивной тревожности как в группе коксартроза, так и гонартроза имел тенденцию к увеличению. Анализ полученных данных (см. таблицу) позволяет обратить внимание на состояние коморбидных суставов.
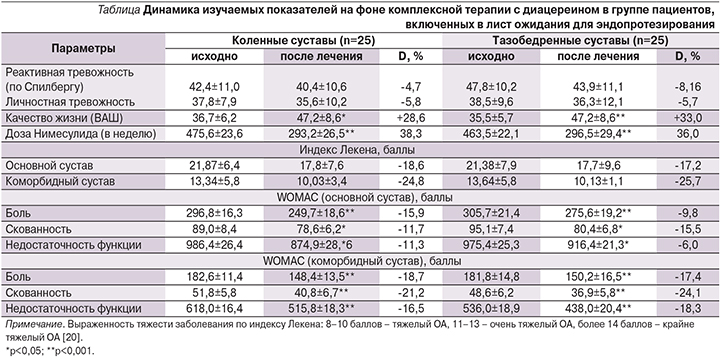
Установлено, что у пациентов с гонартрозом сумма баллов тяжести заболевания по основному суставу составила 21,87±6,4, что соответствует очень тяжелому остеоартриту, а в коморбидном суставе этот показатель также характеризовал тяжелый артрит – 13,34±5,8 балла. Лечение с дополнительным применением диацереина позволило уменьшить тяжесть заболевания в основном суставе до 17,8±7,6 балла, что оставалось в пределах той же группы очень тяжелого состояния, тогда как в коморбидном суставе тяжесть остеоартрита по индексу Лекена снизилась на 24,8% и составила 10,03±3,4 балла, что уменьшило градацию тяжести заболевания на один разряд. Аналогичная ситуация отмечена и в отношении динамики индекса Лекена по оценке тяжести поражения тазобедренного сустава. При исходных значениях в основном суставе 21,38±7,9 балла определено его снижение до 17,7±9,6 балла (снижение на 17,2%), при этом в коморбидном суставе уменьшение индекса Лекена достигало 25,7% (с 13,64±5,8 до 10,13±1,1 балла). В начале наблюдения выявлены более низкие значения показателей индекса WOMAC (боль, скованность движений и недостаточность функции) в коморбидном суставе (как коленном, так и тазобедренном), что в целом логично (см. таблицу). Наличие и прогрессирование болевых ощущений у пациентов с суставной патологией играют важную роль в социальной дезадаптации пациентов с коксартрозом и гонартрозом и снижение ее выраженности или полное устранение служат основной целью при планировании эндопротезирования [23].
Динамическое наблюдение за пациентами в процессе дополнительно проводимой терапии позволило установить хорошую переносимость диацереина и высокую приверженность лечению всех пациентов. Эти результаты совпадают с данными других авторов, показавших наличие побочных эффектов, отмеченных у 35,7–45,1% пациентов [24].
В целом в нашем наблюдении по двум группам (коксартроз и гонартроз) побочные эффекты определены у 5 (10%) пациентов в виде послабляющего эффекта в 3 случаях (не потребовавших отмены препарата) и легкой тошноты у 2 пациентов, которые продолжили терапию. В исследованиях других авторов также отмечались такие побочные эффекты, как частый жидкий стул, диарея, гастралгии, которые в большинстве случаев прекращались по мере продолжения приема препарата и не имели клинической значимости, но достигали частоты до 42% [25, 26]. Многие авторы отмечают дозозависимое проявление побочных эффектов, что определило оптимальной суточную дозу диацереина не выше 100 мг [27, 28].
Изменений со стороны лабораторных показателей на протяжении всего периода наблюдения за нашими пациентами не выявлено. Определена тенденция к снижению значений фибриногена и С-реактивного белка, которые находились в пределах референсных значений. Согласно данным литературы, не было также зарегистрировано изменений лабораторных показателей, оценивавших функцию почек и печени [29].
Все наблюдаемые пациенты, принимавшие диацереин, отметили уменьшение выраженности болевых ощущений к концу первого месяца терапии, что выразилось в постепенном снижении потребности в применении НПВС. Суммарно в подгруппе гонартроза недельная доза нимесулида снизилась с 475,6±23,6 до 293,2±26,5 мг (на 38,3%), а в подгруппе коксартроза – с 463,5±22,1 до 296,5±29,4 мг (на 36,0%).
При анализе показателей, составляющих индекс WOMAC (см. рисунок), отмечена интересная закономерность: наряду с уменьшением выраженности болевых ощущений и чувства скованности при движении как в основном, так и в коморбидном суставе практически все пациенты обратили внимание на увеличение подвижности суставов, в которых планируется вмешательство. Так, в группе гонартроза боль, скованность и недостаточность функции снизились в основном суставе на 15,9% 11,7 и 11,3% соответственно, при этом в коморбидном суставе эти сдвиги были более выраженными и достигали 18,7% 21,2 и 16,5% соответственно. У пациентов с коксартрозом боль, скованность и нарушение функции изменялись в положительную сторону: на 9,8% 15,5 и 6,0% соответственно в основном суставе и на 17,4% 24,1 и 18,3% соответственно в коморбидном (см. таблицу).
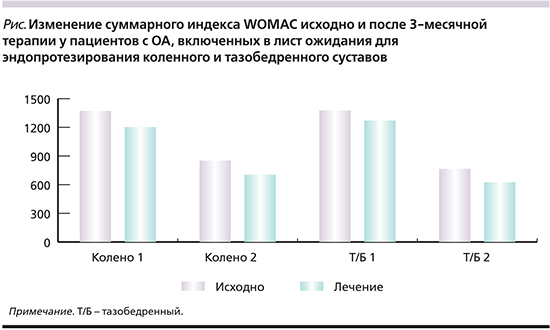
Данную ситуацию мы склонны объяснить уменьшением выраженности болевого синдрома в коморбидном суставе и увеличением объема движений в них, что в целом создает эффект улучшения функциональной активности.
Мы полагаем, что в случаях, когда пациенты не уверены в своем согласии на оперативное вмешательство, возможно проведение пробного 3-месячного курса терапии диацереином с оценкой эффекта от проводимой терапии в числовом выражении по ВАШ или с использованием индекса WOMAC, что позволит объективизировать потребность оперативного вмешательства в случае отсутствия существенного изменения объективных параметров или возможности продолжить комбинированную противовоспалительную терапию с хондропротективным действием при получении хорошего ответа.
В нашем наблюдении не выявлено потребности в коррекции артериального давления у пациентов с признаками гипертонической болезни, которые получали подобранную антигипертензивную терапию.
Все пациенты отметили улучшение КЖ по ВАШ: в группе коксартроза – на 33,0%, в группе гонартроза – на 28,3%. Вместе с тем уровень личностной тревожности не претерпел достоверных изменений в обеих группах обследованных пациентов, хотя показатель личностной тревожности снизился в группе коксартроза на 8,1%, в группе гонартроза – на 4,7%. По-видимому, длительный предшествующий период заболевания и предстоящее оперативное вмешательство налагают свой отпечаток и требуют более длительного наблюдения.
Обсуждение
В настоящее время можно считать доказанной значимую патогенетическую роль воспалительного процесса, затрагивающего все структуры сустава в формировании и прогрессировании дегенеративных изменений в суставах [30, 31]. В данном аспекте повышается роль противовоспалительной терапии в коррекции скорости формирования и тяжести дегенерации хрящевой ткани и подхрящевых структур. Особое внимание привлекают препараты с противовоспалительным влиянием через такой многофункциональный цитокин, каким является интерлейкин-1 (ИЛ-1), экспрессируемый в пораженном остеоартритом хряще. Именно этот цитокин стимулирует выработку хондроцитами и другими клетками матриксных металлопротеиназ (ММПs: коллагеназы – ММП-1, -8, -13; аггреканазы – ADAM-TS4 и -TS5; стромелизин-1 – ММП-3 и желатиназы – ММП-2, -9) и тормозит активность ингибиторов ММПs, синтез коллагена и протеогликанов, простагландинов и лейкотриенов, опосредующих воспалительные процессы [32]. В качестве препаратов, блокирующих воспалительные реакции указанного типа, наибольший интерес представляют недостаточно используемые в клинической практике диацереины, включенные в рекомендации по лечению ОА практически всех ревматологических общественных профессиональных организаций [33–35]. Вместе с тем вопрос об эффективности воздействия диацереина на болевые и функциональные показатели суставного процесса у пациентов в предоперационный период перед эндопротезированием опорных суставов остается открытым. С учетом полученных нами результатов, показавших возможность уменьшения выраженности болевых ощущений посредством использования диацереина, создаются условия, позволяющие снизить потребность в использовании НПВС и анальгетиков, что повысит безопасность подготовки пациентов к оперативному вмешательству.
Фармакокинетика диацереина (ацетилированная форма реина) хорошо изучена: при приеме внутрь он быстро абсорбируется и превращается в активный метаболит реин, полностью связывается с белками плазмы (>90%). Пиковая концентрация в плазме достигается через 15–30 минут, период полувыведения реина составляет 4,2 часа после приема первой дозы 50 мг и возрастает до 7,5 часа после девятого приема препарата с 12-часовым интервалом. Выводится реин преимущественно почками: 20% – в неизмененном виде, 60% – в виде глюкуронида и 20% – в сульфатированной форме. Рекомендуется прием диацереина во время еды, что повышает его абсорбцию. В эксперименте доказано положительное действие диацереина в условиях гипоксии хрящевой ткани с воздействием на поверхностные и глубокие структуры хрящевой ткани [36, 37].
Выявлена также способность диацереина снижать коцентрацию ИЛ-1 в синовиальной жидкости и увеличивать синтез гиалуроната синовиальными клетками [28, 38, 39]. Структурно-модифицирующее действие препарата показано на различных моделях ОА у животных [40, 41]. Получены также доказательства клинической эффективности диацереина в двойных слепых плацебо-контролируемых исследованиях [39, 42].
Представляет интерес влияние диацереина на состояние минеральной плотности костной ткани, изученное на модели овариоэктомированных крыс, у которых он снижал уровни щелочной фосфатазы и гидрооксипролина мочи [40], данный факт имеет дополнительное положительное значение для предоперационной подготовки пациентов к эндопротезированию.
Важным преимуществом диацереина является его способность значимо улучшать симптомы болезни по сравнению с плацебо, практически равное действию НПВС по выраженности противовоспалительного и анальгетического эффектов, но с выраженным последействием без развития тяжелых побочных эффектов, характерных для НПВС [43, 44].
Таким образом, проведенное нами исследование позволило установить выраженные изменения не только в суставах, для которых запланирована оперативная коррекция, но и в симметричных (коморбидных) суставах, значимость которых в постоперационной реабилитации пациентов с коксартрозом и гонартрозом несомненна. Наше наблюдение обращает внимание на возможность улучшения функциональных показателей в коморбидных суставах на фоне дополнительного применения диацереина у пациентов, включенных в лист ожидания для эндопротезирования. Дополнительным эффектом проведенного лечения в предоперационном периоде можно считать некоторое снижение выраженности тревожных состояний, что значимо в аспекте положительной эмоциональной окраски подготовительного предоперационного периода.
Заключение
Среди пациентов, включенных в лист ожидания для эндопротезирования коленных и тазобедренных суставов в связи с остеоартритом, в большинстве случаев состояние коморбидных суставов также достигает тяжелых стадий по классификации альго-функционального индекса Лекена. Применение в предоперационном периоде диацереина позволяет уменьшить выраженность болевого синдрома как в основном, так и в коморбидном суставе и снижает потребность в применении НПВС более чем в 2 раза. Определено существенное улучшение функции коморбидного сустава как в группе коксартроза, так и гонартроза, что должно уменьшить степень тяжести повреждений этих суставов в реабилитационный период после оперативного вмешательства.
«Пробная» 3-месячная терапия диацереином может быть предложена пациентам, сомневающимся в необходимости проведения оперативного вмешательства с целью выявления реабилитационного потенциала терапевтических вмешательств.


