Введение
По данным Всемирной организации здравоохранения, самой распространенной вирусной инфекцией половых путей является вирус папилломы человека (ВПЧ), который передается главным образом при половых контактах и при тесном генитальном контакте без проникновения [1].
Сегодня идентифицировано около 200 различных типов ВПЧ, которые в свою очередь классифицированы на 2 группы с низким и высоким онкогенным риском в зависимости от их способности вызывать злокачественные поражения, включая карциному шейки матки [2, 3]. Типы низкого риска (ВПЧ 6, 11, 40, 42, 43 и 44) связаны с развитием доброкачественных поражений, таких как бородавки, в то время как типы высокого риска (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 66) связаны с процессом канцерогенеза [4, 5]. Деятельность последних может приводить к развитию неоплазий (дисплазии I–III степеней) шейки матки (62%); преинвазивного и инвазивного рака шейки матки (38%); остроконечных кондилом половых органов и мочевых путей (51%) [6–8].
Распространенность ВПЧ в мире достигает 10%, в основном болеют женщины в возрасте до 35 лет [9]. В Европе показатель распространенности ВПЧ составляет 0,75–3%, в США – 1% [10]. Соотношение частоты встречаемости заболевания среди мужчин и женщин составляет 2,7:1 [11]. В то же время риск прижизненного заражения ВПЧ составляет от 50 до 80% [12] и, по оценкам зарубежных исследователей, у 90% лиц с наличием ВПЧ генитальные бородавки не проявляются клинически, но пациент является источником распространения вирусной инфекции [13].
Аногенитальные бородавки, возникающие в результате действия ВПЧ, являются одной из самых частых и распространенных патологий аногенитальной области, передающейся половым путем [5, 14]. Такие доброкачественные поражения почти в 90% случаев связаны с генотипами ВПЧ низкого риска типов 6 и 11. Однако в некоторых исследованиях показано, что онкогенные генотипы 16 и 18 также могут являться причиной кондиломных поражений (в 12% случаев) [15].
Кроме того, несмотря на всю доброкачественность, ВПЧ 6 и 11 могут вызывать респираторный папилломатоз (болезнь, при которой опухоли вырастают в дыхательных путях, ведущих из носа и рта в легкие) и возникновение тяжелых поражений вплоть до предраковых и злокачественных новообразований аногенитальной локализации [16].
Одной из особенных опухолей является гигантская кондилома Бушке–Левенштейна (ГКБЛ), которая считается предраковым заболеванием кожи полового члена [9]. ГКБЛ – чрезвычайно редкая, доброкачественная, медленнорастущая, локально разрушающая опухоль с бородовчатоподобными элементами типа папиллом, сливающимися между собой и образующими очаг поражения с широким основанием [17–19].
Хотя это и доброкачественное новообразование, зачастую оно в своем местном проявлении, подобно злокачественной опухоли, распространятся на кожные структуры, инфильтрирует окружающие ткани и даже при условии своевременной терапии часто рецидивирует в сроки от 2 до 12 лет после возникновения заболевания [20, 21].
Предрасполагающими факторами для агрессивного поведения ВПЧ и как следствие – возникновения гигантской кондиломы могут быть хроническая травматизация, несоблюдение правил личной гигиены, наличие других инфекций, передающихся половым путем, и выраженная иммуносупрессия на фоне всевозможных факторов (прием лекарственных препаратов, хронические заболевания в стадии суб-/декомпенсации, ВИЧ-инфекция, операции и др.) [17].
Лечение ГКБЛ можно разделить на 3 направления: местная терапия (с использованием 5-фторурацила, подофиллина), удаление опухолевой ткани (хирургическим методом, криодеструкцией с жидким азотом, углекислым лазером, электрокаутеризацией) и иммунотерапия (системное или внутриочаговое введение интерферонов, применение имиквимода) [22, 23]. Однако результаты лечения далеки от идеальных, поскольку риск локальных рецидивов составляет 67%, а летальность при возникновении осложнений достигает 20–30% [24]. Основным методом лечения является хирургический, направленный на широкое иссечение опухоли в пределах здоровых тканей. Эффективность химио- и/или лучевой терапии на сегодняшний день остается под вопросом [25].
Клинический пример
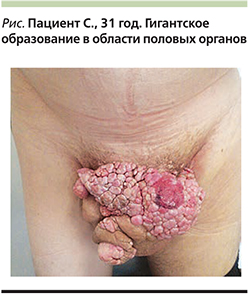 Под нашим наблюдением находился пациент С. 1986 г. рождения, который в мае 2017 г. обратился в Центр дерматологии п профилактики болезней, передающихся половым путем, (Астана, Республика Казахстан), с жалобами на образование в области полового члена, мошонки; боли в области образований; неприятный запах (см. рисунок).
Под нашим наблюдением находился пациент С. 1986 г. рождения, который в мае 2017 г. обратился в Центр дерматологии п профилактики болезней, передающихся половым путем, (Астана, Республика Казахстан), с жалобами на образование в области полового члена, мошонки; боли в области образований; неприятный запах (см. рисунок).
Анамнез болезни: считает себя больным в течение 5 лет, когда впервые отметил появление мелких папуллезных высыпаний на коже лобковой области через некоторое время после проведенной хирургической процедуры удаления пахового лимфатического узла. Далее стал замечать интенсивный рост и слияние элементов с формированием крупного конгломерата. Неоднократно обращался к специалистам (дерматологам, хирургам, онкологам), однако в лечении было отказано в связи с рисками развития осложнений на фоне первичного заболевания лимфатической системы.
Анамнез жизни: состоит на диспансерном учете с диагнозом «диффузный лимфангиоматоз. Лимфедема верхних и нижних конечностей. Лимфаденопатия узлов шеи, брюшной полости». Удаление шейного лимфатического узла в 1997 г., удаление пахового лимфатического узла в 2012 г. Туберкулез, вирусные гепатиты отрицает. Наследственность не отягощена. Непереносимости каких-либо лекарственных препаратов или пищевых продуктов не отмечает.
Объективный статус при поступле-нии: общее состояние удовлетворительное. Частота дыхательных движений – 18 в 1 минуту, АД – 120/70 мм рт.ст., пульс – 72 удара в 1 минуту удовлетворительного наполнения и напряжения, температура тела – 36,5°С. Нормостеник. В легких дыхание везикулярное, хрипы отсутствуют. Тоны сердца ясные, деятельность сердца ритмичная. Живот при пальпации мягкий, безболезненный. Нижний край печени не выступает из-под реберной дуги. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание затруднено, сопровождается неприятными ощущениями жжения и болезненности. Стул оформленный, 1 раз в день.
Локальный статус: патологический процесс локализован в области полового члена, мошонки. Представлен крупным образованием размером с «детскую голову», 27×18 см. Очаг располагается на широком основании, поверхность его неравномерно бледно-розового цвета, шероховатая, мацерирована, поделена на дольки, что придает ей характерный вид «цветной капусты». На некоторых участках имеются эрозивные очаги ярко-розового цвета, обильно выделяющие экссудат. В межпапиллярных бороздах скапливается отделяемое неприятного запаха.
В амбулаторно-поликлинических условиях проведено следующее обследование: реакция Вассермана – отрицательно; ИФА на ВИЧ – отрицательно; ПЦР на ВПЧ-6 – отрицательно, ВПЧ-11 – отрицательно, ВПЧ-16 – положительно.
На основании жалоб пациента на наличие крупного образования в области полового члена, мошонки; анамнеза заболевания (первичное появление мелких папуллезных высыпаний на коже лобковой области с дальнейшим интенсивным ростом и слиянием элементов с формированием крупного конгломерата), характерного локального статуса и результатов проведенных лабораторных исследований (обнаружение ВПЧ-16) выставлен клинический диагноз «гигантская остроконечная кондилома Бушке–Левенштейна».
В связи с большими размерами образования (27×18 см), наличием первичного заболевания «диффузный лимфангиоматоз. Лимфедема верхних и нижних конечностей. Лимфаденопатия узлов шеи, брюшной полости», отягощающего течение кожного процесса, и очевидной неэффективностью консервативных лечебных мероприятий сделано заключение, что пациент не подлежит госпитализации и наблюдению в условиях кожно-венерологических диспансеров.
Даны следующие рекомендации:
- Консультация онколога с последующим решением вопроса о хирургическом лечении и профилактике рецидивов.
- Консультация ангиохирурга, флеболога по поводу первичного заболевания.
- Тотальное иссечение гигантских кондилом с криодеструкцией раневых поверхностей в наиболее ранние сроки.
Было отмечено, что в случае отказа от проведения иссечения образования возможно прорастание опухоли в органы малого таза с последующей деструкцией либо малигнизация с перерождением в карциному.
В июне 2017 г. пациенту была проведена обширная хирургическая операция с тотальным иссечением гигантской кондиломы в условиях Онкологического центра Астана с последующим назначением препарата имиквимод 5%-ный крем (1 раз в день 3 дня в неделю, продолжительность – 16 недель) после полного послеоперационного восстановления кожного покрова. Дальнейшая судьба пациента неизвестна.
Обсуждение
ГКБЛ – это разновидность остроконечной кондиломы, которая развивается на фоне иммуносупрессии и отличается быстрым экзофитным и эндофитным ростом, а также высоким риском злокачественной трансформации (более 50%) [26]. В случае нашего пациента агрессивное распространение вирусной инфекции и рост кондилом связаны не только с причинным ВПЧ-16, но и с развитием иммунодефицита на фоне имеющегося хронического заболевания лимфатической системы. Диффузный лимфангиоматоз – орфанное заболевание, в основе которого лежит малоизученный порок развития лимфатической системы, характеризующийся аномальной пролиферацией и разрастанием лимфатических структур, расширением лимфатических каналов с последующим формированием щелей и полостей [27]. Последние выстланы эндотелием и заполнены хилусом. Системные проявления лимфангиоматоза включают множественные образования в виде полостей или кист в области шеи, средостения и брюшной полости, легочное интерстициальное утолщение и литические поражения костей. Два наиболее частых проявления этого заболевания – хилоторакс и хилоперикардиум [28]. Помимо лимфангиоматоза состояние данного пациента осложняет наличие лимфедемы конечностей, в результате которой нарушается трофика тканей, возникают риски изъязвлений, формирования свищевых ходов, развития флегмон.
В случае отказа от хирургического лечения ГКБЛ оказывает фатально деструктивное действие, распространяясь не только на органы малого таза, но и в костные структуры [29].
Многими авторами это вид патологии расценивается сегодня как один из региональных подтипов веррукозной карциномы, при которой лечебный вариант выбора – радикальное хирургическое удаление, позволяющее провести полное гистологическое обследование и оценку опухолей без резекции [30]. Другие адъювантные методы лечения, такие как лазер, лучевая терапия, интерферон-альфа или имиквимод, могут представлять интерес для предотвращения последствий калечащих хирургических вмешательств [31].
Заключение
Несмотря на доброкачественную природу образования, ГКБЛ может протекать агрессивно с интенсивным ростом, приобретая признаки злокачественной опухоли с разрушением окружающих тканей или органов. На сегодняшний день для достижения клинического улучшения состояния пациента и повышения качества его жизни методом выбора в лечении гигантских кондилом является радикальное хирургическое иссечение в тандеме с другими методами терапии, такими как криодеструкция, лазеротерапия, наружные и системные иммуномодулирующие средства и др.


