Введение
В настоящее время во всем мире наблюдается рост числа аллергических заболеваний среди разных возрастных групп населения. Достигнуты значительные успехи в диагностике и лечении бронхиальной астмы (БА) у детей, однако ряд вопросов сохраняет свою актуальность. В практической деятельности основное внимание уделяется фармакотерапии: использование лекарственных средств позволяет купировать приступ, способствует стабилизации состояния, но в то же время не приводит к полному выздоровлению. Необходимость длительного применения базисной терапии, развитие побочных эффектов, высокая стоимость лечения являются недостатком медикаментозного лечения [1, 2]. Учитывая представленные факты, применение только фармакотерапии является недостаточным для лечения и реабилитации детей, страдающих БА [3].
Эффективность физиотерапевтических методов при аллергических заболеваниях подтверждается положительной динамикой клинической картины заболевания, а также результатами лабораторных исследований [4]. Известно, что ультразвук, являясь фактором физической природы, индуцирует широкий спектр иммунологических эффектов. Наиболее выраженное влияние на показатели иммунного статуса проявляются при воздействии на область проекции иммунокомпетентных органов и в ряде случаев носят разнонаправленный характер [5]. Согласно литературным данным, у пациентов с БА воздействие ультразвуком способствует улучшению клинической картины заболевания, аускультативно уменьшается количество сухих хрипов, снижается коэффициент бронхообструкции [6, 7]. Влияние ультразвука малой интенсивности на легочную ткань проявляется повышением функциональной активности клеток и усилением иммунологических и защитных реакций организма [8].
Метод аутосеротерапии заключается во внутрикожном введении пациенту собственной сыворотки крови, полученной, как правило, на высоте обострения заболевания. Введение сыворотки в организм пациентам с аллергическими заболеваниями способствует его «десенсибилизации» к соответствующим биологически активным веществам. При этом наблюдаются как местный, так и системный иммунокорригирующие эффекты. Предполагают, что при этом в организме синтезируются антитела к уже имеющимся в сыворотке крови антителам к определенному антигену, т.е. наблюдается идиотип-антиидиотипическое взаимодействие. Этот процесс лежит в основе «десенсибилизации» [9, 10].
Таким образом, комбинирование ультразвука с аутосеротерапией будет как способствовать положительной динамике клинической картины БА, так и воздействовать на патогенез заболевания, улучшая показатели иммунного статуса.
Цель работы – изучение клинической и иммунологической эффективности использования ультразвука в сочетании с аутосеротерапией детей с атопической БА.
Материал и методы
В обследование были включены 64 ребенка в возрасте от 6 до 18 лет. Всем пациентам установлен диагноз атопической БА на основании международных рекомендаций [11] и с учетом результатов лабораторных, инструментальных, аллергологических обследований. Исследование проходило по протоколу открытого контролируемого исследования в параллельных группах пациентов на фоне стандартной терапии основного заболевания (этический комитет, протокол № 3 от 11.05.2017). В качестве базисной терапии, согласно международным консенсусам и протоколам лечения, применялись ингаляционные глюкокортикостероиды (иГКС) в низких дозах, а также короткодействующие β2-агонисты по потребности. Пациентов, включенных в исследование, разделили на 2 группы. Дети группы А получали ультразвук на область селезенки в комбинации с аутосеротерапией на фоне базисного лечения. Пациенты группы В получали базисную терапию. Ультразвуковое лечение в комбинации с аутосеротерапией проводили по следующей схеме (табл. 1) [12].
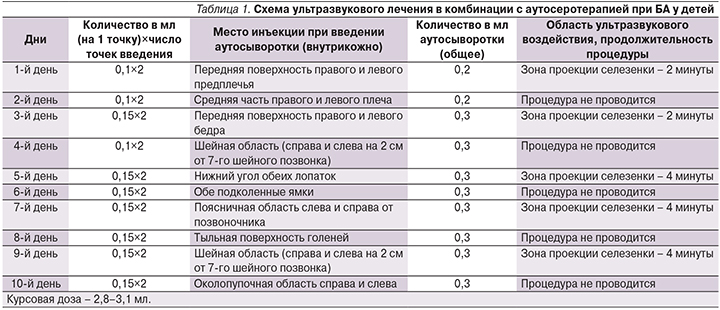
Для проведения физиотерапевтического лечения использовали аппарат ультразвуковой терапии, работающий на частоте 880 кГц (1000 кГц) в импульсном режиме мощностью 0,2 Вт/см2 [12].
С целью изучения клинико-иммунологической эффективности проводимой терапии анализировали следующие показатели:
- уровень контроля БА;
- базисная терапия за 6 месяцев наблюдения;
- фенотип базофилов: уровень CD203с+, CD203с+CD63+, CD203с+IgE+ базофилов.
Фенотипирование клеток проводили на проточном цитометре Cytomics FC 500 (Beckman Coulter Inc., США) с использованием моноклональных антител производства ОДО «НИКП РЕСАН», Беларусь. Для лизиса эритроцитов использовали лизирующий раствор OptiLyse С.
Пакет прикладных программ Statistica 6.0 применяли для статистической обработки данных. Вид распределения количественного признака определяли на основании критерия Шапиро–Уилка. При нормальном распределении для описания признака использовали такие параметры, как среднее значение и среднее квадратическое отклонение. Для анализа этих переменных применяли параметрические методы статистического анализа. При распределении признака, отличного от нормального. использовали медиану и интерквартильный интервал. Использовались непараметрические методы статистического исследования: критерий Манна–Уитни (для анализа различий в двух независимых группах по количественному признаку), критерий Вилкоксона (для анализа различий в двух зависимых группах по количественному признаку). Различия считали достоверными при р<0,05.
Результаты исследования
Обследованы 64 ребенка с атопической БА, которые составили 2 группы пациентов, сопоставимых по полу и возрасту (р>0,05) (табл. 2).

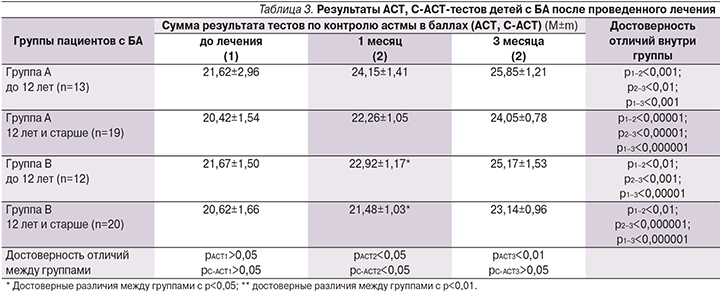
Статистически значимые отличия в группе А среди детей старше 12 лет по результатам теста АСТ выявлены через 1 и 3 месяца от начала лечения по сравнению с исходным уровнем (р<0,01). У детей этого возраста, получавших только базисную терапию (группа В), также наблюдалось повышение контроля заболевания. Достоверные отличия установлены через 1 и 3 месяца от начала терапии по сравнению с исходным уровнем (р<0,01). В ходе исследования установлено, что у детей с БА старше 12 лет в обеих группах наблюдалось повышение контроля заболевания, однако в группе А результаты теста АСТ через 1 и 3 месяца были достоверно выше, чем у детей группы В (рАСТ2<0,05; рАСТ3<0,01) (табл. 3).
В младшей возрастной группе среди детей в возрасте от 6 до 12 лет наблюдалась следующая динамика теста С-АСТ. В группе А установлены статистически значимые отличия через 1 месяц (р<0,001), достоверный рост этого показателя наблюдался и через 3 месяца (р<0,001). У пациентов в группе В уровень контроля БА повышался в течение трех месяцев исследования (р<0,01). При сравнении результатов теста С-АСТ в обеих группах следует отметить, что в группе А результат теста С-АСТ через 1 месяц был статистически значимо выше, чем в группе В (рА2–В2<0,05), что свидетельствует о более раннем достижении контроля в группе детей, получавших наряду с базисным лечением ультразвук с аутосеротерапией (табл. 3).
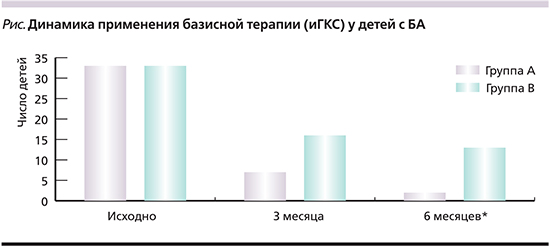
Анализируя базисную терапию детей, получавших ультразвук в сочетании с аутосеротерапией, установлено, что через 3 месяца от начала исследования отмена иГКС стала возможной для 25 пациентов, 7 детей продолжили прием в прежней дозе. Через 6 месяцев у 5 пациентов базисная терапия прекращена в связи с отсутствием приступов. Группе А не потребовалось увеличения дозы иГКС, а также назначения второго лекарственного средства в качестве базисной терапии. В группе В через 3 месяца от начала исследования 16 пациентам отменили прием иГКС. Через 6 месяцев еще 6 детей прекратили прием базисной терапии, однако у 2 пациентов, не получавших базисную терапию, увеличилось число эпизодов бронхообструкции, ухудшились показатели функции внешнего дыхания. Это послужило причиной назначения иГКС. Таким образом, число детей, нуждавшихся в базисной терапии через 6 месяцев от начала лечения, в группе В было статистически значимо выше, чем в группе А (р<0,05) (см. рисунок).
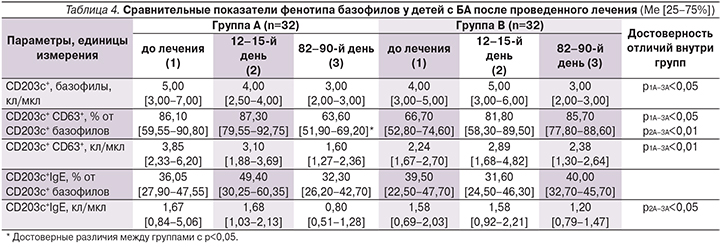
В ходе работы изучали показатели иммунного статуса детей с БА. Наблюдалась следующая динамика фенотипа базофилов в процессе исследования. При определении уровня CD203c+ базофилов в группе А установлены статистически значимые различия через 82–90 дней по сравнению с исходным уровнем (р1–3<0,05). В группе А статистически значимые отличия установлены в динамике относительного уровня CD203c+CD63+ базофилов при втором и третьем определениях по сравнению с предыдущими показателями (p1–3отн.<0,05; p2–3отн.<0,01). Установлено достоверное уменьшение числа этих клеток. Статистически значимое снижение выявлено и при определении абсолютного уровня CD203c+CD63+ базофилов в группе А через 82–90 дней по сравнению с исходным уровнем (p1–-3абс.<0,01). Достоверных отличий в динамике относительного уровня базофилов, несущих CD203c+CD63+-рецептор, в группе В не установлено. Абсолютный уровень CD203с+IgE+ базофилов статистически значимо снижался через 82–90 дней от начала исследования в группе А по сравнению с уровнем этого показателя при втором определении (p2–3абс.<0,05). При сравнении показателей в двух группах между собой установлено, что относительный уровень CD203c+CD63+ базофилов статистически значимо ниже в группе А по сравнению с группой В через 82–90 дней (табл. 4).
Обсуждение
Согласно Международным рекомендациям, целью лечения БА является достижение и поддержание контроля заболевания. Контроль БА означает контроль клинических проявлений заболевания. Однако цель лечения не только достигнуть контроля, но и удержать его длительное время. В ходе нашей работы установлено, что сочетание немедикаментозных методов с базисной терапией позволяет улучшить клиническую картину заболевания, а также достичь контроля в более короткие сроки. В то же время число детей, нуждавшихся в базисной терапии, через 6 месяцев от начала лечения в группе В статистически было значимо выше, чем в группе А, а продолжительность базисной терапии детей, получавших ультразвук в сочетании с аутосеротерапией, значительно меньше.
В последние годы появляются новые данные о роли базофилов в иммунной защите, а также о значении этих клеток в патогенезе аллергических заболеваний. Установлено, что тучные клетки могут потенциально вызывать ремоделирование бронхов как непосредственно через собственные эффекты, так и косвенно через эозинофилы и T-лимфоциты [13]. Являясь одними из основных клеток в индукции БА, базофилы инфильтрируют слизистую оболочку дыхательных путей под воздействием аллергена. Выявленные особенности отражают аллергический фенотип заболевания [14]. В настоящее время рассматривают возможность определения числа активированных базофилов как новый и информативный тест для выявления аллергии и псевдоаллергии [15, 16]. В ходе исследования установлено, что в результате проведенного лечения у пациентов, получавших ультразвук с аутосеротерапией, наблюдалось снижение относительного и абсолютного уровней базофилов, несущих CD203с+CD63+-рецептор. В этой группе детей статистически значимо изменялся и абсолютный уровень CD203с+IgE базофилов.
Следует отметить, что снижение уровня активированных базофилов сопровождалось положительной динамикой клинической картины БА. Рассматривая иммунологические данные в совокупности с показателями уровня контроля заболевания, сопоставляя результаты в обеих группах, можно говорить о том, что коррекция иммунных нарушений необходима, т.к. воздействие на патогенез заболевания улучшает и клиническую картину БА. С другой стороны, показатели фенотипа базофилов могут служить маркером эффективности терапии, учитывая четкую взаимосвязь механизмов развития БА и симптомов заболевания.
Заключение
Так, применение ультразвука в сочетании с аутосеротерапией в отношении детей с атопической БА способствует более быстрому достижению контроля заболевания, сокращению сроков использования базисной терапии, изменяет фенотип базофилов, снижая проаллергические показатели.


