Введение
Вирусная инфекция занимает ведущую позицию в этиологии острых заболеваний верхних и нижних дыхательных путей среди изначально здоровых людей любого возраста. У пациентов с хроническими заболеваниями бронхолегочной системы вирусная инфекция способствует обострению процесса [1].
В детской популяции значимую роль играют острые состояния, сопровождающиеся обструкцией верхних дыхательных путей (ВДП). Наличие лихорадки часто помогает выделить группу инфекционных заболеваний.
А появление симптоматики с рождения характерно для детей с врожденной аномалией развития органов дыхания. Однако на практике вирусные инфекции не всегда сопровождаются высокой температурой, дебют врожденной патологии не всегда наблюдается с рождения, да и другие дыхательные расстройства у детей первых 3 лет жизни могут возникать внезапно, без какой бы то ни было явной причины. Поэтому как педиатры, так и средний медицинский персонал в острой педиатрии должны быть максимально насторожены относительно возможности изменения ситуации за считанные секунды с развитием тяжелого респираторного дистресс-синдрома, в т.ч. с летальным исходом [2].
Медицинским работникам, особенно амбулаторного звена, которые реже сталкиваются с тяжелыми острыми состояниями, необходимо постоянно повышать квалификацию, в т.ч. в специализированных симуляционных центрах, с целью обеспечения своевременной диагностики обструкции ВДП для улучшения качества оказания помощи. Подобная тактика уже неоднократно себя оправдывала как в России, так и в других странах [3, 4].
Наиболее частым симптомом патологии любого отдела респираторного тракта является кашель. Часто только на основании тембра, частоты, времени возникновения кашля можно с высокой вероятностью подозревать то или иное заболевание.
Среди большой группы кашляющих детей ярко выделяются пациенты со стенозом гортани. Клиническая картина типичного ларингостеноза достаточно характерна: стридор, инспираторная одышка, осиплость и грубый кашель. Для его характеристики используют разные термины: «звонкий», «лающий», «гортанный», но услышав, спутать его ни с чем нельзя. Однако в клинической практике приходится иметь дело с совершенно разными ситуациями. Иногда в стационар поступают дети с типичным нетяжелым стенозом, которые дома получали неприемлемую терапию. А иногда дети с кажущейся типичной клинической картиной ларинготрахеита несколько по-другому «звучат» или их состояние не улучшается на стандартной терапии, тогда необходимо исключать другую патологию верхних дыхательных путей.
Круп
Одна из наиболее частых причин респираторного дистресса у детей младшего возраста – острое воспаление слизистой оболочки гортани и трахеи. За исключением небольшого процента ситуаций причиной воспаления является инфекция, что сопровождается гиперемией, отеком, некрозом и отторжением эпителия [5].
С учетом диаметра просвета гортани ребенка даже небольшой отек слизистой оболочки приводит к значительному концентрическому сужению ее поперечного сечения [6]. Дети компенсируют это более частым и глубоким дыханием. По мере прогрессирования процесса усилие, затрачиваемое на вдох, приводит к обратному результату: поток воздуха в гортани становится турбулентным, на вдохе стенки подскладочного пространства смыкаются. Появляется характерная клиническая симптоматика: инспираторный стридор, осиплость, грубый «лающий» кашель. Быстрое прогрессирование стеноза без своевременной помощи приводит к невозможности синхронизировать дыхательные движения мышц грудной клетки и живота. Ребенок быстро истощается, развивается гипоксия и гиперкапния с респираторным дистрессом и возможным летальным исходом [6, 7]. Ларинготрахеит, ларинготрахеобронхит и спастический круп входят в синдром крупа у детей [6].
Эпидемиология
Как было указано выше, основной причиной воспаления слизистой оболочки гортани и трахеи является инфекция, в подавляющем большинстве случаев вирусная. Наиболее распространенными респираторными вирусными патогенами принято считать человеческий риновирус, RS (респираторно-синцитиальный)-вирус, грипп, адено-, коронавирус. Однако сравнительно небольшое внимание уделялось человеческому вирусу парагриппа, тропному к слизистой оболочке респираторного тракта, чаще приводящему к заболеванию детей первого года жизни и пациентов с иммунодефицитными состояниями. У изначально здоровых взрослых парагрипп сопровождается нетяжелыми симптомами поражения верхних дыхательных путей. Но именно с этим вирусом ассоциируется круп, особенно его тяжелое течение [1].
Парагрипп – РНК-вирус, относящийся к парамиксавирусам. Циркулирует обычно поздней осенью или ранней весной, но спорадические случаи могут регистрироваться в течение всего года. Круп чаще всего связан с 1-м, 2, 3 и 4-м серотипами [8]. Например, во Вьетнаме у детей до 2 лет при крупе чаще всего выделялись серотип 1 и 3 (р<0,005) [9].
Интересно, что 1-й тип в основном циркулирует раз в 2 года, а 2-й и 3-й – ежегодно [10].
Не вызывает сомнений, что по крайней мере до 75% случаев крупа связано с вирусом парагриппа [11, 12].
Реже он провоцируется другими респираторными вирусами: RS-, грипп А, метапневмо-, аденовирус [8]. Еще реже ряд авторов указывает на роль Mycoplasma pneumoniae, коронавируса, энтеро-, риновирусов, вируса кори, эпидемического паротита. Не стоит забывать о т.н. истинном крупе, связанном с Сorynеbacterium diphtheriaе [13].
По данным отделения диагностики и восстановительного лечения ФГАУ ННПЦЗД МЗ РФ, среди госпитализированных детей причиной крупа в 72% случаев был вирус парагриппа, далее практически с одинаковой частотой были выделены RS- и аденовирус, лишь у 2% детей – вирус гриппа А [14].
С таким широким кругом возбудителей и чрезвычайной распространенностью респираторных вирусов связана и высокая заболеваемость. Каждый год круп переносят около 3% детей [12].
Например, в США ежегодно по поводу стенозирующего ларинготрахеита госпитализируется 8481 ребенок в возрасте до 5 лет, т.е. 0,4 на 1000 детей в год, что обходится в 58 млн долл. Бóльшая часть случаев приходится на детей в возрасте до 2 лет [10].
Есть данные, согласно которым круп почти в 2 раза чаще возникает у мальчиков, преимущественно в возрасте от 6 месяцев до 3 лет с пиком на втором году жизни. Однако описаны случаи заболевания у детей 3 месяцев и подростков [8, 15].
Клиника
Как правило, ларинготрахеит протекает нетяжело и купируется без каких бы то ни было активных вмешательств. Поэтому большинство детей могут получать лечение в домашних условиях. Однако в части случаев происходит быстрое прогрессирование отека подскладочного пространства, что может приводить к опасной для жизни обструкции [12].
В Канаде до 4% детей с крупом госпитализируются по тяжести состояния, более того – 1 на 170 госпитализированных детей требует интубации и вспомогательного дыхания [16].
По другим данным, до 9% детей (средний возраст – 18 месяцев) нуждались в интенсивной терапии, при этом у 3% круп рецидивировал в течение 30 дней [7].
Продолжительность интубации по поводу тяжелого крупа может составлять до 60 часов, и 30% случаев ассоциированы с вирусом парагриппа. У 6,5% детей можно ожидать повторного ухудшения состояния после экстубации, что, по данным ряда авторов, не связано ни с длительностью интубации, ни с массой тела/возрастом ребенка [17].
Тяжелое течение стеноза, сопровождающееся снижением сатурации менее 95%, а также наличие интубации в анамнезе достоверно повышают продолжительность пребывания в стационаре (р<0,05) [18].
В классическом варианте первые симптомы крупа возникают внезапно – обычно вечером или ночью, что, по-видимому, связано с циркадными ритмами уровня кортизола в сыворотке, который нарастает с 23.00 до 04.00 с пиком концентрации в 8 утра. Изредка симптомы могут прогрессировать в течение дня. У ребенка появляются грубый кашель, иногда с металлическим оттенком, инспираторный стридор, осиплость, обычно при невысоком уровне температуры. Стридор обычно присутствует только на вдохе. При стремительном ухудшении он также проявляется на выдохе с развитием смешанной одышки. Однако до появления клинически значимого дистресса проходит не менее нескольких часов, которые позволяют принять меры для улучшения состояния ребенка [8].
Длительность заболевания в 60% случаев не превышает 2 суток, редко у некоторых пациентов симптомы могут сохраняться до 5–6 дней. Стенозу гортани в течение 24–48 часов могут предшествовать неспецифические проявления респираторной вирусной инфекции: лихорадка, ринит, кашель [8, 12].
При классическом течении диагноз крупа не вызывает сомнений и может быть установлен на основании данных анамнеза и физикального осмотра без проведения дополнительного обследования. В случае сомнений, отсутствия должного ответа на лечение или развития тяжелого дистресс-синдрома выполняют анализы крови и рентгенографию грудной клетки [7, 19].
Несмотря на отсутствие рекомендаций к проведению вирусологического, бактериологического исследований для подтверждения этого диагноза, в США, например, анализ более 6000 соответствующих историй болезни показал почти 5-кратное превышение числа назначений дополнительных методов исследования или препаратов [20].
Дифференциальная диагностика
Круп следует дифференцировать с состояниями, сопровождающимися стридором и внезапной обструкцией ВДП: эпиглоттит, бактериальный трахеит, инородное тело дыхательных путей или пищевода, заглоточный или перитонзиллярный абсцесс, травма дыхательных путей, дифтерия, ангионевротический отек, спазмофилия, ожог едкими веществами [7].
Не по частоте, но по тяжести течения и возможных нежелательных последствий при инспираторной одышке необходимо исключать эпиглоттит – острое бактериальное воспаление или флегмону надгортанника. В большинстве случаев эпиглоттита удается выделить Haemophilus influenzae типа b, значительно реже – стрепто- и пневмококки.
Для него характерны внезапное начало всегда с высокой лихорадкой, дисфагия, саливациия, токсикоз, тревожность. Голос приглушенный, но нет осиплости и типичного для крупа «лающего» кашля. Обычен особый низкий звук на выдохе и умеренный инспираторный стридор. Заболевают, как правило, дети старшего возраста. Однако с началом вакцинации против гемофильной палочки и пневмококка случаи эпиглоттита стали встречаться реже [7].
Вообще современное здравоохранение связывает большие надежды с вакцинопрофилактикой в плане значительного снижения заболеваемости пневмонией, крупом и бронхиолитом у детей первого года жизни [10].
При подозрении на флегмону надгортанника ни в коем случае нельзя беспокоить ребенка, фарингоскопию необходимо проводить с чрезвычайной осторожностью, не касаясь шпателем корня языка и особенно надгортанника, чтобы не спровоцировать его резкий отек. Поэтому эту манипуляцию лучше проводить без шпателя или в присутствии реаниматолога, готового к интубации. Также при подозрении на эпиглоттит нельзя осуществлять седацию и ингалировать, поэтому при невозможности полностью исключить вирусный круп лучше дать гормон внутрь. Пациент обязательно госпитализируется для пристального наблюдения с готовностью к интубации, экстренно начинается парентеральное введение антибиотика [7, 21].
В Корее было проведено исследование, призванное выявлять дифференциальные критерии вирусного крупа и эпиглоттита. Кроме описанных выше признаков было выявлено отношение мальчиков к девочкам при крупе 1,9:1, при эпиглоттите – 2,3:1, средний возраст составил 2,2–2,0 и 5,6–5,8 года соответственно. Сезонность крупа регистрировалась с пиком в июле, эпиглоттита – в мае. В обеих группах наблюдались кашель, лихорадка и диспноэ. Но при эпиглоттите диспноэ, боль в горле и рвота встречались достоверно чаще (p<0,05) [15].
Одним из альтернативных диагнозов при инспираторном стридоре может быть бактериальный трахеит. Тяжелая бактериальная инфекция, требующая лечения, возможно, может осложнять круп. Обычно бактериальный трахеит начинается с внезапного ухудшения симптомов после эпизода крупа с резким повышением температуры, токсикозом и неэффективностью ранее проведенной терапии. Состояние чревато окклюзией дыхательных путей из-за выраженной продукции вязкого секрета. Лечение проводится в стационаре и включает парентеральную антибактериальную терапию и мониторинг дыхания. Иногда может потребоваться интубация с респираторной поддержкой [7, 21].
Инородное тело дыхательных путей или пищевода, так же как и вирусный круп, чаще всего встречается у мальчиков в возрасте до 3 лет. Если родители не отметили эпизода внезапного закашливания на фоне полного здоровья, в дальнейшем жалобы могут быть самыми разнообразными: длительный кашель, бронхообструкция, дисфагия или снижение аппетита, а также стридор. В доступной литературе представлено множество публикаций, посвященных случаям ларинготрахеита на фоне инородного тела. Например, случай крупа, длившегося неделю при инородном теле гортани [22], или некупируемый в течение 2 недель круп и снижение аппетита у 20-месячного мальчика с последующим извлечением косточки мушмулы из пищевода [23].
Гемангиома дыхательных путей часто протекает с инспираторным стридором [24].
Дифференциальный диагноз вирусного стеноза гортани также проводится с заглоточным абсцессом, термическим или химическим ожогом дыхательных путей, ангионевротическим отеком и другими состояниями.
Вирусный и рецидивирующий круп
Ранее уже упоминалось, что к синдрому крупа у детей относят ларинготрахеит, ларинготрахеобронхит, остро возникшие на фоне вирусной инфекции. Выделяют также спастический, или рецидивирующий, круп [6], который не всегда связан с вирусной инфекцией и необязательно сопровождается продромой или лихорадкой. Развивается внезапно, также обычно ночью, как правило, быстрее заканчивается, но часто рецидивирует.
Несмотря на то что оба вида крупа хорошо известны и давно описаны, до сих пор практически не встречается публикаций, основанных на рандомизированных доказательных исследованиях с хорошим дизайном, представляющих четкий алгоритм дифференциальной диагностики этих состояний [5].
Спастический и вирусный круп – патогенетически разные состояния с одинаковой симптоматикой. Поэтому рецидивирующий круп не может быть диагнозом и требует верификации этиологического фактора [24].
Существуют данные, что спастический круп чаще встречается у детей с бронхиальной астмой или атопией. При наличии отягощенного аллергологического анамнеза или у детей, угрожаемых по развитию бронхиальной астмы, рецидивы крупа также могут протекать на фоне респираторной вирусной инфекции. Однако считается, что в такой ситуации отек слизистой оболочки возникает не в ответ на инфекцию, а как аллергическая реакция на вирусный антиген. При этом рутинное исследование иммуноглобулина Е (IgE) у детей с рецидивирующим крупом не показало своей целесообразности [7, 26].
Кроме того, доказано, что у большой части детей с рецидивами стеноза гортани провоцирующим фактором является гастроэзофагеальный рефлюкс [27]. По разным данным, частота рефлюкса колеблется от 20 [28] до 60% [29] и практически все дети хорошо отвечают на антирефлюксное лечение (р=0,006) [30].
Такая частота рефлюкса позволила применить тактику эмпирического назначения антирефлюксной терапии при рецидивирующем крупе даже в отсутствие иной клинической симптоматики. Авторы такого мнения считают возможным избежать излишнего инвазивного и дорогостоящего эндоскопического обследования в случае успешного ответа [27].
Некоторые анатомические особенности также могут стать причиной повторных эпизодов стеноза гортани.
Американский обзор, включивший 885 соответствующих пациентов, которым была проведена диагностическая бронхоскопия, показал, что наряду с рефлюкс-эзофагитом и атопией, не сопровождавшимися значимыми эндоскопическими изменениями, в 8,7% случаев была выявлена серьезная патология. К таким находкам были отнесены трахеобронхомаляция, постинтубационный рубцовый стеноз гортани, а также анатомически узкое подскладочное пространство. Значимые эндоскопические изменения также коррелировали с возрастом младше 3 лет (отношение шансов [ОШ]=3,22, 95% доверительный интервал [ДИ] – 1,66–6,27), c возрастом младше 1 года (ОШ=2,86, 95% ДИ –1,28–6,40) и недоношенностью (ОШ=2,90, 95% ДИ – 1,39–6,06) [28,31].
Эти данные сопоставимы с результатами других опубликованных исследований, показавших четкую связь серьезных эндоскопических изменений с интубацией в анамнезе (р=0,002) [27] и (р=0,003) [29], а также возрастом младше 3 лет (р=0,01) [27] и (р=0,013) [29].
Ряд авторов указывает на то, что число рецидивирующих крупов, причина которых может быть не выяснена, доходит до 45% [30].
Маляция ВДП также может сопровождаться хроническим течением стридора [21].
С одной стороны, органические изменения гортани и трахеи встречаются в популяции не так часто, с другой – дети этой категории должны быть выделены из общей массы и тщательно обследованы ввиду необходимости индивидуальной тактики их ведения [24].
Оценка степени тяжести
Для оценки степени тяжести крупа в России до последнего времени использовалась шкала В.Ф. Ундрица 1969 г., в которой выделяют 4 стадии острого стеноза гортани по наличию и выраженности клинических проявлений.
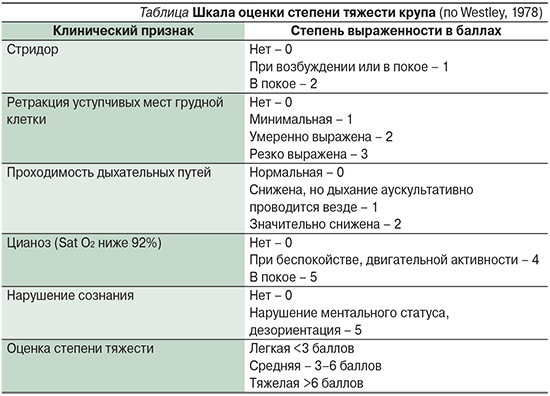
В зарубежной литературе круп оценивается по не менее известной 3-балльной шкале Westhley 1978 г. (Тhe Westhley Croup Score). Степень тяжести определяется исходя из суммы баллов (максимум 17) в зависимости от выраженности отдельных симптомов (см. таблицу) [32]. В ежедневной практике этой шкалы вполне может быть достаточно, т.к. она отражает наиболее яркие клинические проявления заболевания и витальные показатели [33].
Заблуждения
Увлажненный кислород. Более 100 лет детей с крупом лечили увлажненным воздухом. До сих пор в некоторых стационарах применяют многочисленные кислородные палатки, паровые ингаляции и т.д. Помимо того что эти манипуляции неудобны и вызывают негативизм со стороны ребенка, его излишнее беспокойство, доказано, что значимого улучшения состояния на фоне такого лечения не происходит (А) [34, 35].
Опубликованы результаты исследования, включившего 140 детей с крупом тяжелого и среднетяжелого течения. Дети были разделены на три группы с учетом способа лечения: 1-я группа – в качестве плацебо использовали ингаляции кислорода (по влажности он сопоставим с комнатным воздухом), 2-я группа – кислородом, увлажненным до 40%, и 3-я группа – кислородом, увлажненным до 100%. Значимых различий в длительности заболевания, необходимости госпитализации и дополнительных назначений не наблюдалось [36].
Результаты исследования, проведенного в ОДВЛ ННПЦЗД, также давно показали, что улучшений симптомов крупа, таких как кашель, одышка, беспокойство, не происходит при ингаляциях увлажненного воздуха [37].
Поэтому в кислороде нуждаются только дети с гипоксией, сатурацией кислорода крови ниже 92% и тяжелым дистресс-синдромом. Кислород никогда не подается ребенку насильно, т.к. это приводит к излишнему возбуждению. Если ребенок отказывается от ингаляций, маску с хорошей подачей кислорода можно просто положить рядом с его лицом [38].
Однако, поскольку стеноз гортани, как правило, развивается ночью, родители начинают паниковать, не зная, чем помочь ребенку. Поэтому в рекомендациях оказания помощи в домашних условиях, например до приезда бригады скорой медицинской помощи, значатся горячий пар, пребывание на холодном воздухе 10–15 минут, отвлечение, успокоение ребенка, выпаивание маленькими глотками напитков со льдом до нескольких раз в течение часа. Запрещается давать препараты от кашля и курить в присутствии ребенка [39].
Гелий. Также для лечения активно назначались ингаляции гелия. Считалось, что благодаря его низкой плотности нивелируется турбулентность в суженном просвете гортани и уменьшается стридор. Однако последние исследования эффективности такого лечения показывают, что если гелий и улучшает состояние ребенка с крупом, то только кратковременно и при условии параллельного введения кортикостероидов [34, 38, 40].
Другие данные свидетельствуют о том, что улучшение клинической картины на фоне ингаляционной терапии гелием не имеет значимого преимущества по сравнению со стандартным лечением [6, 41]. Поэтому сегодня мы не имеем достаточных оснований для рутинного применения гелия у детей с синдромом крупа (С) [34, 40].
Антибиотики. В выписных эпикризах большинства детей, госпитализированных в наше отделение из других стационаров России с острым или рецидивирующим крупом, мы видим назначение системной антибактериальной терапии по поводу каждого эпизода стеноза гортани. В настоящее время как российские, так и зарубежные протоколы лечения не рекомендуют эмпирического назначения антибиотиков с учетом того, что круп – это вирусное заболевание. Бактериальные осложнения (бактериальный трахеит, пневмония) возникают настолько редко (менее 1 на 1000), что профилактическое назначения антибиотика также не рекомендовано [6, 7, 37].
Другие препараты. Также нет опубликованных данных о назначении антипиретиков при крупе, кроме как для снижения температуры и купирования болевого синдрома. Лечение противокашлевыми препаратами и деконгестантами не сопровождается значимым улучшением. А принимая во внимание, что подскладочное пространство относится к ВДП, нет физиологической базы к применению β2-миметиков, как и доказательств их эффективности [6, 7].
Лечение
Глюкокортикостероиды (ГКС) и сегодня относятся к основным препаратам терапии синдрома крупа [34]. Эффективность их применения обусловлена выраженным уменьшением отека слизистой оболочки гортани.
В современной литературе снова и снова приводятся доказательные исследования, подтверждающие эффективность их применения в быстром облегчении симптомов крупа, снижении потребности в госпитализации и времени пребывания в стационаре, снижении риска и длительности интубации, необходимости реинтубации.
Достоверно уменьшается число повторных обращений к врачу и потребность в дополнительных назначениях (А) [6, 42, 43].
Традиционно используется парентеральное введение дексаметазона в дозе 0,6 мг/кг [44].
Наши данные показывают, что на фоне только введения дексаметазона круп у 88% детей купируется в течение первых суток [14].
До сих пор не было достаточной доказательной базы эффективности преднизолона. В настоящее время опубликованы результаты исследования по лечению легкого и средней тяжести крупа преднизолоном в дозе 2 мг/кг/сут в течение 3 дней по сравнению с 1 дозой дексаметазона 0,6 мг/кг и 2 доз плацебо. Не было выявлено достоверной разницы в длительности симптоматики (2,8 против 2,2 дня; р=0,63), лающего кашля (6,1 против 5,9 дня; р=0,81), сопутствующем уходе (2 против 7%; р=0,34), длительности стресса (1,39 против 1,56 дня; р=0,51) и количестве бессонных ночей для родителей (0,68 против 1,21 ночи; р=0,55) [2, 45].
Поэтому введение преднизолона в острых ситуациях также может быть рекомендовано [46].
Кроме того, доказана практически одинаковая эффективность как перорального, так и парентерального введения дексаметазона [44, 47]. При пероральном приеме он хорошо абсорбируется с быстрым достижением пиковой концентрации, сравнимой по скорости и эффективности с парентеральным введением [46].
При этом пероральный прием безусловно менее травматичен для ребенка, что важно, когда излишнее беспокойство приводит к усилению инспираторной одышки. Перорально можно применять раствор для инъекций, смешанный со сладким сиропом. При таких рекомендациях рвота возникает менее чем в 5% случаев. Улучшение состояния наступает в течение 1–3 часов и длится от 24 до 48 часов [48, 49].
Более того, достаточно исследований указывают, что доза дексаметазона 0,15 мг/кг по эффективности сопоставима с более высокой [50, 51]. С другой стороны, ряд авторов по-прежнему рекомендуют 0,6 мг/кг дексаметазона ввиду клинически значимого ответа от большего числа пациентов [52, 53].
В ожидании новых исследований окончательные рекомендации по выбору дозы не могут быть сделаны, поэтому клиницист в зависимости от тяжести заболевания может использовать ту или иную дозировку. В нашем отделении часто используется доза 0,3 мг/кг дексаметозана с тем же эффектом, что и 0,6 мг/кг.
Не нашлось контролируемых исследований для ответа на вопрос: требуется ли дополнительное введение гормонов после первой дозы? Ввиду короткого течения заболевания большинству пациентов чаще требуется только одно введение [34, 54].
В нашем отделении лишь 15% пациентов потребовалось более 1 дозы гормонов [14, 37].
В силу высокой эффективности и скорости наступления эффекта системные ГКС являются препаратом выбора при острых стенозах гортани и многих других неотложных респираторных состояниях в педиатрии с минимальным риском развития серьезных последствий. Индивидуального подхода будут требовать дети с иммунодефицитными состояниями или при недавнем контакте с больными ветряной оспой [47, 55].
ГКС также могут быть назначены ингаляционно в виде будесонида через компрессорный небулайзер [21]. Будесонид показал сравнимую эффективность с пероральным приемом дексаметазона и может быть использован при рвоте, вызванной пероральным приемом ГКС.
При выраженном негативизме и страхе ребенка его может быть труднее заставить ингалироваться. Хотя мы с такими ситуациями в практике сталкиваемся нечасто, особенно со стороны старших детей. Но убедились, что через 12 часов после ингаляции будесонида у детей стойко сохраняется положительный эффект и в 85% случаев достаточно однократного его применения [14]. Однако стоимость этого препарата может служить причиной ограничения его использования в рутинной педиатрической практике [8].
Адреналин на протяжении многих десятилетий с успехом назначали детям даже с тяжелым течением крупа, в пределах 30 минут облегчая тяжесть симптомов и достоверно снижая риск необходимости интубации и длительность госпитализации [7]. Ингаляции адреналина приводят к вазоконстрикторному эффекту на слизистую оболочку подскладочного пространства, снижая ее отек и воспаление. И благодаря быстрому действию как при легком инспираторном стридоре, так и при тяжелом дистресс-синдроме он может быть рекомендован в рутинной практике (С) [6, 8, 34]. Продолжительность действия иногда превышает 60 минут и заканчивается в пределах 2 часов. После этого состояние пациента, как правило, возвращается к исходному, но не ухудшается [7].
Традиционно в Северной Америке для лечения крупа использовалась рацемическая форма адреналина. Хотя сегодня он стал практически недоступен, некоторые педиатрические клиники США и Западной Европы продолжают сообщать о его применении.
Известно, что L-адреналин столь же эффективен и безопасен, как рацемический [6, 8].
В отношении дозировки, по данным разных руководств, есть некоторые различия. Одни предлагают детям любого возраста использовать стандартную дозу 0,5 мл 2,25%-ного рацемического адреналина или 0,5 мл L-адреналина в разведении 1:1000 [7], другие – 0,05 мл/кг (максимум 0,5 мл) рацемического адреналина 2,25% или 0,5 мл/кг (максимум 5 мл) L-адреналина 1:1000 [6].
Было опубликовано сообщение о развитии желудочковой тахикардии и инфаркта миокарда у изначально здорового ребенка с крупом, трижды получившего в течение часа ингаляции адреналина [56]. Поэтому категорически не рекомендуется применять повторные его дозы, за исключением случаев развития значимой дыхательной недостаточности. При том что однократное применение не сопровождается значимым повышением артериального давления и частоты сердечных сокращений – ЧСС [46].
Комбинированное лечение ГКС с адреналином в тяжелых ситуациях может считаться эффективнее монотерапии.
Исследование в Иране показало достоверное превосходство парентерального введения преднизолона с последующей ингаляцией L-адреналина при тяжелом крупе относительно дексаметозона с плацебо в купировании стеноза (р<0,009) и снижении ЧСС (р<0,026) [18, 45].
Детям с тяжелым дистрессом также может быть рекомендовано одновременное назначение ингаляций будесонида и L-адреналина, что эффективнее применения только адреналина [8].
Тем не менее в Российской Федерации зарегистрирована лишь одна форма синтетического адреналина – R-адреналин 1 мг/мл, для которого прописаны подкожное, внутримышечное и внутривенное введения. Достоверной информации об эффективности его ингаляционного применения при крупе мы не нашли.
Случаи рецидивирующего стеноза гортани, которые требуют хирургического лечения, достаточно редки [27,29].
Но в неясных, не поддающихся лечению случаях рецидивирующего крупа педиатр должен быть насторожен относительно хирургической патологии и вовремя направить ребенка на то или иное исследование или консультацию специалиста [29].
В случаях эндоскопического выявления значимого подскладочного стеноза (как правило, постинтубационного [57]) отоларингологи с успехом применяют ларинготрахеальную реконструкцию [58], а также супраглоттопластику при врожденной ларингомаляции со значительным снижением послеоперационной потребности в системных стероидах (до и после 9,8 против 0,2 (p=0,003)) [59].
В нашем отделении было два случая повторного инспираторного стридора на фоне вирусной инфекции, в которых настораживали «металлический» звук кашля и низкая эффективность ГКС. При выполнении компьютерной томографии грудной клетки с контрастированием в обоих случаях была выявлена аномалия внутригрудных сосудов с компрессией трахеи аномально расположенными сосудистыми стволами. Эти дети с успехом были прооперированы кардиохирургами и в дальнейшем не давали рецидивов синдрома крупа.
Заключение
Несмотря на то что дети со стенозирующим ларинготрахеитом регулярно встречаются в практике педиатра и в большинстве случаев благополучно выздоравливают, всегда существует опасность прогрессирующего ухудшения состояния, требующего слаженности работы медицинского персонала и своевременного обеспечения эффективной помощи без излишних манипуляций и бесполезных медикаментозных назначений.
Даже при тяжелом течении крупа возможно быстрое облегчение состояния благодаря широкой доступности таких препаратов первой помощи, как пероральные, парентеральные и ингаляционные ГКС. Этого, как правило, бывает достаточно.
Однако педиатр в любой ситуации должен быть ориентирован относительно показаний к госпитализации, случаев, требующих дополнительного обследования или консультации узкого специалиста. Применение мультидисциплинарного подхода к каждому конкретному случаю позволит успешно выйти из любой затруднительной ситуации.


