Введение
Длительное время бронхиальная гиперреактивность (БГР) рассматривалась как дифференциально-диагностический критерий бронхиальной астмы (БА) и хронической обструктивной болезни легких (ХОБЛ) [1, 2]. Однако результаты эпидемиологических исследований показали, что БГР не является патогномоничным признаком БА и может встречаться у 11–20% здоровых лиц [3], а также присутствует при ряде других воспалительных, обструктивных заболеваний дыхательной системы, в частности ХОБЛ [4, 5]. Вместе с тем вклад БГР в формирование клинико-функциональных особенностей ХОБЛ, ее влияние на качество жизни (КЖ) больных и значение для терапевтической эффективности до настоящего времени остаются малоизученными.
БГР как фактор риска ХОБЛ
Гиперреактивность дыхательных путей (ДП) является одной из патофизиологических характеристик ХОБЛ и встречается у большинства больных этим заболеванием. Частота БГР среди больных ХОБЛ, по данным современных исследований, составляет 55–94% [6–8]. В течение длительного времени считалось, что БГР при ХОБЛ является вторичным феноменом вследствие изменения геометрии ДП и полностью зависит от тяжести бронхиальной обструкции [9, 10]. Однако в последние годы накапливаются данные, согласно которым БГР является одним из ведущих факторов риска ХОБЛ [11, 12]. Результаты проспективного исследования SAPALDIA (Swiss Cohort Study on Air Pollution and Lung and Heart Diseases in Adults), оценивавшего влияние гиперреактивности ДП на формирование респираторной патологии, демонстрируют существенный вклад БГР в развитие ХОБЛ.
В частности, среди лиц с «бессимптомной» БГР спустя 11 лет частота вновь диагностированной ХОБЛ увеличилась с 14,3 до 37,9% случаев [5]. Было показано, что БГР – второй по значимости фактор риска развития ХОБЛ, обусловливая 15–17% новых случаев заболевания в процессе многолетнего наблюдения, уступая лишь табакокурению (29–39%) [11]. Еще более высокую вероятность развития ХОБЛ на фоне БГР представляют данные недавнего 9-летнего наблюдательного исследования по оценке факторов риска ХОБЛ: вероятность развития заболевания в группе пациентов с БГР была существенно выше – отношение шансов (ОШ)=23,13 (95% дове-рительный вариант [ДИ] – 1,4–380,5) по сравнению с таковой у пациентов без БГР [12].
Таким образом, полученные данные не только позволяют рассматривать БГР в качестве независимого предик-тора развития ХОБЛ, но и определяют существенный вклад БГР в развитие ХОБЛ.
Клинико-функциональные особенности больных ХОБЛ с БГР
Кроме несомненного вклада гиперреактивности ДП в формирование ХОБЛ БГР cчитается неблагоприятным прогностическим фактором, существенно модифицирующим течение ХОБЛ. В частности, в ряде исследований продемонстрировано, что БГР ассоциируется с более быстрым прогрессированием бронхиальной обструкции [13–15], утяжеляет респираторные симптомы, увеличивает частоту обострений и снижает КЖ больных ХОБЛ [8, 16–18]. В исследовании А. Zanini и соавт. показано, что БГР у больных ХОБЛ в значительной степени влияет на выраженность респираторных симптомов. Так, результаты корреляционного анализа демонстрируют сильную степень зависимости между шкалой симптомов ХОБЛ и кумулятивной дозой метахолина (rs=-0,76; р=0,005), а также числом обострений ХОБЛ за предшествовавший год (rs=-0,59; р=0,021) [16].
Проведенная нами сравнительная оценка выраженности респираторных симптомов также свидетельствует о существенных различиях в зависимости от уровня бронхиальной реактивности у больных ХОБЛ (рис. 1).
Одышка большей степени интенсивности отмечена в группе пациентов с синдромом БГР. Разница показателей составила в среднем 0,8 балла (р<0,001) по шкале MRC (Medical Research Council Dyspnea Scale). Различия выявлены также и в выраженности ночного кашля, интенсивность которого у пациентов с БГР была более чем в 2 раза выше по сравнению с пациентами с неизмененной реактивностью бронхов на метахолин (р=0,002). Выраженность кашля в дневное время была сопоставимой в обеих группах больных (p>0,05), т.е. не определялась уровнем реактивности бронхов. Интенсивность продукции мокроты характеризовалась большей степенью у пациентов с БГР (рис. 1).
Индивидуальный анализ подтвердил гетерогенность одышки в зависимости от уровня реактивности бронхов (рис. 2).
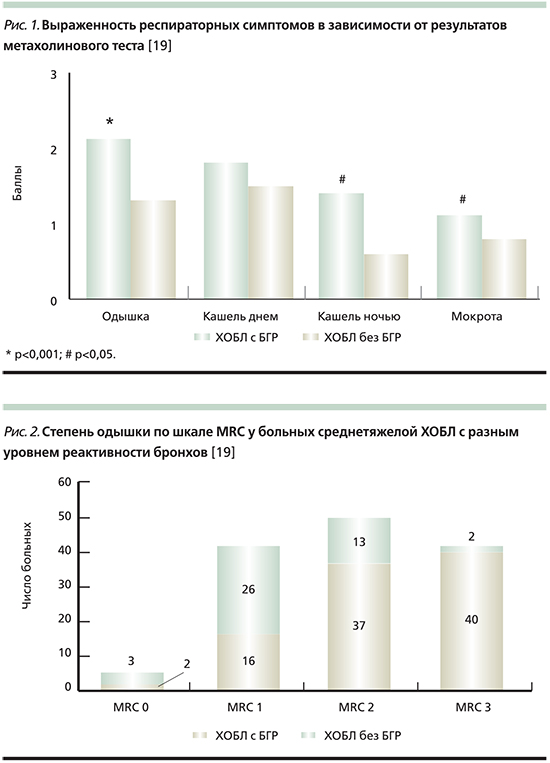
Так, БГР большинства (81,1%) пациентов характеризовалась одышкой средней и тяжелой степеней, у 16 (16,8%) пациентов выявлена легкая одышка и у 2 таковая не отмечена, за исключением очень тяжелой физической нагрузки (MRC 0). Большинство (59,1%) больных ХОБЛ без БГР описывали легкую степень одышки, у 29,5% больных выявлена умеренная одышка, и только 2 пациента без БГР характеризовали ее как тяжелую. При этом следует отметить, что показатели объема форсированного выдоха за первую секунду (ОФВ1) до и после бронходилататора были сопоставимыми в обеих группах больных ХОБЛ. Таким образом, БГР можно рассматривать как предиктор тяжелой одышки у больных ХОБЛ и, соответственно, более тяжелого течения заболевания независимо от степени тяжести бронхиальной обструкции.
Другой важной клинической характеристикой ХОБЛ являются частота обострений, в значительной степени влияющих на тяжесть течения заболевания, а также объем терапии [20]. Кроме усиления респираторных симптомов у пациентов с БГР ХОБЛ сопровождается увеличением числа обострений заболевания. В частности, частота обострений в группе больных среднетяжелой ХОБЛ с БГР была в 1,5 раза выше, составив в среднем 1,6±1,2 (M±SD) в год, по сравнению с 1,1±0,6 у пациентов с неизмененной реактивностью бронхов на метахолин (р=0,017). Кроме того, следует отметить, что число пациентов с частыми обострениями (2 и более в год) преобладает среди больных ХОБЛ, имеющих БГР. Так, частые обострения выявлены у 39 (41,1%) из 95 больных ХОБЛ с БГР, тогда как среди больных ХОБЛ без БГР частые обострения наблюдались только у 6 (13,6%) из 44 пациентов (р=0,002) [19].
Среди функциональных особенностей больных ХОБЛ с БГР в ряде исследований отмечено увеличение показателей легочной гиперинфляции по сравнению с пациентами без БГР. Так, у 29 пациентов легкой и среднетяжелой ХОБЛ показатели остаточного объема легких (ООЛ) составили 168±36% от должных величин среди больных БГР и 146±40% в отсутствие повышенной чувствительности к метахолину (p=0,024) [16]. Показатели ООЛ среди больных среднетяжелой ХОБЛ, по результатам нашего исследования, также характеризовались существенными различиями; так, после бронходилататора ООЛ составил 170,4±18,1% от должного у больных ХОБЛ с БГР и 153,4±21,2% – в отсутствие БГР (р<0,001) и в еще большей степени до его применения – 203,0±21,1% у больных ХОБЛ с БГР и 173,5±22,0% (р<0,001) без БГР. Взаимосвязь БГР (кумулятивная доза метахолина) и ООЛ подтверждается результатами корреляционного анализа (rs=-0,62; р=0,017) [19].
Представленные данные свидетельствуют о значительном вовлечении периферической зоны дыхательных путей в формирование БГР и подтверждаются результатами исследования М. Kohlhaufl и соавт. [21]. При проведении анализа легочной депозиции аэрозольных частиц средним размером 0,91±0,03 мкм у 32 женщин с «бессимптомной» БГР и 60 женщин без БГР в ингаляционном тесте с метахолином получены существенные различия. Избранный размер частиц, по мнению авторов, предполагал преимущественную локализацию в зоне бронхиол и ацинуса. Величина ОФВ1 была сопоставимой в обеих группах. Результаты показали, что у женщин с БГР отмечено значительное увеличение депозиции частиц аэрозоля по сравнению с таковой у обследуемых пациенток без БГР (p<0,01). Представленные различия авторы объясняют снижением вентиляции, которое, вероятнее всего, обусловлено воспалительным процессом и ремоделированием на уровне бронхиол, что препятствует нормальному транспорту аэрозольных частиц, попадающих в т.н. мертвую зону ловушки [21]. Таким образом, среди больных ХОБЛ с сопоставимой степенью тяжести бронхиальной обструкции выраженность легочной гиперинфляции значительно различается в зависимости от уровня бронхиальной реактивности, что подтверждает взаимосвязь БГР с патологическими изменениями периферической зоны ДП, формирующих легочную гиперинфляцию.
Уровень БГР не ограничивается влиянием на тяжесть клинико-функциональных проявлений заболевания и в значительной степени определяет летальность при ХОБЛ. Рядом авторов была установлена зависимость между частотой летальных исходов и уровнем БГР у больных ХОБЛ. Так, относительный риск (ОР) смерти составил 3,83 (95% ДИ – 0,97–15,1) при максимальной пороговой дозе гистамина 32 г/л, что соответствует низкому уровню БГР, и 15,8 (3,72–67,1) при дозе гистамина 1 г/л, что характеризует высокую степень реактивности бронхов [22].
Представленные данные позволяют рассматривать БГР как предик-тор более выраженных респираторных симптомов и частых обострений у больных ХОБЛ и, соответственно, более тяжелого течения заболевания у пациентов независимо от показате-лей бронхиальной обструкции. Таким образом, БГР служит не только самостоятельным фактором риска развития ХОБЛ, но и индикатором неблагоприятного течения заболевания.
Бронхопротективный эффект М-холинолитиков у больных ХОБЛ
Согласно современным отечественным и международным клиническим рекомендациям, основным направлением в лечении ХОБЛ является длительная бронходилатирующая терапия двумя классами препаратов – антихолинергиками и β2-агонистами [20, 23]. Для клинико-функциональной оценки эффективности бронходилатационной терапии больных ХОБЛ чаще всего используется анализ динамики показателей бронхиальной обструкции и легочной гиперинфляции [24, 25]. Однако с учетом выраженного негативного влияния БГР на течение ХОБЛ воздействие на гиперреактивность ДП или бронхопротективный эффект бронходилататоров представляется важной мишенью и конечной точкой оценки эффективности терапии при данном заболевании.
До настоящего времени механизмы БГР при ХОБЛ остаются малоизученными, вместе с тем нарушение парасимпатического контроля остается определяющим фактором регулирования тонуса гладкой мускулатуры бронхиального дерева [26]. Было показано, что парасимпатическая активация является доминирующим компонентом обратимой бронхиальной обструкции при этом заболевании [27–29]. В связи с этим применение М-холинолитиков при бронхообструктивной патологии, характеризующейся повышенным холинергическим тонусом, рассматривается как патогенетически обоснованная терапия [30, 31]. Среди антихолинергических препаратов длительного действия до недавнего времени единственным представителем этого класса был тиотропия бромид (ТБ), однако в последние годы в арсенале российской клинической практики появились новые антихолинергические препараты, в т.ч. гликопиррония бромид (ГБ).
В литературе представлены немногочисленные данные, подтверждающие бронхопротективное действие различных М-холинолитиков [32, 33].
В частности, у больных БА ингаляция 10 мкг ТБ вызывала снижение БГР, о чем свидетельствовало увели-ение провокационной концентрации метахолина (PC20) более чем в 2 раза, тогда как увеличение дозы тиотропия до 40 мкг сопровождалось возрастанием PC20 в 7 раз [32]. При сравнении бронхопротективного действия ТБ и ГБ у больных БА был продемонстрирован выраженный эффект через час после ингаляции обоих препаратов, о чем свидетельствует 16-кратное увеличение PC20 метахолина. Однако сила бронхопротективного действия ТБ значительно превосходила ГБ через 24, 72 часа и сохраняла свое статистическое преимущество (p=0,028) даже через 7 дней после последней дозы ТБ [33].
Нами проведено исследование, продемонстрировавшее бронхопротективное действие М-холинолитиков у больных среднетяжелой ХОБЛ с исходной БГР (провокационная доза метахолина – ПД20≤0,471 мг) [18]. Выраженность бронхопротективного эффекта оценивалась по динамике ПД20 метахолина у 15 пациентов, получавших ТБ, и у 22 больных на фоне терапии ГБ. Для оценки раннего бронхопротективного эффекта (1-й этап) уровень бронхиальной реактивности оценивался исходно и в динамике по значению ПД20 метахолина в течение первого часа и через 24 часа после однократного применения М-холинолитиков. На втором этапе у всех больных повторно анализировались показатели реактивности бронхов (ПД20 метахолина) через 3–6 месяцев лечения М-холинолитиками (в интервале 24±1 час после приема последней дозы препарата).
Уровень реактивности бронхов существенно снижался через 20 и 60 минут после первой дозы ГБ и ТБ соответственно: у 8 (53%) из 15 больных группы ТБ и у 20 (90,9%) из 22 больных группы ГБ метахолиновый тест становился отрицательным. У больных с сохранившимися признаками БГР среднее значение ПД20 метахолина увеличилось после однократного приема препаратов более чем в 2 раза, что указывает на значительное снижение бронхиальной реактивности. Очень важное обстоятельство – сохранность протективного эффекта ТБ и ГБ на протяжении всего лечебного периода. Так, через 6 месяцев лечения ТБ у 9 (60%) из 15 человек метахолиновый тест был отрицательным (ПД20>0,471 мг). При этом у абсолютного большинства больных (7 из 8 пациентов) с отрицательным тестом после ТБ в «острой» пробе через 6 месяцев терапии также не выявлено БГР. У остальных пациентов сохранялось значительное снижение уровня БГР, о чем свидетельствует достоверное повышение средней кумулятивной дозы метахолина на 23% (р<0,05) относительно исходных величин. Аналогичные данные получены и для ГБ. Через 3 месяца терапии у 6 из 22 больных спустя 24±1 час после приема последней дозы препарата метахолиновый тест был отрицательным. При этом у абсолютного большинства больных (6 из 7 пациентов) с отрицательным тестом после оценки раннего протективного эффекта ГБ (спустя 24 часа после приема первой дозы препарата) через 3 месяца терапии также не выявлена БГР. У остальных пациентов, так же как и в группе ТБ, сохранялось значительное снижение уровня БГР, о чем свидетельствует достоверное повышение медианы ПД20 метахолина на 53% относительно исходных величин (р=0,009).
В ряде исследований убедительно показано, что М-холинолитики оказывают положительное действие на клинико-функциональный статус, КЖ больных ХОБЛ и снижают частоту обострений заболевания [34, 35]. Однако при сравнительной оценке эффективности терапии выявлены существенные различия в зависимости от уровня бронхиальной реактивности. Так, в процессе 6-месячного лечения ТБ пациенты со среднетяжелой ХОБЛ с БГР демонстрировали более выраженное уменьшение одышки и кашля, особенно в ночное время, снижение частоты обострений заболевания, улучшение функционального статуса и показателей КЖ по сравнению с больными ХОБЛ без БГР [18].
Таким образом, представленные результаты свидетельствуют о значительном бронхопротективном действии ТБ и ГБ, развивающемся через несколько минут после первой ингаляции препарата и сохраняющемся через 3–6 месяцев терапии больных среднетяжелой ХОБЛ. Снижение уровня БГР на фоне терапии ТБ ассоциируется с большей положительной динамикой клинико-функциональных характеристик и показателей КЖ больных ХОБЛ.
Заключение
Представленные в литературе данные и результаты наших исследований свидетельствуют о наличии БГР у большинства больных ХОБЛ и позволяют рассматривать БГР не только в качестве предиктора тяжелого течения и неблагоприятного прогноза ХОБЛ, но и как маркер вариабельности клинических проявлений и терапевтического ответа. БГР, являясь независимым фактором риска развития ХОБЛ, оказывает значительное негативное воздействие на течение заболевания, ухудшая клинико-функциональное состояние и КЖ больных ХОБЛ.
С учетом клинико-прогностического значения БГР и механизмов ее формирования при ХОБЛ антихолинергическая терапия, обладающая выраженным бронхопротективным действием, рассматривается как патогенетически ориентированная. Гиперреактивность бронхов при ХОБЛ представляется чрезвычайно важной терапевтической мишенью, а снижение уровня БГР оказывает существенное модифицирующее влияние на течение заболевания.


