Сегодня диуретики являются одним из распространенных классов лекарственных препаратов, используемых в медицинской практике, включая внутренние болезни, неврологию, эндокринологию, урологию, офтальмологию и другие медицинские специальности. Такой широкий спектр их применения объясняется рядом факторов, включающих наличие нескольких классов диуретических препаратов, которым присущи различные механизмы действия, клиническая эффективность и низкий риск развития тяжелых побочных эффектов.
Проведенные в последние десятилетия интенсивные экспериментальные и клинические исследования [1–3], посвященные механизму действия диуретиков, их фармакокинетике и фармакодинамике, взаимодействию с другими лекарственными препаратами, клинической эффективности, развитию диуретической резистентности (ДР), позволили существенно улучшить подходы к проведению диуретической терапии (ДТ).
К достижениям ДТ следует отнести:
- создание различных классов диуретиков, включающих осмотические диуретики, ингибиторы карбоангидразы, тиазидовые и тиазидоподобные диуретики, петлевые диуретики (ПД), калийсберегающие диуретики, включающие амилорид и триамтерен, а также антагонисты альдостерона (спиронолактон и эплеренон) [1–3];
- проведение масштабных контролируемых рандомизированных исследований (КРИ), посвященных эффективности (в т.ч. и влияние на выживаемость) ненатрийуретических дозировок антагонистов альдостерона для больных хронической сердечной недостаточностью (ХСН) со сниженной фракцией изгнания левого желудочка [4];
- проведение масштабных КРИ, посвященных оценке антигипертензивной эффективности тиазидовых и тиазидоподобных диуретиков [5–8];
- изучение механизмов резистентности ДТ и путей ее устранения [1, 9, 10];
- изучение взаимодействия диуретиков с другими лекарственными препаратами [2, 3];
- изучение клинической эффективности комбинаций различных классов диуретических препаратов [10];
- определение места осмотических и ПД при остром повреждении почек (ОПП) [2, 3];
- создание антагонистов V1- и V2-рецепторов вазопрессина (т.н. ваптанов, также именуемых акваретиками) [11–16];
- изучение осложнений ДТ и подходов, направленных на их профилактику и устранение [9, 14].
Вместе с тем остается много проблем ДТ, которые включают:
- отсутствие масштабных КРИ, посвященных оценке влияния диуретиков на продолжительность пребывания в стационаре, частоту повторных госпитализаций, непосредственную и отдаленную выживаемость больных острой и ХСН, хронической болезнью почек (ХБП), нефротическим синдромом (НС), циррозом печени (декомпенсированная фаза), а также у больных, получающих диализную терапию [2, 3, 6];
- выбор диуретика, его первоначальных, пороговых и поддерживающих дозировок, а также путей введения [4];
- высокая частота развития ДР [9, 10, 17, 18];
- определение места натрийуретических дозировок антагонистов альдостерона в лечебной тактике больных ХСН и НС [6].
Применение диуретиков нередко сопровождается индукцией гомеостатических механизмов, лимитирующих их диуретический эффект и способствующих развитию ДР, суть которых заключается в недостаточном диуретическом (натрийуретическом) ответе или его отсутствии. Общепринятое определение понятия «диуретическая резистентность» отсутствует. В частности, M. Erstein и соавт. [5] определяют ДР как неспособность экскретировать по меньшей мере 90 ммоль натрия в течение 72 часов на 160 мг перорального фуросемида (по 80 мг×2 раза в сутки).
Частота развития ДР, по данным различных сообщений, составляет 20–30% и более, что связывают со многими факторами, включающими неоднозначный подход к определению понятия ДР, выбор диуретика и способа его применения, вариабельность дозировок и продолжительности применения диуретических препаратов [1–3, 17, 18]. Ведущие причины развития ДР показаны в таблице [2].
Снижение диуретического ответа также может быть следствием т.н. псевдорезистентности, к причинам которой можно отнести неправильный диагноз, несоблюдение больным водно-солевого режима, высокую вариабельность в биодоступности диуретиков не только для различных больных, но и для одного и того же больного с течением времени. Например, биодоступность перорального фуросемида колеблется от 10 до 90–100% [1, 2, 10].
Как показано в таблице, одной из причин развития «истинной» ДР служит нарушение поступления диуретиков в активной форме в просвет канальцев вследствие фармакокинетических и/или фармакодинамических причин, включающих снижение биодоступности диуретика в результате нарушения его абсорбции при пероральном приеме вследствие отека кишечника (системные отеки различного генеза) [19, 20]; снижение скорости клубочковой фильтрации (СКФ) и/или почечного кровотока вследствие нарушения почечной перфузии, что ведет к снижению секреции диуретика в просвет канальцев (ОПП, ХБП) [21]; чрезмерную реабсорбцию натрия в проксимальном нефроне (в частности, в петле Генле) в связи с активацией РААС и СНС; феномен «торможения» («braking phenomenon»); феномен «отскока»/«рикошета» («rebound sodium retention») [9, 10, 18]; почечную адаптацию («адаптация нефронов») [22, 23]; повышение ретенции натрия и воды в дистальных канальцах и собирательных трубочках, обусловленное вторичным гиперальдостеронизмом и влиянием вазопрессина [4, 9, 24]; лекарственное взаимодействие (прием НПВС, глюкокортикоидов, нефротоксических антибиотиков и др.) [25]. Приведенные выше факторы формирования ДР нередко представлены в различных комбинациях.
«Феномен торможения» («braking phenomenon») означает острое (в течение нескольких часов или дней) снижение диуретической активности при повторных приемах ПД [1, 26]. В эксперименте показано, что такое снижение натрийуретического ответа может быть обусловлено двумя факторами: 1) снижением реабсорбции NaCl в петле Генле и 2) повышением реабсорбции NaCl в дистальных канальцах. Кроме того, даже единственный прием ПД может вести к алкалозу («contraction alkalosis») и способности развития «феномена торможения» [2, 10].
Гипертрофии дистальных канальцев отводится важное место в развитии феномена «отскока»/«рикошета» с почечной ретенцией натрия («rebound sodium retention»), который развивается при длительном приеме ПД и сопровождается увеличением реабсорбции Na+ в дистальном сегменте нефрона [9, 10].
Почечная адаптация («адаптация нефронов») развивается при хроническом приеме ПД и характеризуется гипертрофией и гиперфункцией тубулярных эпителиальных клеток дистальных канальцев, что ведет к увеличению реабсорбции натрия в них, а следовательно, к снижению диуретического ответа [10, 22, 23].

Профилактика/устранение ДР
При проведении ДТ следует оценивать такие параметры фармакокинетики, как биодоступность, пути метаболизма и время полувыведения, играющие ключевую роль в выборе класса диуретиков, их дозировок и путей введения [1, 2, 17]. Лечебные подходы, базирующиеся на превентировании/устранении ДР, включают «натрийуретическую» стратегию, «ненатрийуретическую» стратегию и ультрафильтрацию [27, 28].
«Натрийуретическая» стратегия подразумевает:
- первоначальным и важным подходом к достижению оптимального диуретического эффекта при применении диуретиков является строгое ограничение поваренной соли (обычно до 4,0–6,0 г/сут, а в отсутствие диуретического эффекта – менее 1,5–2,4 г/сут, по данным разных авторов [9, 14];
- ДТ не должна прерываться одномоментно (остро), т.к. адаптационные механизмы, лимитирующие экскрецию Na+, персистируют после прекращения приема диуретиков [2, 3];
- замена короткодействующего диуретика на диуретик того же класса с пролонгированным действием [29, 30];
- повышение кратности приема в течение суток у диуретиков короткого действия [4];
- превентирование диуретик-индуцированного (петлевые и тиазидовые диуретики) метаболического алкалоза («contraction alkalosis»), ингибирующего натрийуретический эффект диуретиков [2, 10];
- смена режима применения ПД с пероральной формы на внутривенную (болюсную или инфузионную) с целью устранения проблем с биодоступностью [9];
- одновременное блокирование реабсорбции Na+ в различных сегментах нефрона посредством комбинации диуретиков различных классов (например, ПД с тиазидовыми диуретиками и/или с ингибиторами карбоангидразы, и/или с «натрийуретическими дозами» антагонистов альдостерона) [4, 9];
- ингибиция РААС и СНС за счет применения ингибиторов ангиотензинпревращающего фермента или антагонистов рецепторов ангиотензина II и «ненатрийуретических» (субдиуретических) дозировок антагонистов альдостерона, т.к. активация этих систем повышает активность ренина плазмы и секрецию альдостерона [1–3, 10].
«Ненатрийуретические» подходы включают:
- использование низких («почечных») дозировок допамина (2–3 мг/кг массы тела). В указанной дозе он действует на периферические дофаминовые рецепторы, что приводит к вазодилатации почечных, коронарных, спланхнических и церебральных артерий [31, 32];
- использование «акваретиков» – антагонистов вазопрессина (ваптанов), блокирующих V2-рецепторы и индуцирующих «водный диурез» (например, толваптан) [4, 33, 34].
ДР при сердечной недостаточности
Применение ПД при сердечной недостаточности часто сопровождается развитием резистентности к ним в связи с дисрегуляторными процессами, включающими активацию РААС и СНС, что ведет к снижению почечного кровотока, а следовательно, к уменьшению поступления диуретика в восходящий толстый отдел петли Генле [16, 18, 35–37].
Активация РААС и СНС, нарастающая при применении диуретиков, в комбинации со снижением почечного кровотока ответственна за развитие ДР. В свою очередь ДР ассоциируется с увеличением регоспитализаций и неблагоприятным прогнозом [16, 38–41].
Наличие ХБП, часто развивающейся при тяжелой сердечной недостаточности, способствует развитию ДР. Снижение почечной перфузии вследствие активации РААС и СНС, обусловленной применением диуретиков, «наслаивающееся» на уже существующую ХБП, способствует развитию ДР, требующей в свою очередь прогрессивного повышения дозировок диуретиков, а следовательно, дальнейшей активации нейрогормональной системы, прогрессирующему ухудшению функции почек и развитию кардиоренального синдрома [18, 41].
Кардиоренальный синдром характеризуется тяжелой кардиоренальной дисрегуляцией, ведущей к состоянию, при котором терапия (в частности, диуретическая), направленная на уменьшение/устранение симптомов застоя, присущих ХСН, становится малоэффективной вследствие дальнейшего снижения функции почек [42]. По мнению E. Brounwald [16], ДР является как «маркером», так и «игроком» независимо от особенностей патофизиологических механизмов. Представлены убедительные доказательства, что развитие ДР является крайне неблагоприятным прогностическим «маркером» у больных ХСН. По данным клинического исследования, проведенного M. Valente и соавт. [43], установлена независимая ассоциация между ДР и наличием одышки, увеличением частоты госпитализаций, тяжестью сердечной недостаточности и снижением функции почек.
Вызванная петлевыми и тиазидовыми диуретиками потеря Na+ ведет к снижению ЭАОК, что стимулирует неосмотическое освобождение вазопрессина, активирует его V2-рецепторы и реабсорбцию воды. Вследствие неосмотической стимуляции вазопрессина индуцируется реабсорбция воды, что приводит к гиперосмолярности мочи и играет определенную роль в развитии рефрактерности к диуретикам [33]. Антагонисты V2-рецепторов вазопрессина способствуют увеличению «водного» диуреза («aquaresis»). В ряде исследований показано увеличение диуреза при применении толваптана дополнительно к ПД у больных, где имела место ДР [33, 34, 44–46].
За последние годы (2012–2014) опубликованы результаты исследований японских кардиологов, посвященных ведению больных сердечной недостаточностью. K. Dohi и соавт. [44] в своем обзоре приводят данные о благоприятном действии толваптана на больных сердечной недостаточностью, резистентных к диуретической терапии ПД и/или тиазидовыми диуретиками: 7-дневное применение толваптана существенно увеличивало диурез и обеспечивало снижение массы тела в отсутствие влияния на артериальное давление, частоту сердечных сокращений. Примечательно, что у пациентов не наблюдалось явной симптоматической гипернатриемии во время лечения, главным образом из-за смещения жидкости из интерстициального пространства во внутрисосудистое после обеспечения адекватного диуреза. Больных острой декомпенсированной сердечной недостаточностью применение толваптана в комбинации с ПД приводило к более существенному повышению диуреза по сравнению с самостоятельным приемом фуросемида. Кроме того, у больных, принимавших толваптан, не отмечено случаев развития ОПП, а также имело место снижение летальности в течение 180 дней наблюдения.
В японских рекомендациях, посвященных лечению пациентов с острой декомпенсированной сердечной недостаточностью, отмечается возможность применения толваптана при наличии симптомов сердечной недостаточности, сохраняющихся, несмотря на оптимальную диуретическую терапию ПД. В данных рекомендациях также показано применение предсердного натрийуретического пептида – карперитида, обладающего вазодилататорным и натрийуретическим свойствами, дополнительно к ПД и толваптану с целью профилактики или устранения ДР [45, 47–49]. С целью увеличения диуреза при ДР приемлемо также применение вазодилататоров (в частности, нитроглицерина) в комбинации с ПД пациентами с острой декомпенсированной сердечной недостаточностью при нормальном или повышенном артериальном давлении [47–49].
ДР при ХБП
Действие диуретиков (за исключением калийсберегающих) осуществляется после их поступления в просвет канальцев (люминальное пространство). Секреторная способность проксимальных почечных канальцев определяет количество, а значит, и активность диуретиков, поступающих далее в дистальные отделы нефрона [3]. Снижение почечного кровотока и в меньшей мере СКФ лимитируют поступление петлевых и тиазидовых диуретиков в просвет канальцев, а следовательно, и их диуретическое действие. В связи с этим при ХБП III стадии необходимо увеличивать дозу диуретика, чтобы его количество в интратубулярной жидкости оказалось достаточным для достижения оптимального диуретического ответа.
Смена одного класса диуретиков на другой, а также смена препаратов внутри одного класса могут приводить к увеличению диуретического ответа. Так, тиазидовые диуретики занимают определенное место в диуретической терапии больных ХБП I–III стадий [5, 6]. При более существенном нарушении функции почек (СКФ менее 30 мл/мин – ХБП IV–V стадий) диуретическое действие тиазидовых диуретиков существенно снижается и преимущество следует отдавать комбинации тиазидовых диуретиков с ПД [1, 6, 9, 10]. ПД являются диуретиками выбора для больных ХБП IV–V стадий. Они способны осуществлять диуретическое действие при СКФ менее 30 мл/мин, что особенно важно при увеличении экстрацеллюлярного объема жидкости (в частности, при артериальной гипертензии и ХСН), часто наблюдаемых при ХБП [50].
ДР при нефротическом синдроме
НС характеризуется четырьмя кардинальными проявлениями, включающими:
- большую (массивную) протеинурию;
- гипо- и диспротеинемию;
- гипер- и дислипидемию;
- отеки [15, 51, 52].
В основе развития НС лежит повышение проницаемости клубочкового фильтра для белков и других компонентов крови. Многочисленные заболевания, патологические состояния, лекарственные препараты и токсические вещества способны посредством различных механизмов повреждать гломерулярные структуры (эндотелий, базальную мембрану и подоциты), обусловливая нарушение физиологических свойств гломерулярного аппарата и вторично-канальцевой системы.
Патофизиология отеков при НС в отличие от таковой при ХСН неоднозначна и во многом определяется особенностями поражения почечных структур [51]. На протяжении многих лет доминирующая точка зрения включала следующие звенья формирования «нефротических отеков»: большая (массивная) протеинурия →гипо- и диспротеинемия (в частности, гипоальбуминемия) →снижение коллоидно-осмотического давления белков плазмы →нарушение равновесия Старлинга →увеличение выхода жидкой части крови в интерстициальное пространство →гиповолемия за счет снижения объема циркулирующей плазмы →активация РААС, симпатической и других вазопрессорных систем → увеличение реабсорбции натрия и воды в канальцевом аппарате →отеки [53]. Однако ряд экспериментальных и клинических данных [2, 3, 53] ставит под сомнение целостность этой точки зрения и свидетельствует о более сложных и неоднозначных механизмах формирования «нефротических отеков».
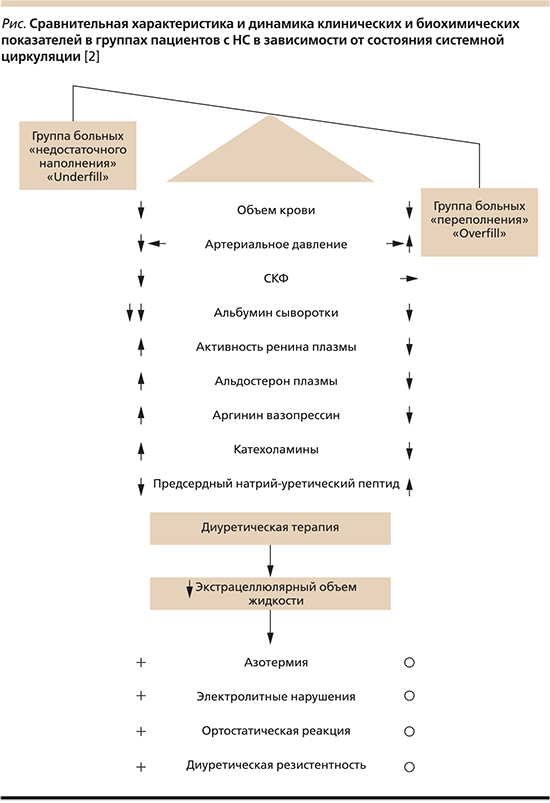
В последние годы патофизиология отеков при НС рассматривается с двух позиций, включающих «недостаточное наполнение» («underfill») системной циркуляции и ее «переполнение» («overfill») [2]. На рисунке показаны различия клинических и биохимических показателей при НС в зависимости от наполнения системной артериальной циркуляции.
ПД, используемые с целью уменьшения/устранения отеков у больных НС, занимают ведущее место в лечебной тактике [14, 15, 54]. Однако их применение нередко характеризуется развитием ДР.
Развитие ДР при НС обусловлено рядом механизмов, включающих [14] тесную интратубулярную связь профильтрованного ПД с альбумином, в результате чего связанный диуретик становится неактивным; снижение СКФ и почечного кровотока, нарушающие поступление ПД в петлю Генле; увеличение реабсорбции Na+ в восходящем отделе петли Генле; резистентность к ПД на клеточном уровне; повышение диффузии диуретика в экстрацеллюлярное пространство в связи с низкими уровнями альбумина сыворотки крови.
При тяжелом НС, характеризующемся «недостаточным наполнением» («underfill») (особенно при ДТ), наблюдается существенная стимуляция активности ренина плазмы, ведущая к гиперальдостеронизму, а следовательно, к увеличению реабсорбции Na+ в дистальных канальцах и собирательных трубках. Длительное применение ПД приводит к снижению реабсорбции Na+ в восходящем отделе петли Генле (т.н. феномен ускользания – «escape»), а следовательно, к повышению его поступления в дистальный сегмент нефрона, что приводит к гипертрофии его структур, обусловливающей увеличение реабсорбции натрия, и развитию ДР [14, 15, 55–57].
Особенности ДТ при НС включают:
- увеличение дозировок ПД. При необходимости возможно применение «пороговой дозы» («ceiling dose») фуросемида до 160–200 мг или эквивалентных дозировок торасемида или буметанида [3];
- комбинацию ПД с тиазидовым диуретиком, которые блокируют реабсорбцию Na+ в гипертрофированных дистальных сегментах нефрона, проявляя синергизм с ПД и повышая диурез [3, 6, 8–10];
- повышение диуретического ответа при НС может быть достигнуто посредством комбинации ПД с внутривенным применением альбумина (прежде всего при тяжелой гипоальбуминемии <20 г/л) [1, 41, 58, 59].
Заключение
Применение диуретиков при сердечной недостаточности, ХБП, НС довольно часто (в 20–30% случаев) сопряжено с риском развития ДР, что существенно снижает их эффективность. В связи с этим в лечебной тактике важное место должно отводиться подходам к ее устранению и профилактике. С этой целью следует учитывать патофизиологические особенности формирования отеков при различных патологических состояниях, характеризующихся развитием системных отеков, а также фармакологические свойства диуретиков, правильный выбор класса, оптимальных дозировок, кратности применения и возможных комбинаций, а также путей введения, что позволит повысить эффективность диуретической терапии.



