Введение
В последние десятилетия в связи с ростом малоинвазивных технологий закономерно отмечается и увеличение числа оперативных пособий как в плановой, так и в ургентной хирургии, в т.ч. с расширением объема вмешательств. Подобная трансформация оперативной активности закономерно увеличивает число больных спаечной болезнью брюшины и как следствие – острой спаечной кишечной непроходимостью, регистрируемой в 30–67% спаечной болезни [1–3].
Несмотря на многолетнее изучение вопросов профилактики и лечения спаечной болезни брюшины, частота острой кишечной непроходимости спаечного генеза не имеет тенденций к снижению, а послеоперационная летальность на протяжении последних лет достигает 8,1–22% [4].
Основным субстратом спаечной болезни следует признать наличие самих спаек в брюшной полости, а исходя из частоты возникновения, а также вероятности развития илеуса, наибольший практический интерес представляют спайки между париетальной брюшиной брюшной стенки и висцеральной брюшиной стенки кишки, а также межкишечные «парусные» сращения или адгезивный процесс в виде «двустволок». Частота подобных внутрибрюшных сращений колеблется в пределах 67–93% после общехирургических абдоминальных операций и достигает 95–97% после гинекологических вмешательств традиционным лапаротомным доступом [5–8]. По секционным данным, частота развития спаечного процесса после лапаротомии в общей популяции достигает 70–90% [9].
Не стоит забывать, что послеоперационные спаечные сращения резко нарушают качество жизни оперированных пациентов, усложняя повторные доступы в брюшную полость, приводя к формированию непроходимости тонкой кишки [8, 10], женскому бесплодию [11–13], а также к хроническим абдоминальным и тазовым болям [5, 14].
На сегодняшний день частота верификации внутрибрюшных сращений как причины илеуса составляет более 40% среди различных видов приобретенной непроходимости кишечника; при этом цифры летальности достигают 8–19% [15, 16]. Среди ведущих причин высокой частоты спайкообразования в первые 6–12 месяцев после трансабдоминального вмешательства следует считать универсальность запуска механизмов формирования соединительной ткани в ответ на повреждение, в т.ч. вследствие денудации (высушивания) брюшины, компрессии тканей, использования агрессивных энергий, а также избыточной коагуляции [8, 17]. Недостаточное кровоснабжение и сниженная оксигенация тканей, отмечаемые при хирургическом повреждении, также часто приводят к снижению фибринолитической активности, позволяя потенцировать пролиферацию соединительной ткани, и как следствие – к формированию волокнисто-сосудистых спаек [18].
Безусловно, чем больше и чаще осуществляется трансабдоминальный доступ, особенно в неотложной хирургии и при воспалении брюшинного покрова [19], тем прогрессивнее нарастает риск как спайкообразования в целом, так и осложнений в виде илеуса [8, 10, 11, 13]. Именно последний аспект и резкое нарушение качества жизни оперированных больных с точки зрения здравоохранения значительно увеличивают материальные затраты на оказание помощи таким пациентам, в т.ч. необходимость повторных, порою многократных, операций [20]. По оценочным данным, по поводу спаечной болезни в США госпитализируют ежегодно не менее 117 человек на 100 тыс. населения с общими затратами на их лечение до 1,3 млн долл. ежегодно [3, 8, 20].
Приведенные данные призывают оптимизировать поиск дополнительных методик в лечении пациентов со спаечной болезнью, осложненной острой спаечной тонкокишечной непроходимостью.
Цель работы: демонстрация неинвазивной методики стимуляции перистальтической активности пищеварительного тракта для коррекции энтеральной дисфункции у пациентов с острой спаечной тонкокишечной непроходимостью.
Материал и методы
В ходе работы нами проанализирован исход лечения 46 пациентов, находившихся на стационарном лечении по поводу острой спаечной тонкокишечной непроходимости за 2015–2016 гг.
Все пациенты были госпитализированы по каналу скорой медицинской помощи и удовлетворяли критериям включения и исключения согласно дизайну исследования.
Критерии включения: собственно тонкокишечный характер кишечной непроходимости, отсутствие онкологического анамнеза и инструментальных данных об очаговых образованиях брюшной полости и забрюшинной клетчатки. Также критерием включения считалось наличие хотя бы одного полостного оперативного вмешательства, а также отсутствие признаков странгуляции и декомпенсации непроходимости. При этом изначально включались пациенты с явлениями дилатации тонкой кишки до 3,5–4,0 см.
Более значимое расширение петель кишечника, по данным рентгенологического исследования и протоколу ультразвукового исследования, рассматривалось как вариант декомпенсации и эти больные в исследование не включались.
В качестве критериев исключения из исследования нами выделены толстокишечный характер непроходимости, тяжелый декомпенсированный коморбидный фон, наличие «фекалоидной» рвоты и перитонеальной симптоматики, а также значительного выпота в брюшной полости по данным инструментальных исследований (как проявление декомпенсации непроходимости).
В анализируемой когорте больных отмечено преобладание лиц женского пола (59%), при этом у всех пациентов в анамнезе было от 1 до 7 операций, в среднем Мср.=2,6±1,1. С целью объективизации данных для адекватного анализа нами были выделены 2 группы исследования: основная (21 пациент, оценивалась проспективно) и группа сравнения (25 пациентов, где проводился ретроспективный анализ). Обе группы были соизмеримыми по возрасту, полу и тяжести состояния.
В группе сравнения проведено лечение острой кишечной непроходимости, согласно приказу № 320 и Национальным клиническим рекомендациям (2015). Пациентам основной группы в лечении илеуса помимо стандартной терапии и комплекса обследования для коррекции энтеральной недостаточности, профилактики прогрессирования внутрибрюшной гипертензии, сохранения и стимуляции перистальтической активности желудочно-кишечного тракта (ЖКТ) проводились сеансы последовательной резонансной стимуляции пищеварительного тракта.
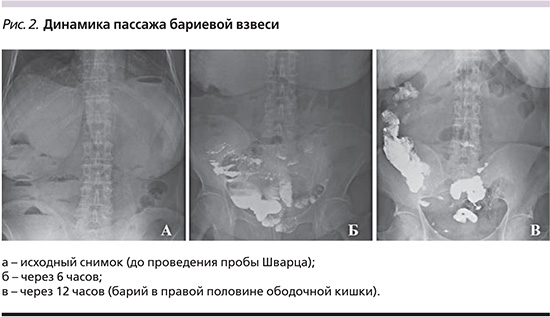
Всем пациентам обеих групп исходно проведены декомпрессия проксимальных отделов ЖКТ путем установки назогастрального зонда, динамический пассаж бариевой взвеси с рентгенологическим контролем (проба Шварца), а также электрогастроэнтеро- и колографии на «селективном полиграфе ЖКТ» [21]. Основные параметры электронного блока селективного полиграфа, осуществлявшего обработку и усиление сигналов, определены с учетом общей биоэлектрической активности организма человека, рассматриваемого как неоднородный объемный проводник, содержащий множество различных источников механической и электрической активности. Часть т.н. механической активности, а именно сокращений и деформаций внутренних органов, превращается в биоэлектрические сигналы, регистрируемые интегральными электрофизиологическими методами в виде графиков динамики активности основных отделов ЖКТ и/или спектров [22].
Особое внимание нами уделялось мониторингу и при необходимости – коррекции уровня внутрибрюшного давления, регистрируемого по методике непрямого трансвезикального измерения [23]. В настоящее время подобный способ манометрии признается как «золотой» стандарт для большинства пациентов [24].
Статистическая обработка полученных данных осуществлена с использованием пакетов программ «Microsoft Word 2010» и «Microsoft Excel 2010». Полученные в ходе исследования данные обработаны статистически с расчетом средней арифметической (М) и средней ошибки (m). Количественные параметры сравнивали с использованием t-критерия достоверности по Стьюденту.
Результаты и обсуждение
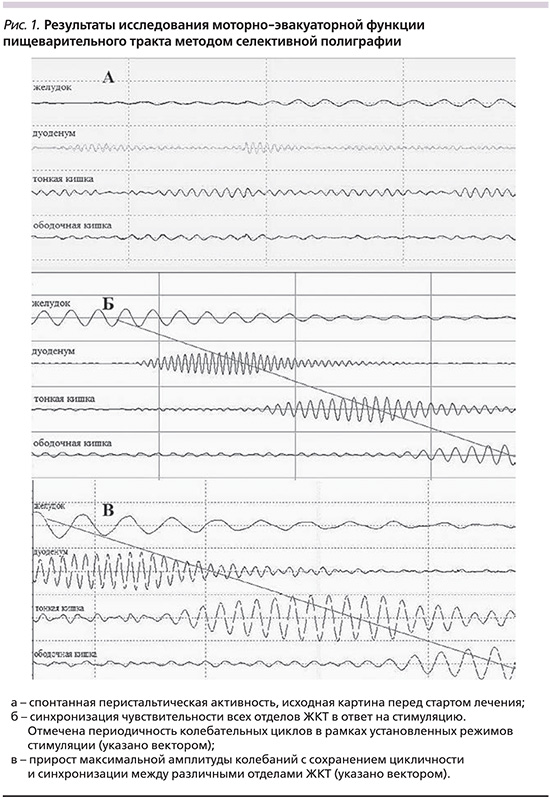
Всем госпитализированным больным обеих групп исследования после проведения необходимого по всем стандартам дообследования выполнено исследование моторно-эвакуаторной функции пищеварительного тракта методом селективной полиграфии. При этом регистрировалось 4 потока кривых, соответствовавших желудочной, дуоденальной, тонко- и толстокишечной пропульсивной активности. У всех пациентов обеих групп исходная активность возбудимых структур была незначительной, не превышавшей 11,3±5,8 мкВ (рис. 1а), хотя имелись единичные пики колебаний, но в основном они представлялись набором хаотичных импульсов, не систематизированных и не имевших нужной периодичности (согласно пропульсивности нормальной энтерокинетики). В группе сравнения после регистрации исходной активности реализовывался стандартный протокол ведения пациентов с острой кишечной непроходимостью спаечного генеза, согласно нормативным документам. В основной группе после проведения селективной полиграфии помимо медикаментозной терапии проведена последовательная резонансная стимуляция с экспозицией не менее 1,5 часов на все структуры последовательно в стандартных режимах.
В ходе проведения стимуляции нами были получены ответы возбудимых структур всех «заинтересованных» отделов пищеварительного тракта. Амплитуда вызванных сигналов «зон интереса» достигала 85±9 мкВ, при этом, как правило, при продроме болезни более суток отмечено быстрое угасание колебаний с возвратом к исходному низкоамплитудному уровню. Несмотря на быстрое угасание, проводилась последовательная резонансная селективная стимуляция с усилением сигналов на «проблемных» отделах в динамике. Как правило, к исходу первого сеанса (порядка 70% пациентов) и на втором сеансе (у всех остальных) получены ответы от всех стимулированных отделов ЖКТ с синхронизацией чувствительности перечисленных отделов (рис. 1б) и сохранением активности в фоновых режимах стимуляции. Максимальная чувствительность имела тенденцию к увеличению (рис. 1в) с Mcр. 64±11 мкВ до Мср. 110±13 мкВ, при этом наблюдались отдельные периоды активности возбуждения всех отделов ЖКТ с максимальной амплитудой регистрируемых сигналов до 200–250 мкВ. В ходе выполнения стимуляции кратность резонансной терапии составила Mcр. 3,4±1,4, что соответствовало в среднем 48 часам лечения в стационаре с длительностью каждого сеанса от 60 до 240 минут, Mcр. – 104±57 минут.
В ходе энтерографии пассаж в дистальные отделы подвздошной и правые отделы ободочной кишки (рис. 2а, б, в) составил 6,2±2,1 часа в основной группе и 8,1±2,3 (р≤0,05) в контрольной. При этом тенденция лизиса уровней жидкости по рентгенологическому исследованию имела также бóльшую положительную динамику в группе применения резонансной стимуляционной терапии. Назогастральное зондирование позволило объективизировать динамику уменьшения/разрешение гастро- и/или энтеростаза: имелся отчетливый лизис отделяемого по зонду в основной группе, что позволило выполнить его удаление в 100% наблюдений к исходу первых суток, при том что в группе сравнения персистенция назогастральной декомпрессии занимала более суток для подавляющего числа больных (n=12; 48%; p≤0,05). Во всех наблюдениях основной группы к исходу первых суток получен самостоятельный стул, при том что в группе сравнения лишь 2/3 пациентов удовлетворяли этому критерию.
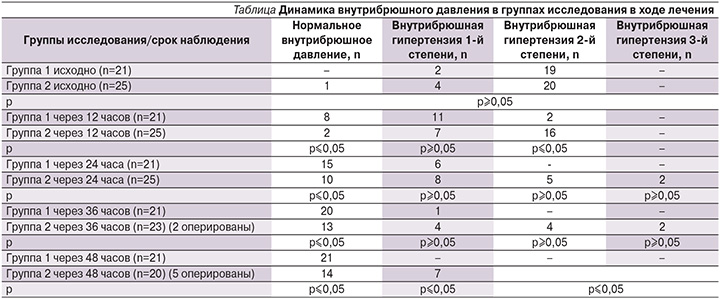
Одним из методов оценки проводимой терапии и, следовательно, резонансной стимуляции послужило определение внутрибрюшного давления как исходно, так и в динамике лечения (см. таблицу).
Так, при старте лечения внутрибрюшная гипертензия отмечена у 24 пациентов группы сравнения и у всех пациентов основной группы.
В ходе лечения внутрибрюшная гипертензия мониторировалась каждые 12 часов, при этом уже к концу первых суток отметилось четкое разделение групп исследования с достоверной разницей между группами. Исходные параметры внутрибрюшной гипертензии составили 18,3±4,3 мм рт.ст. в основной группе и 17,9±3,7 мм рт.ст. в группе сравнения (p≥0,05), в то время как к концу 24-часового наблюдения в 1-й группе интраабдоминальное давление составляло 11,2±2,1 мм рт.ст., а в группе сравнения – 14,1±5,7 мм рт.ст. (p≤0,05). На данном этапе у всех пациентов основной группы отмечено достижение бариевой взвеси слепой и ободочной кишки.
К исходу вторых суток лечения у всех пациентов основной группы трансвезикально измеренное давление составило 5,8±1,3 мм рт.ст. (при физиологически допустимых колебания до 7 мм рт.ст.), в то время как среднее значение абдоминального давления в группе сравнения равнялось 10,3±3,9 мм рт.ст. (p≤0,05), а у 7 пациентов имели место признаки гипертензии 1-й степени (значения более 12 мм рт.ст.) и, соответственно, риск развития энтеральной недостаточности. При этом задержка пассажа бариевой взвеси как раз и наблюдалась у данных пациентов, что трактовалось как высокая вероятность оперативного пособия.
Хирургическое лечение в группе сравнения проведено пятерым пациентам: в 2 наблюдениях выполнен лапароскопический адгезиолизис, в 3 – лапаротомия с раздельной назогастральной и интестинальной интубацией кишечника ввиду отсутствия эффекта от проводимой консервативной терапии.
Оперативное лечение в основной группе выполнено в одном наблюдении в объеме адгезиолизиса в рамках плановой герниопластики сетчатым протезом Prolenmesh 30×20 sublay по поводу послеоперационной вентральной грыжи W3MR2 после обследования и подготовки пациента в условиях терапевтического отделения (по срокам наблюдения исключен из исследования). Сроки стационарного лечения в основной группе составили 3,1±0,9, в группе сравнения – 4,8±2,9 суток (р≤0,05). Летальных исходов и осложнений в группах исследования не отмечено.
Заключение
Одним из основополагающих моментов в коррекции энтеральной недостаточности при острой спаечной тонкокишечной непроходимости является восстановление пропульсивного пассажа химуса по пищеварительному тракту, а также коррекция степени внутрибрюшной гипертензии. Приведенные данные позволяют оптимизировать хирургическое лечение больных столь тяжелой и прогностически неблагоприятной категории, избегая напрасных операций и снижая риск дальнейшей травматизации брюшины и прогрессирования спаечного процесса.
Считаем целесообразным применение методики резонансной стимуляции ЖКТ в комплексной терапии спаечной кишечной непроходимости для восстановления перистальтики и разрешения синдромов кишечной непроходимости и энтеральной недостаточности.


