Хламидийная инфекция широко распространена во всех человеческих популяциях земного шара и служит серьезным эпидемиологическим и этиологическим факторами различных заболеваний у взрослых и детей. Многочисленные исследования позволили установить этиопатогенетическое значение хламидийной инфекции в возникновении патологии глаз, центральной, периферической нервной и сердечно-сосудистой систем, опорно-двигательного аппарата, респираторного, пищеварительного и урогенитального трактов [1–8].
Впервые внутриклеточные включения хламидий были обнаружены в клетках плоского эпителия при трахоме в 1907 г. Анализ отдельных фенотипических, культуральных и морфологических признаков привели к открытию в 1957 г. Сhlamydia trachomatis, затем в 1963 г. – Chlamydia psittaci, в 1989 г. – Сhlamydia pneumoniae, в 1993 г. – Сhlamydia pecorum. До 1999 г. порядок Chlamydiales включал одно семейство Chlamydiaceae и один род Chlamydia, куда входили известные к тому времени вышеперечисленные хламидии. С исследованием генома и использованием строгих критериев геносистематики для описания таксономических групп различного уровня привели к открытию новых микроорганизмов с характерным для хламидий циклом развития и к необходимости пересмотра и расширению классификации порядка Chlamydiales. Согласно новой номенклатуре и таксономии хламидий и родственных им микроорганизмов, порядок Chlamydiales уже включает четыре семейства: Chlamydiaceae, Parachlamydiaceae, Simkaniaceae, Waddiaceae. Генетические и фенотипические различия между хламидиями позволили выделить в семействе Chlamydiaceae два рода: род Chlamydia, куда вошла Сhlamydia trachomatis, и два новых вида – Chlamydia muridarum и Chlamydia suis, и род Chlamydophila, включивший Chlamydophila pneumoniaе и Chlamydophila psittaci (прежние названия – Chlamydia pneumoniaе и Chlamydia psittaci), Chlamydophila abortus, Chlamydophila caviae, Chlamydophila felis.
Для человека опасны C. pneumoniae, C. psittaci и С. trachomatis как возбудители заболеваний респираторного и урогенитального трактов человека. Другие виды хламидий, такие как C. аbortus, могут инициировать спорадические аборты у женщин, работавших с овцами, C. felis, являющаяся причиной ринитов и конъюнктивитов у домашних кошек, иногда вызывает те же заболевания и у людей [9].
Хламидии являются облигатными внутриклеточными микроорганизмами, чувствительными к любым клеткам организма человека, где возможно энергетическое паразитирование: различным типам эпителия, фиброцитам, гистиоцитам, эпителиальным, глиальным и мышечным клеткам, плоскому эпителию оболочек мозга и глазного яблока, нейронам, моноцитам, макрофагам и т.д. [9]. Хламидии по своей структуре, химическому составу и энзиматической активности близки к грамотрицательным бактериям, т.к. сохраняют морфологическую сущность на всем протяжении жизненного цикла, имеют клеточную стенку, рибосомы, ДНК, РНК, возможность деления вегетативных форм, характер энзиматической активности, наличие биохимических элементов гликолиза, тканевого дыхания, синтеза пептозы, чувствительность к ряду антибиотиков широкого спектра; наличие общего родоспецифического антигена. Но по многим своим характеристикам хламидии похожи на вирусы, поскольку являются облигатными внутриклеточными паразитами, полностью зависят от хозяина, не культивируются на питательных средах и проходят через бактериальные фильтры, задерживающие другие бактерии. Поэтому долгое время хламидии и определялись как «крупные вирусы».
Несмотря на широкое распространение хламидийной инфекции в человеческих популяциях всего земного шара и вероятность многократного реинфицирования, хламидии нельзя рассматривать как условно-патогенные микроорганизмы, т.е. как оппортунистическую инфекцию, которая довольно часто входит в состав факультативной микрофлоры нормального биоценоза слизистых оболочек. Хламидии обладают всеми атрибутами патогенности, т.к. являются облигатными энергетическими и метаболическими паразитами, вызывают первичную инфекцию, способны к внутриклеточному существованию, продуцируют белковые экзотоксины, в т.ч. и белок теплового шока, способны к персистенции, инвазии, диссеминации, индукции, задержке апоптоза инфицированной клетки.
Хламидии имеют уникальный цикл внутриклеточного развития, не наблюдаемый у других бактерий, и в организме человека они присутствуют в виде нескольких форм (ретикулярные тельца, элементарные тельца, L-формы). Репродукция хламидий представляет собой процесс последовательного образования двух форм возбудителя, отличающихся по морфологическим и биологическим свойствам: элементарных и ретикулярных телец. Элементарные тельца представляют собой мелкие, внеклеточные микроорганизмы, не чувствительные к антибиотикам, метаболически малоактивные, являющиеся инфекционной формой хламидий и предназначенные для внедрения в новые клетки-мишени. Ретикулярные тельца представляют собой более крупные, метаболически активные внутриклеточные образования, чувствительные к антибиотикам, интерферону, и являющиеся репродуктивной формой существования возбудителя.
Ведущий фактор в патогенезе хламидийной инфекции – способность к персистенции (своеобразной L-форме инфекционного процесса, характеризующейся длительным пребыванием возбудителя в макроорганизме в трансформированной форме). Изменчивость хламидийных микроорганизмов обусловлена дефектами клеточного строения, прежде всего полной или частичной потерей клеточной стенки в основном за счет снижения или полного прекращения продукции основного белка наружной мембраны, который является основным иммуногеном хламидий [10]. В условиях персистенции значительно уменьшается метаболическая активность хламидий, вследствие чего наблюдаются задержка роста, приостановка или замедление дифференцировки ретикулярных телец в элементарные тельца.
Формированию персистенции хламидий способствуют различные трансформирующие факторы: неадекватная этиотропная терапия, дефицит метаболитов, неполноценная реализация цитокинового, интерферонового, гидролитического и антимикробного потенциалов макроорганизма. Удаление трансформирующего агента приводит к продолжению репродуктивного цикла развития.
В массе исследовательских работ представлена информация об изменениях иммунного статуса у лиц с заболеваниями урогенитального и нижнего отделов дыхательного тракта. Согласно этим данным, хламидии препятствуют механизмам иммунной защиты, индуцируют иммунодефицитные состояния, что обусловливает развитие тяжелых генерализованных форм, длительную персистенцию возбудителя и присоединение интеркуррентных инфекционных заболеваний [11]. Иммунологические особенности проявления хламидийной инфекции у лиц с заболеваниями верхних дыхательных путей на сегодняшний момент остаются малоизученными.
Для оториноларингологов интерес переставляют С. trachomatis и C. pneumoniae. C. pneumoniaе является первичным респираторным возбудителем, обладающим повышенной тропностью к эпителиальным клеткам верхних и нижних дыхательных путей. Для C. pneumoniaе свойствен аспирационный механизм заражения с реализацией воздушно-капельного пути. Для С. trachomatis свойствен контактный механизм передачи инфекции с реализацией полового, бытового, водного, внутриутробного, интра- и неонатального путей заражения. С учетом многообразия путей передачи хламидийной инфекции наличие больного хламидиозом верхнего отдела респираторного тракта в семье представляет угрозу для заражения других ее членов [12].
По мнению большинства исследователей, диагностика хламидийной инфекции должна быть комплексной, основываться как на прямом выявлении возбудителя, его структур, антигенов и нуклеиновых кислот, так и на косвенном подтверждении инфицирования (определение противохламидийных антител) [13, 14]. Неравнозначное диагностическое значение каждого из методов лабораторной диагностики определяет необходимость их комбинированного использования.
На сегодняшний день не вызывает сомнений, что лечение заболеваний, инициируемых хламидийной инфекцией, должно быть комплексным, включающим этиотропные, симптоматические, иммуномодулирующие средства, эубиотики, но главная роль в лечении хламидийной инфекции все же должна отводиться антимикробным средствам, способным проникать в клетку-мишень, и действовать непосредственно на возбудителя [15].
К группам антибактериальных препаратов, эффективно элиминирующих хламидии, относятся макролиды, тетрациклины, фторхинолоны и рифампицин [16, 17]. Из всех антибиотиков противохламидийного действия для детей наиболее эффективными и безопасными являются препараты группы макролидов, способных накапливаться в очаге воспаления, в инфицированных клетках, нейтрофилах, макрофагах; обладают хорошей переносимостью, низкой токсичностью; оказывают иммуномодулирующее действие, а некоторые из них, в частности азитромицин, – выраженный постантибиотический эффект [18–20].
Важным условием эффективности антихламидийной терапии является выбор адекватных схем применения этиотропных средств, учитывающих длительность воспалительного процесса, вероятность персистирования хламидийной инфекции и фазу репродуктивного цикла, в которой находится возбудитель. В настоящее время существует несколько подходов к этиотропному лечению хламидийной инфекции, включающих как моноантибиотикотерапию, так и комбинацию противомикробных препаратов непрерывными или прерывными курсами. Длительность непрерывного курса антибактериальной терапии может варьироваться от 5 до 21 дня приема препарата. Ряд исследователей рекомендуют однократный прием антибиотика, при этом констатируя этиологическое излечение у 84% больных, однако эта схема вызывает сомнения в корректности организации проведения клинических испытаний [21, 22]. Другие ученые считают целесообразным проведение антимикробной терапии методом «пульс-терапии» по 3 или 4 цикла продолжительностью по 6–7 дней с восстановительным интервалом в 5–6 суток [9]. Цель данного подхода заключается в уничтожении внутриклеточных ретикулярных телец, затем элиминации вновь возникших во время перерыва эрадикационной терапии вегетативных форм хламидий из не чувствительных к антибиотикам элементарных телец.
До сих пор еще не разработаны схемы комплексного лечения и вопросы о рациональных методах этиотропной терапии острых синуситов у детей, ассоциированных с хламидийной инфекцией. Зачастую таким больным нераспознанной хламидийной инфекцией назначают стартовые антибактериальные препараты группы пенициллинов, неэффективные в отношении внутриклеточных возбудителей, что способствует трансформации хламидий в L-формы с последующей персистенцией и хронизацией инфекционного процесса.
Цель настоящего исследования состояла в изучении клинико-иммунологических особенностей острого синусита у детей, ассоциированного с хламидийной инфекцией, с разработкой рационального комплексного подхода к лечению этой патологии.
Материал и методы
Объем группы для изучения частоты выявления хламидий и клинических проявлений этой инфекции составил 58 детей в возрасте от 3 до 15 лет, находящихся на стационарном лечении в ЛОР-отделении с острым верхнечелюстным синуситом (ОВЧС). Для выявления патоиммунологических нарушений группа детей с верифицированной хламидийной инфекцией включила 23 ребенка, лабораторные показатели которых сравнивались с данными 20 больных детей. Лабораторные данные детей с синуситом сравнивались с аналогичными показателями 25 здоровых детей того же возраста.
Результативность разработанной схемы эрадикационной терапии изучалась посредством рандомизированного контролируемого испытания на независимых выборках, общий объем которых составил 28 человек. С помощью таблиц случайных чисел пациенты с подтвержденной хламидийной инфекцией распределялись в опытную и контрольную группы. Критерии включения пациентов в группы исследования: наличие острого гнойного верхнечелюстного синусита, сопряженного с хламидийной инфекцией, и письменное согласие родителей на их участие в клинических испытаниях. Критерии исключения: сочетанная ЛОР-патология, наличие тяжелых сопутствующих соматических заболеваний, проведенная в течение последнего месяца антибактериальная терапия. Необходимый объем групп оценивался по методике А.Б. Файдшмидта, согласно которой обе группы оказались репрезентативными (t=1,99) [23].
Верификация двух видов хламидий (С. trachomatis и C. pneumoniae) осуществлена по разработанному нами алгоритму комплексной лабораторной диагностики. Для непосредственного выявления хламидийных структур (поверхностных антигенов и ДНК) применялись прямой иммунофлуоресцентный анализ и полимеразная цепная реакция. Видоспецифические антитела класса G против основного белка наружной мембраны возбудителя определены с помощью иммуноферментного анализа. Материалом для прямой верификации хламидий стали мазки-соскобы со слизистой оболочки среднего носового хода. Исследование клеточного иммунитета проведено методом непрямой иммунофлуоресценции с использованием моноклональных антител к поверхностным клеточным антигенам лимфоцитов СD3+, СD4+, СD8+, CD16+, CD72+. Концентрацию иммуноглобулинов (Ig) классов M, A и G в крови оценивали методом радиальной иммунодиффузии в геле. Содержание циркулирующих иммунных комплексов (ЦИК) в сыворотке крови изучали методом селективной преципитации.
Анализируемые качественные признаки представлены в виде относительной частоты и 95% доверительного интервала (ДИ). Для описательной статистики количественных признаков применялись методы непараметрической статистики с определением медианы (Ме) и интерквартильного интервала (ИКИ). Для оценки эффективности предложенной схемы антибактериального лечения использованы точный критерий Фишера, определение абсолютных и относительных вероятностей и доверительных интервалов их соотношений.

Результаты и обсуждение
Положительные результаты на наличие хламидийных структур в мазках со слизистой оболочки носа имели место у 28 детей (48%; ДИ – 36–61). C. pneumoniae была выявлена у 23 детей (40%; ДИ – 28–53). C. trachomatis идентифицировалась гораздо реже (р<0,001) и была диагностирована у 9 детей (16%; ДИ – 7–26). Хламидийная микст-инфекция была выявлена у 4 детей (7%; ДИ – 2–15). Половозрастных особенностей в инфицировании детей хламидиями не получено.
Серологические исследование были проведены 20 детям с отрицательными и 27 – с положительными результатами прямых методов идентификации хламидий. От одного ребенка группы детей с неверифицированными хламидиями был получен сомнительный титр противохламидийного IgG к C. pneumoniae. Этот факт, по нашему мнению, связан с наличием либо пассивных следов инфекции в результате перенесенного пневмохламидиоза в прошлом, либо фонового титра антител, обусловленного широкими контактами с хламидиями, не приведшими к развитию инфекции. Ни у одного из детей с наличием положительных маркеров прямых тестов по выявлению хламидийной инфекции не было выявлено видоспецифических хламидийных IgG к C. trachomatis. У 11 (41%) детей также не было обнаружено IgG к C. pneumoniae. Положительный, слабоположительные и сомнительный титры имели место соответственно у 4 (15%), 9 (33%) и 3 (11%) детей. Сильно положительных титров не выявлено ни у одного из детей. Таким образом, только у 15% детей уровни специфических антител класса G соответствовали диагностическому титру.
У всех серопозитивных детей с острым синуситом срок заболевания не превышал 2 недель. Беря во внимание тот факт, что специфические IgG к хламидиям при остром процессе начинают появляться к концу третьей недели после инфицирования, наличие позитивных результатов можно истолковать как свидетельство более ранней контаминации слизистой оболочки верхних отделов респираторного тракта хламидиями с развитием различной патологии верхних отделов дыхательных путей. Тем более что у 12 из 16 детей с выявленными противохламидийными антителами (75%; ДИ – 52–92) имелись сопутствующие хронические заболевания глотки, такие как хронический аденоидит и гипертрофия небных миндалин.
Хламидии значительно чаще диагностировались у детей с продолжительностью заболевания от 7 до 14 дней (р=0,001), тогда как в более поздние сроки от предполагаемого начала заболевания различий в частоте выявления хламидий обнаружено не было (р=0,1). Это может быть связано с тем, что дети, поступившие в ЛОР-отделение, с длительностью заболевания свыше 2 недель, в амбулаторных условиях получали эмпирическую и неадекватную этиотропную терапию, способствующую персистенции хламидий.

У детей с острым синуситом независимо от наличия или отсутствия хламидий наблюдались схожие жалобы и клиническая симптоматика. Но дети с ОВЧС, ассоциированным с хламидийной инфекцией, чаще предъявляли жалобы на боли в области пораженных пазух, лба, корня носа (54 против 23%; р=0,02). Кроме этого у инфицированных хламидиями детей были более выражены системные реакции на инфекцию, проявляющиеся повышением температуры тела почти у половины детей (13 человек; 46%). Тогда как в группе детей, у которых наличие хламидий не было подтверждено, температурная реакция имела место только у 6 детей (20%; р=0,03).
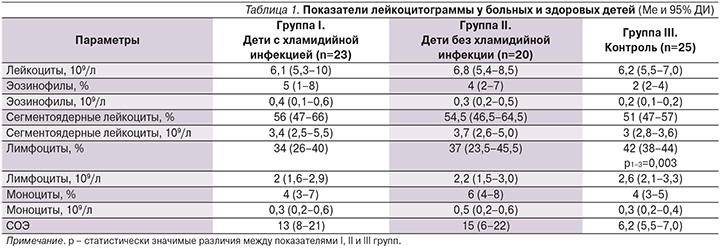
При сравнении средних показателей лейкоцитограммы больных острым синуситом детей с контролем независимо от наличия или отсутствия хламидийной инфекции никаких различий в содержании отдельных клеток крови обнаружено не было (табл. 1).
Исключение составили только относительные показатели лимфоцитов, которые были значительно ниже у больных детей с идентифицированными хламидиями по сравнению со здоровыми детьми. Различия в показателях иммунного статуса (табл. 2) касались только детей, у которых острое воспаление верхнечелюстных пазух было сопряжено с хламидийной инфекцией.
Так, у них по сравнению со здоровыми детьми имело место значимое повышение относительного содержания Т-клеток CD8+ (р=0,003). При сравнении показателей гуморального иммунитета установлено статистически значимое повышение уровня IgA (р<0,001) у детей как с верифицированной хламидийной (Ме=2,5; ИКИ 1,4–3,6), так и с неподтвержденной хламидийной инфекциями (Ме=2,0; ИКИ – 1,5–2,5) по сравнению со здоровыми лицами (Ме=0,8; ИКИ – 0,5–1,2).
Схема лечения детей с ОВЧС, ассоциированным с хламидийной инфекцией, включала эрадикационную терапию, иммуно-, биокоррекцию и физиотерапию. Был проведен сравнительный анализ эффективности антибактериального лечения хламидийной инфекции у детей с ОВЧС в зависимости от применения моно- или полиантибиотикотерапии препаратами макролидной группы. Детям опытной группы назначалась цикличная полиантибиотикотерапия, заключающаяся в последовательном применении двух антибиотиков: азитромицина в течение 5 дней (10 мг/кг в 1-й день, в последующие дни – по 5 мг/кг 1 раз в сутки), затем после 5-дневного перерыва – джозамицин в течение 10 дней (40 мг/кг, разделенные на 2 приема). Дети контрольной группы получали один антибиотик – джозамицин в течение 14 дней.
Перед началом медикаментозного лечения всем детям проведено физиолечение с применением низкоинтенсивного лазерного излучения с использованием аппарата магнитноинфракрасной лазерной терапии «РИКТА». При воздействии лазерного облучения на ткани улучшается микроциркуляция, раскрываются коллатерали, активизируется трофика, нормализуется нервная возбудимость, а самое важное – повышается чувствительность хламидий к антибиотикам вследствие выхода микроорганизмов из состояния возможной персистенции. При остром синусите детям проведено облучение в течение 2 минут области передних стенок верхнечелюстных пазух и эндоназальное воздействие в течение 3 минут.
Учитывая стандартные схемы лечения хламидийного поражения урогенитального тракта, а также результаты проведенных нами исследований иммунного ответа у детей с респираторным хламидиозом, указывающие на выраженный дисбаланс в клеточном звене, обусловленный активацией CD8+Т-лимфоцитов, и недостаточно выраженную активность гуморального иммунитета, в схему лечения были включены иммунокорректоры [24]. Больным детям по схеме назначался Циклоферон (меглюмина акридонацетат), который является индуктором эндогенного интерферона и выполняет важную роль в борьбе с внутриклеточной хламидийной инфекцией, активируя макрофаги, усиливая эффекторные функции естественных киллеров, нейтрофилов, повышая резистентность клеток к внутриклеточным микроорганизмам, стимулируя выработку интерлейкина-1 (ИЛ-1), ИЛ-2 и иммуноглобулинов. Кроме Циклоферона в комплекс лечения инфицированных хламидиями детей был включен Иммунал в возрастной дозировке в течение 30 дней. Данный препарат служит неспецифическим иммуномодулятором растительного происхождения, обладает противовирусным действием, повышает активность фагоцитов.
Для повышения барьерного иммунитета, фагоцитарной активности макрофагов, увеличения содержания лизоцима и восстановления нарушенной колонизационной резистентности слизистой оболочки верхнего отдела респираторного тракта у детей с верифицированной хламидийной инфекцией в течение 14 дней применен местный иммуномодулятор микробного происхождения ИРС 19. Учитывая факт достаточно длительного применения антибиотиков, с целью профилактики и восстановления, возможных дисбиотических нарушений в микрофлоре пищеварительного тракта всем детям назначался пробиотик Линекс по 1 капсуле 3 раза в сутки 14 дней.
Дополнительно в комплекс лечения детей с острым гнойным воспалением пазух входило проведение оториноларингологических лечебных мероприятий (пункции, промывание носа методом перемещения по Проетцу и пр.).
В ходе проведенного клинического исследования осложнения и побочные эффекты не выявлены ни у одного из пациентов. Положительный результат лечения оценивался по данным бактериологической эрадикации хламидий. В табл. 3 сопряженности представлены результаты рандомизированного контролируемого исследования по изучению эффективности поли- и моноантибиотикотерапии детей с острым синуситом.
У детей, получавших один антибиотик, эффективность лечения оказалась значительно ниже, чем у детей, получавших полиантибиотикотерапию. Так, микробиологическое выздоровление детей, у которых в комплексное лечение входил только один джозамицин, имело место у 41,7% (ДИ – 16,5–69,4), тогда как у детей, получавших азитромицин и джозамицин, проведенная терапия оказалась эффективной для 87,5% (ДИ – 67,5–98,7). Проверка нулевой гипотезы о вероятности отрицательного результата лечения разработанным методом, учитывая объем выборок, осуществлялась с применением точного критерия Фишера. Результаты теста показали, что с 99,9%-ной доверительной вероятностью (р=0,01) следует принять альтернативную гипотезу о существовании различий между основной и контрольной группами (р=0,001).
Абсолютная вероятность получения положительного результата в основной и контрольной группах составила соответственно 0,88 и 0,42. Разность относительных частот и относительная вероятность составили соответственно 0,46 (терапевтический эффект) и 2,2. Различия между группами определены тремя способами: расчетами ДИ для разности абсолютных вероятностей, ДИ для отношения относительной вероятности и ДИ отношения шансов, которые составили соответственно 0,12–0,80; 1,02–4,35 и 1,38–69,71. Так как ДИ для разности абсолютных вероятностей не включает ноль, а ДИ для отношения относительной вероятности и отношения шансов правее единицы, следовательно, различия между группами статистически значимые.
Заключение
Проведенное исследование показало высокую частоту выявления хламидийной инфекции у детей, госпитализированных по поводу ОВЧС, – почти у половины лиц. В структуре видового распределения удельный вес хламидофильной инфекции в 2,5 раза превышал долю C. trachomatis.
У седьмой части детей острым синуситом имела место хламидийная микстинфекция.
У детей с острым синуситом, получавших с первых же дней заболевания в амбулаторных условиях антимикробную терапию, оптимальным сроком для выявления хламидийной инфекции является длительность заболевания, не превышающая 2 недель.
В более поздние сроки индикация хламидий проблематична, что связано с трансформирующим действием на хламидии неадекватного антимикробного лечения, способствующего персистенции микроорганизма в виде L-форм. Кроме этого эмпирически назначаемая этиотропная терапия, затрудняющая диагностику хламидийной инфекции, искажает истинную частоту выявления хламидий.
Клиническая картина острых синуситов у детей с подтвержденным лабораторными методами хламидийным инфицированием слизистой оболочки носа не имеет ярковыраженной специфики. К особенностям, характеризующим клинику ОВЧС у детей, сопряженного с хламидийной инфекцией, относятся более частые жалобы на болевые ощущения в области пораженных пазух, лба и переносицы на фоне более выраженных симптомов общей интоксикации в виде повышения температуры тела.
У детей с идентифицированными хламидиями при остром синусите имеет место наличие дисбаланса в клеточном звене иммунитета, проявляющегося относительной лимфопенией, указывающей на бóльшую выраженность инфекционно-токсических процессов, по сравнению с детьми, у которых наличие хламидий подтверждено не было. Кроме этого у детей с верифицированными хламидиями наблюдается повышение уровня Т-лимфоцитов CD8+, осуществляющих элиминацию организма от внутриклеточной инфекции, в т.ч. и от хламидий. У детей с ОВЧС независимо от наличия или отсутствия хламидийного возбудителя имеет место повышение уровня сывороточного IgA, что указывает на активацию гуморального звена иммунитета. Повышение уровня сывороточного IgA у детей с идентифицированными хламидиями, возможно, связано с тем, что последние не являются единственным этиологическим агентом, а выступают в роли ассоциантов с другой внеклеточной инфекцией.
Лечение хламидийных поражений околоносовых пазух у детей должно быть комплексным и включать применение антимикробных препаратов, иммуномодуляторов, местного лечения, физиопроцедур, пробиотиков. Результаты проведенного контролируемого клинического исследования показали высокую эффективность и целесообразность использования в практической медицине цикличной полиантибиотикотерапии макролидами ОВЧС, ассоциированного с хламидийной инфекцией, у детей, позволяющей добиваться клинико-микробиологического выздоровления в 87,5% случаев. Поскольку прямые тесты на хламидийные антигены и ДНК остаются положительными в течение 1,5 месяцев после лечения, этиологический контроль выздоровления должен осуществляться также через 1,5 месяца после проведенной антихламидийной терапии.


