Вступление
Болезнь Паркинсона (БП) – нейродегенеративное заболевание, которое помимо двигательных расстройств сопровождается широким спектром немоторных проявлений, важное место среди которых занимают когнитивные нарушения – КН [4, 8, 10].
Согласно результатам проведенных исследований, КН разной степени выраженности (легкие, умеренные, тяжелые когнитивные расстройства) выявляются при обследовании у 90–95% больных БП [1, 3, 15]. Относительно частоты представленности тяжелых когнитивных расстройств или деменции при БП (БПД) данные противоречивы. Так, мета-анализ 13 популяционных исследований показал, что средняя распространенность деменции у пациентов с БП составляет 31,5% [20]. Таким образом, риск развития деменции у больных БП в 5–6 раз выше, чем у лиц того же возраста в общей популяции [10]. Однако многолетнее наблюдение за пациентами с БП показало, что деменция отмечается у 83% пациентов, что делает ее связь с БП почти обязательной [22].
Деменция – синдром, характеризующийся приобретенным снижением интеллекта на фоне ясного сознания, которое возникает в результате органических повреждений головного мозга и приводит к нарушению социальной адаптации пациента, т.е. делает его не способным к продолжению профессиональной деятельности и/или ограничивает возможности самообслуживания, нарушает его бытовую независимость, согласно DSM-IV (Diagnostic and Statistical Manual of mental disorders IV).
Развитие деменции ограничивает возможности медикаментозного лечения (применение амантадинов, холинолитиков, агонистов дофаминовых рецепторов при деменции часто невозможно) и нейрохирургического лечения моторных проявлений БП [2]. Согласно проведенным исследованиям, риск летального исхода в 2 раза больше у пациентов с БПД по сравнению с БП; финансовые расходы на лечение пациентов при присоединении деменции возрастают в 3,3 раза (наибольший прирост расходов связан с уходом за больными) [27].
На данный момент нет единого мнения о причинах развития деменции при БП. Высказываются различные мнения: деменция при БП – обязательное следствие развития болезни [13, 22], деменция при БП не связана с данным заболеванием и возникает в результате сочетания БП и болезни Альцгеймера – БА [21], деменция при БП является недиагносцированным вариантом деменции с диффузными тельцами Леви – ДТЛ [19], деменция при БП – результат наложения на КН при БП возрастных нейродинамических изменений когнитивных функций [1].
Цель исследования: оценить гетерогенность деменции при БП.
Задачи исследования:
- Оценить качество когнитивных расстройств у пациентов с сочетанием БП и деменции.
- Оценить частоту представленности форм БП (акинетикоригидная, дрожательная, смешанная) у пациентов с БПД, а также зависимость типа КН от формы паркинсонизма.
- Оценить выраженность деменции в зависимости от возраста и образования пациентов, длительности и стадии БП, возраста дебюта длительности деменции, сосудистых факторов риска.
- Оценить динамику КН у пациентов с БПД в течение 2 лет.
- Оценить влияние на КН при БПД сосудистых факторов риска.
Материал и методы
В исследование были включены 50 пациентов с БП и деменцией (деменция дебютировала не ранее 2 лет от момента появления моторных проявлений БП). Диагноз БП устанавливался в соответствии с критериями UK Brain Bank(UK Brain Bank, 1992) и A.J. Hughes и соавт. (1992); диагноз деменции – в соответствии с критериями МКБ-10, DSM-IY и Клиническими диагностическими критериями диагностики деменции, ассоциированной с БП [20]. Средний возраст пациентов составил 73,2±6,1 года. Средняя длительность БП на момент включения пациентов в исследование составила 6,6±2,8 года, средняя длительность деменции – 2,1±1,5 года (табл. 1).

Всем пациентам выполнено клиническое неврологическое обследование. Выраженность двигательных расстройств оценивалась с помощью шкал Hoehn-Yahr и UPDRS. Выраженность КН оценивалась с помощью нейро-психологических шкал [29] (табл. 2).
Выполнено детальное соматическое обследование пациентов, а также инструментальное обследование, включившее общий и биохимический анализы крови, электрокардиограмму, магнитно-резонансную томографию с использованием стандартных режимов (Т1- и Т2-взвешенное изображение).
Согласно приведенному протоколу, пациенты осматривались при включении в исследование и далее раз в год. Через год обследование выполнено 40 пациентам, через 2 года осмотрены 20 пациентов. Помимо указанных параметров анализировалась смертность пациентов и факторы, оказывающие на нее влияние.
Статистическая обработка данных проведена с помощью IBM SPSS 17; использованы методы описательной, корреляционный анализ, однофакторный дисперсионный анализ.
Результаты исследования
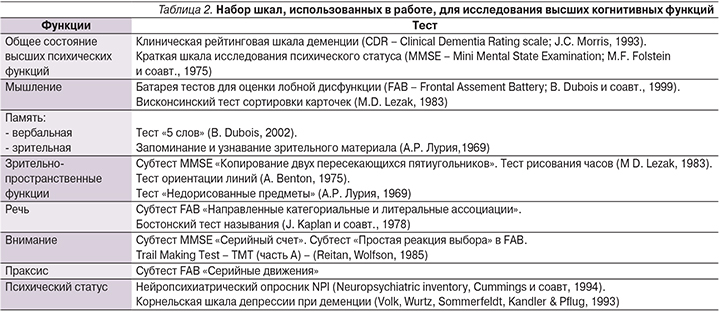
Качественный анализ данных неврологического осмотра и нейропсихологического тестирования позволил разделить пациентов на 4 группы с различным паттерном когнитивных расстройств. Статистический анализ показал достоверное отличие между группами по признакам, положенным в основу классификации (рис. 1):
- группа 1 (20 пациентов) – пациенты с преобладанием дизрегуляторных когнитивных расстройств, проявлявшихся в трудностях обобщения, решения задач планирования, разработки, переключения и поддержания выбранной стратегии. Выполнение заданий улучшалось при условии внешней подсказки;
- группа 2 (7 пациентов) – пациенты, у которых дизрегуляторные расстройства сочетались с поведенческими нарушениями: расторможенностью, агрессией, раздражительностью.
У этих пациентов преобладала лобная дисфункция, проявлявшаяся как инертностью, так и импульсивностью психических процессов (значительные трудности при выполнении теста FAB, снижение числа выложенных категорий и увеличение числа хаотических ответов в Висконсинском тесте) в сочетании с выраженными нейродинамическими расстройствами (согласно выполнению тестаTMT [часть А]); - группа 3 (18 пациентов) – пациенты с выраженными зрительно-пространственными расстройствами и нейродинамическими нарушениями, повышенной чувствительностью следа памяти к интерференции, а также флюктуациями выраженности КН;
- группа 4 (5 пациентов) – пациенты с первичными гиппокампальными нарушениями памяти (снижение объема отсроченного воспроизведения запоминаемого материала по сравнению с объемом непосредственного воспроизведения в сочетании с посторонними вплетениями и неэффективностью семантического опосредования. У пациентов этой группы не было выявлено значительного снижения зрительно-пространственных функций и флюктуации выраженности когнитивных расстройств.
Проведенный статистический анализ позволил выявить достоверные различия между группами (табл. 3).
Так, тяжесть моторных проявлений и длительность БП были сопоставимыми у пациентов групп 1, 2 и 3 и достоверно меньше в группе 4.
Пациенты группы 2 были достоверно моложе, чем пациенты других групп (р<0,047). Деменция у пациентов этой группы развилась в достоверно более молодом возрасте (р=0,06), отличалась большей выраженностью и предположительно быстрым прогрессированием (р=0,02). Пациенты этой группы также имели достоверно бóльшую наследственную отягощенность по БП и деменции.
Пациенты, составившие группу 4, были достоверно старше пациентов остальных групп; дебют деменции также был отмечен в более старшем возрасте. У пациентов этой группы не было отмечено случаев паркинсонизма у ближайших родственников, однако наследственный анамнез был отягощен по деменции.
Выраженность КН у пациентов группы 1 была меньше, в то же время пациенты этой группы достоверно отличались большей представленностью, тяжестью сердечно-сосудистых расстройств и сосудистых факторов риска (р=0,000), наличием и выраженностью признаков сосудистого поражения головного мозга при нейровизуализации и большей выраженностью, не связанной с паркинсонизмом неврологической патологии (анизорефлексия, мозжечковый синдром и т.д.; р=0,000).
Пациенты группы 3 отличались от таковых других групп большей выраженностью вегетативных нарушений, преимущественно – ортостатической гипотензии (р=0,000), и нарушений мочеиспускания (р=0,01), а также большей выраженностью постуральных расстройств со склонностью к падению назад.
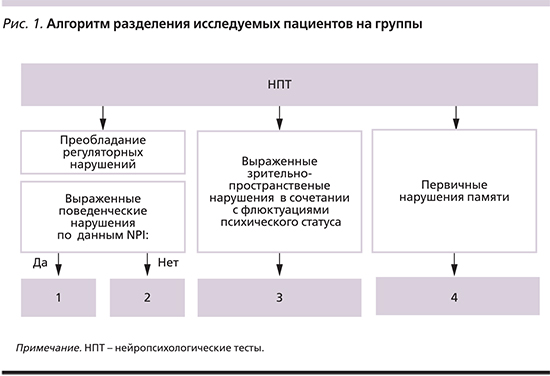
Анализ характера двигательных расстройств у пациентов исследуемых групп показал, что смешанная форма БП была отмечена у 58%, акинетикоригидная – у 42% пациентов. Ни в одном из случаев не было зафиксировано дрожательной формы БП. Анализ распределения формы БП у пациентов исследуемых групп позволил выявить достоверные различия. Так, у пациентов групп 1 и 2 достоверно чаще отмечалась смешанная форма БП (р<0,05), в то время как у пациентов групп 3 и 4 преобладала акинетикоригидная форма БП (рис. 2).
Вне зависимости от возраста дебюта деменции и БП у всех пациентов тяжесть деменции зависела от ее длительности (р<0,05). Не было выявлено зависимости между тяжестью деменции и возрастом ее дебюта, уровнем образования, возрастом пациентов и числом сосудистых факторов риска, тяжестью и длительностью паркинсонизма.

Наличие и выраженность сопутствующей сердечно-сосудистой патологии определяли тип когнитивных расстройств, но не оказывали влияния на дальнейшее прогрессирование деменции. Следует отметить, что за время наблюдения ни у одного из пациентов не было зафиксировано утяжеления сопутствующей сердечно-сосудистой патологии. Была установлена связь между выраженностью сопутствующей сердечно-сосудистой патологии и выраженностью неврологических расстройств, не связанных с паркинсонизмом (р=0,004), а также флюктуаций выраженности когнитивных расстройств (р=0,007).
При повторном осмотре прогрессирование деменции было выявлено у 90% пациентов. Выраженность двигательных расстройств достоверно увеличилась только в группе 2 (р=0,04), у пациентов групп 1, 3 и 4 тяжесть паркинсонизма осталась прежней.
Динамика изменения когнитивных и моторных функций в выделенных группах отображена в табл. 4.
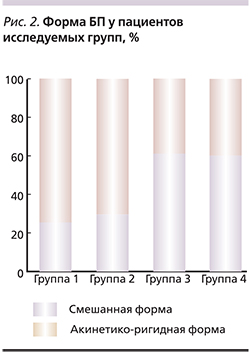 Прогрессирование КН имело качественные отличия у пациентов исследуемых групп. Так, у пациентов группы 1 отмечено достоверное нарастание нейродинамических расстройств (по результатам пробы Шульте; р=0,017).
Прогрессирование КН имело качественные отличия у пациентов исследуемых групп. Так, у пациентов группы 1 отмечено достоверное нарастание нейродинамических расстройств (по результатам пробы Шульте; р=0,017).
У пациентов групп 2 и 3 ухудшение проявлялось преимущественным нарастанием дизрегуляторных расстройств (уменьшение суммарного балла в FAB в группе 2 на 4,4; р=0,05, в группе 3 – на 4,7 балла; р=0,03).
Паттерн КН изменился при втором осмотре – у10% у пациентов с лобно-подкорковыми нарушениями развились первичные гиппокампальные нарушения памяти.
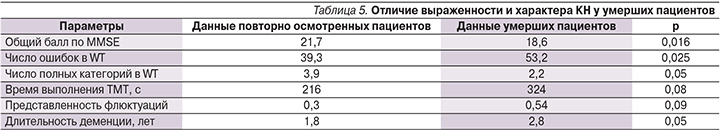
В течение двух лет наблюдения умерли 11 пациентов, из них 6 – из группы 3; 4 – из группы 1; 1 – из группы 4 (8 мужчин, средний возраст – 75,4±6,4 года, и 3 женщины, средний возраст – 74±2,6 года). Однофакторный дисперсионный анализ показал, что у умерших пациентов были достоверно больше длительность деменции (р=0,05), и выраженность КН (общий балл – MMSE; р=0,016). При этом в профиле КН были отмечены бóльшая выраженность регуляторных (число ошибок; p=0,025, и выложенных полных категорий WT; р=0,05) и нейродинамических (ТМТ; р=0,08) расстройств, а также бóльшая выраженность и частота флюктуаций (р=0,09) (табл. 5).
Обсуждение
Проведенное исследование показало, что деменция при БП гетерогенна, при этом разный характер КН определяет в т.ч. прогноз и продолжительность жизни пациентов [4, 28]. Различие КН и как следствие – различие патоморфологического субстрата деменции требуют дополнительного обсуждения [17].
Так, часть пациентов с БПД (40%) – пациенты группы 1, в настоящем исследовании демонстрировали преимущественно нейродинамические и регуляторные когнитивные расстройства, что свидетельствует о преимущественном страдании подкорковых структур, а также лобных долей и лобно-подкорковых связей [1, 7, 23]. Указанные нарушения сочетались с негрубыми зрительно-пространственными расстройствами, преимущественно в виде пространственной дисгнозии и конструктивной диспраксии.
Происхождение зрительно-пространственных расстройств при БП требует дополнительного уточнения. Так, традиционно зрительно-пространственные расстройства связывают с дисфункцией теменно-затылочной коры, в то время как лобно-подкорковые нарушения являются прямым следствием гибели серого вещества базальных ганглиев и лобной коры. Гибель нейронов компактной части черной субстанции снижает ее угнетающее влияние на полосатые тела, которые в свою очередь обеспечивают связь между ассоциативными зонами афферентных (теменно-височно-затылочных) и эфферентных (лобных) отделов коры. Таким образом, чаще всего зрительно-пространственные нарушения при БП являются следствием поражения базальных ганглиев и их связей, в то время как сама теменно-затылочная кора не страдает [1, 4, 6, 8, 18, 20].
В эмоционально-поведенческой сфере пациентов этой группы преобладали снижение фона настроения (депрессия), тревога, апатия, галлюцинации, эмоциональная лабильность.
Указанные когнитивные и эмоциональные нарушения типичны для БП и, наиболее вероятно, являются ее прямым следствием [9, 20]. Так, известно, что основной момент патогенеза БП – гибель нейронов компактной части черной субстанции и ослабление ингибирующего влияния черной субстанции на полосатые тела [7]. Поскольку полосатые тела в свою очередь интегрированы в фронто-стриарные нейрональные круги, объединяющие префронтальные отделы лобной коры, полосатые тела, черную субстанцию, бледный шар, зрительный бугор, а опосредованно – и теменно-затылочную кору, в единый функциональный комплекс, чрезвычайно важный для формирования когнитивных процессов; наступление деменции при прогрессировании БП должно быть облигатным [8].
Однако проведенное нами исследование позволило поставить под сомнение происхождение деменции при БП только как следствие БП. Так, у пациентов, демонстрировавших типичные для БП КН, не было выявлено связи между выраженностью когнитивных и двигательных расстройств, а также длительностью болезни. Наряду с этим у них отмечались достоверно более выраженные сердечно-сосудистые расстройства и представленность сосудистых факторов риска. Повторный осмотр не показал выраженного прогрессирования как КН, так и сердечно-сосудистой патологии у этих пациентов, при этом небольшое ухудшение касалось в основном выраженности нейродинамических расстройств. Полученные нами результаты позволяют предположить, что деменция в данном случае смешанная и возникает как следствие взаимного усиления КН при сочетании церебрального сосудистого и нейродегенеративного поражения. Сходная точка зрения высказывалась и другими исследователями [1, 5].
Пациенты (14%) с типичными для БП КН (нейродинамические, регуляторные и зрительно-пространственные расстройства) демонстрировали также выраженные лобные симптомы – импульсивность, повышенную отвлекаемость и расстройства поведения (возбуждение, эмоциональную лабильность, расторможенность, аномальную двигательную активность, нарушение пищевых привычек). Несколько бóльшая выраженность зрительно-пространственных расстройств у этих пациентов также, наиболее вероятно, была следствием импульсивности. Так, они хуже справлялись с тестом «Рисование часов», однако тест «Перерисовывание часов» выполняли значительно успешнее, чем пациенты группы 1. Таким образом, на основании имевшихся у этих пациентов когнитивных, эмоциональных и поведенческих расстройств мы предполагаем, что деменция в данном случае является следствием поражения не только базальных ганглиев, но и в значительной степени лобной коры. При этом поражение лобной коры затрагивает как медиобазальные, так и орбито-фронтальные ее отделы, что объясняет сочетание инертности и импульсивности у пациентов при выполнении нейропсихологических проб, равно как и широко представленные расстройства поведения [1, 4, 23].
При повторном осмотре было зафиксировано одновременное нарастание выраженности двигательных, когнитивных и поведенческих нарушений, что принципиально отличает развитие деменции в данном случае от такового у пациентов группы 1 и свидетельствует о прогрессирующем нейродегенеративном процессе. Анализ наследственного фактора показал, что у этих пациентов имели место случаи развития БП и деменции у близких родственников. Все перечисленное выше заставило нас предположить, что в данном случае, наиболее вероятно, деменция не служит следствием БП и, возможно, эти пациенты являются пациентами с особым вариантом течения лобно-височной дегенерации. Несомненно, эти предположения требуют дальнейшего генетического подтверждения [25].
Совершенно другой характер когнитивных расстройств в нашем исследовании имели 36% пациентов: нейродинамические и дизрегуляторные нарушения сочетались с выраженными зрительно-пространственными расстройствами, истощаемостью когнитивной деятельности, нарушениями памяти по типу повышенной тормозимости следа памяти интерферирующим воздействием, а также легко представленными нарушениями речи (снижение беглости речи, семантическая, амнестическая, сенсорная афазии). Указанные нарушения сочетались с вегетативными нарушениями (самым частым проявлением была ортостатическая гипотензия и расстройства мочеиспускания) и зрительными галлюцинациями (100% пациентов).
Флюктуации, или колебания выраженности двигательных и КН, также достоверно чаще развивались в этой группе. Наряду с колебаниями выраженности двигательных и когнитивных расстройств в течение суток возникали эпизоды спонтанного нарастания клинических проявлений заболевания. Эти периоды декомпенсации длились от нескольких дней до нескольких недель и заканчивались спонтанным улучшением состояния, если не приводили к смерти больного. В момент флюктуации отмечалось достоверное нарастание выраженности зрительно-пространственных (р=0,002), нейродинамических (р=0,03), вегетативных расстройств (р=0,05), а также выраженность сопутствующей сердечно-сосудистой патологии (р=0,007).
Таким образом, у этих пациентов нейродегенеративный процесс захватывал подкорковые ганглии, их связи в передними отделами головного мозга, кору передних отделов головного мозга, неспецифические стволовые структуры, а также структуры гиппокампового круга [1, 6]. Подобный вариант деменции при БП описывают и другие исследователи [11, 15, 18, 19]. Клинически и морфологически этот вариант БПД не отличим от ДТЛ.
По данным литературы, ДТЛ и БПД объединяет много патоморфологических и клинических особенностей: нейропсихиатрические симптомы [9], тип и тяжесть моторных проявлений [11], нарушения сна [9], вегетативные нарушения [6], гиперчувствительность к нейролептикам [4, 8, 11, 18]. Согласно общепринятым международным критериям, ДТЛ должна диагностироваться, когда деменция развивается перед или конкурирует с паркинсонизмом, при этом временной промежуток между развитием деменции и паркинсонизма не превышает двух лет, и БПД – когда деменция развивается в рамках установленной БП через 2 года или более от дебюта двигательных симптомов; по данным литературы, также используется интервал 1 год [20]. Очевидно, что этот критерий весьма условен и зачастую БПД и ДТЛ – две клинические сущности одного нейродегенеративного процесса [18]. Более позднее развитие когнитивных расстройств при БП с деменцией в сочетании с флюктуациями психического статуса, зрительными галлюцинациями, вегетативными расстройствами предположительно может свидетельствовать о более медленном распространении дегенеративного процесса [14].
Из умерших пациентов 55% имели данный тип КН. Высокая смертность связана с наличием у них вегетативных расстройств и флюктуаций психического статуса.
Наконец, незначительное число пациентов (10% пациентов, группа 4) демонстрировали легкие подкорковые нарушения, которые сочетались с первичными гиппокампальными нарушениями памяти, а также с выраженными больше, чем у всех остальных включенных в исследование пациентов, речевыми расстройствами (семантическая, амнестическая афазии). Согласно исследовательским критериям БА (NINDS-ADRDA – National Institute of Neurological and Communicative Disorders and Stroke-Alzheimer’s Disease and Related Disorders Association), для установления БА необходимо наличие прогрессирующих нарушений памяти со слов пациента и/или его родственников, подтвержденное нейропсихологическим исследованием. При этом нарушения памяти должны иметь гиппокампальный характер – при таком типе нарушений памяти отмечается снижение объема воспроизведения заученного материала со временем, а также неэффективность семантического опосредования и посторонние вплетения. Указанные клинические особенности должны сопровождаться результатами инструментальных исследований, подтверждающими альцгеймеровский характер нейродегенерации: снижение уровня амилоидного белка в спинномозговой жидкости, повышение содержания амилоидного белка в веществе головного мозга (позитронно-эмиссионная томография), атрофия коры височных, теменных и затылочных долей больших полушарий головного мозга (магнитно-резонансная томография). БА – самая частая причина деменции и одно из самых распространенных заболеваний пожилого возраста. Заболеваемость ею увеличивается от 1,2 случая на 1000 населения в возрасте 65–69 лет до 53,3 – в возрасте 90 лет и старше [1, 4, 8, 17, 21].
Таким образом, на основании полученных данных можно предположить, что у этих пациентов имело место сочетание БП и БА, при этом деменция была результатом именно БА. Это предположение подтверждает не только характер КН, идентичных таковым при БА, но и тот факт, что наследственный анамнез этих пациентов позволил зафиксировать у них достоверно более частые случаи деменции у близких родственников по сравнению с таковыми других исследуемых групп. Пациенты с предположительным сочетанием БА и БП были старше других включенных в исследование пациентов, при этом выраженность двигательных симптомов паркинсонизма у них была меньше, что также свидетельствует в пользу нашей гипотезы. При анализе характера и выраженности КН через 2 года наблюдений паттерн когнитивных расстройств не изменился качественно: отмечалось лишь нарастание выраженности существующих КН. Выраженность двигательных расстройств при этом не изменилась. Несомненно, подтверждение этой гипотезы требует инструментального подтверждения и выявления изменения концентрации амилоидного белка в спинномозговой жидкости и веществе головного мозга.
Интересен тот факт, что у 10% пациентов, первоначально демонстрировавших только нейродинамические, регуляторные и зрительно-пространственные когнитивные расстройства, через 2 года наблюдения были зафиксированы первичные гиппокампальные нарушения памяти. Полученные результаты можно объяснить с помощью теории H. Braak [14], согласно которой дегенеративный процесс при БП последовательно захватывает мозговые структуры, начиная с обонятельных луковиц, вегетативных ядер ствола и далее – компактную часть черной субстанции, полосатые тела, нейроны коры передних отделов головного мозга, ассоциативные зоны коры теменных отделов, а также лимбическую систему. Однако, возможно, нарушения в данном случае можно объяснить и сосуществованием двух патологических процессов – БП и присоединившейся БА [1, 4, 8, 17].
Проведенное нами исследование показало, что у пациентов с преимущественно лобно-подкорковым типом когнитивных расстройств преобладала смешанная (акинетикоригидно-дрожательная) форма БП, в то время как у пациентов, демонстрировавших когнитивный дефект, сходный с таковым при ДТЛ и БА, отмечалась преимущественно акинетикоригидная форма паркинсонизма. Согласно результатам гистохимических исследований предыдущих лет [7], у больных БП с выраженным тремором покоя на фоне низкого содержания дофамина в стриатуме и наружном сегменте бледного шара отмечается нормальное или даже повышенное содержание дофамина во внутреннем сегменте бледного шара, тогда как при акинетикоригидной форме отмечается равномерное снижение содержания дофамина во всех подкорковых структурах. Таким образом, акинетикоригидная форма более неблагоприятна в отношении развития и прогрессирования деменции [12, 16, 26], что подтверждается в т.ч. и данными выполненного нами исследования.
Анализ скорости прогрессирования деменции при БП показал ее значительную вариабельность. Максимальная скорость развития когнитивных расстройств была зафиксирована у пациентов, имевших флюктуации выраженности КН, выраженные зрительно-пространственные расстройства, первичные гиппокампальные нарушения памяти. Сочетание выраженной деменции, вегетативных нарушений, флюктуаций был фактором, определившим негативный прогноз заболевания и повысившим смертность пациентов. Таким образом, наше исследование позволяет предположить, что именно анализ характера КН при БПД может достаточно точно определять как последующую скорость развития КН, так и прогноз при этом заболевании. Отсутствие ожидаемых корреляций с тяжестью моторных проявлений БП и длительностью заболевания в большинстве случаев БПД свидетельствует о том, что деменция не только является результатом поражения экстрапирамидной системы и ее связей с другими отделами головного мозга, но и представляет собой гораздо более распространенный нейродегенеративный процесc [4, 8, 11, 14].
Нарастание выраженности двигательных расстройств, напротив, приводило к преимущественной отрицательной динамике регуляторных и нейродинамических функций. Эти результаты легко объяснимы, учитывая морфологическую общность указанных когнитивных симптомов и двигательных проявлений БП, а также прогрессирующую с течением времени дегенерацию подкорковых и лобных структур, а также их связей [7, 23]. Совокупное страдание когнитивных и двигательных функций подтверждает также достоверное нарастание тяжести деменции со временем вместе с нарастанием выраженности двигательных расстройств при преимущественно нейродинамически-регуляторном паттерне КН.


